象山港人工鱼礁投放对大型底栖动物群落结构的影响*
2014-03-09廖一波曾江宁高爱根江志兵陈全震严小军
廖一波 曾江宁 寿 鹿, 高爱根 江志兵 陈全震 严小军
(1.宁波大学海洋学院 宁波 315211;2.国家海洋局第二海洋研究所 国家海洋局海洋生态系统与生物地球化学重点实验室杭州 310012;3.南京师范大学生命科学学院 南京 210097)
人工鱼礁是世界各国普遍采用的渔业管理工具,它在增殖和优化渔业资源、改善海洋生态环境、修复人类活动造成的栖息地丧失等方面都发挥着重要作用(Pickeringet al,1999;Dupont,2008;Whitmarshet al,2008)。目前,有关人工鱼礁的设计、应用和管理(Baine,2001;Shermanet al,2002),以及对海域水质和沉积物环境(章守宇等,2006;Falcãoet al,2007;Vicenteet al,2008;王伟定等,2010)、渔业资源(Godoyet al,2002;Santoset al,2010;吴忠鑫等,2012)、附着生物(张伟等,2009)等的影响研究较多,但对鱼礁生态系统中重要的组成部分—大型底栖动物的影响研究报道较少(Perkol-Finkelet al,2005;Boaventuraet al,2006;赵静等,2010)。大型底栖动物不仅是鱼类等更高级消费者重要的食物来源,也是生境变化的重要指示者,因此它们在评价人工鱼礁的资源和环境修复效果中发挥重要的作用。象山港曾经是浙江省重要的海水增养殖基地和多种经济鱼虾贝藻类的渔业资源产地(宁修仁等,2002),由于其自身的低水交换率(董礼先等,1999a,b)以及近年来高强度的人类开发活动(如临港工业开发、电厂建设与运行、滩涂围垦和水产养殖等)和过度捕捞对海域的生态环境造成了严重的影响(杨季芳等,2011;曾相明等,2011;廖一波等,2011),渔业资源也急剧衰退。为恢复和改善海洋生态环境,增殖和养护渔业资源,当地政府于2008年在白石山群岛海域投放了水泥鱼礁体230个(约5000空立方)(宁波市海洋渔业局,2009)。另根据《宁波市“十二五”现代渔业发展规划》,至2015年,在象山港海洋牧场核心示范区(铜山-白石山海域)建成 3个人工鱼礁群(水泥砼礁和贝藻礁等礁体),总建礁规模7.4万空立方。为探明人工鱼礁生境中底栖生物群落结构的组成情况,评估人工鱼礁投放的生态修复效果,本文根据2006—2007年4季象山港全港和2010年4季人工鱼礁及邻近海域大型底栖动物群落的调查资料,比较分析了不同区域大型底栖动物群落结构差异,以期为象山港人工鱼礁投放对海域生态和资源修复效果评价提供基础资料和实践依据。
1 材料与方法
1.1 研究区域和站位布设
象山港位于浙江省北部沿海,是一个狭长的半封闭型海湾,总面积为 563km2,其中水域面积约占70%,滩涂面积约占30%。本文分别在象山港全港海域和白石山群岛邻近海域布设调查站位。其中,X1—X8为象山港全港区的调查站位,A1—A5为人工鱼礁区的调查站位,B1—B3为人工鱼礁邻近海区的调查站位。具体调查站位设置见图1。
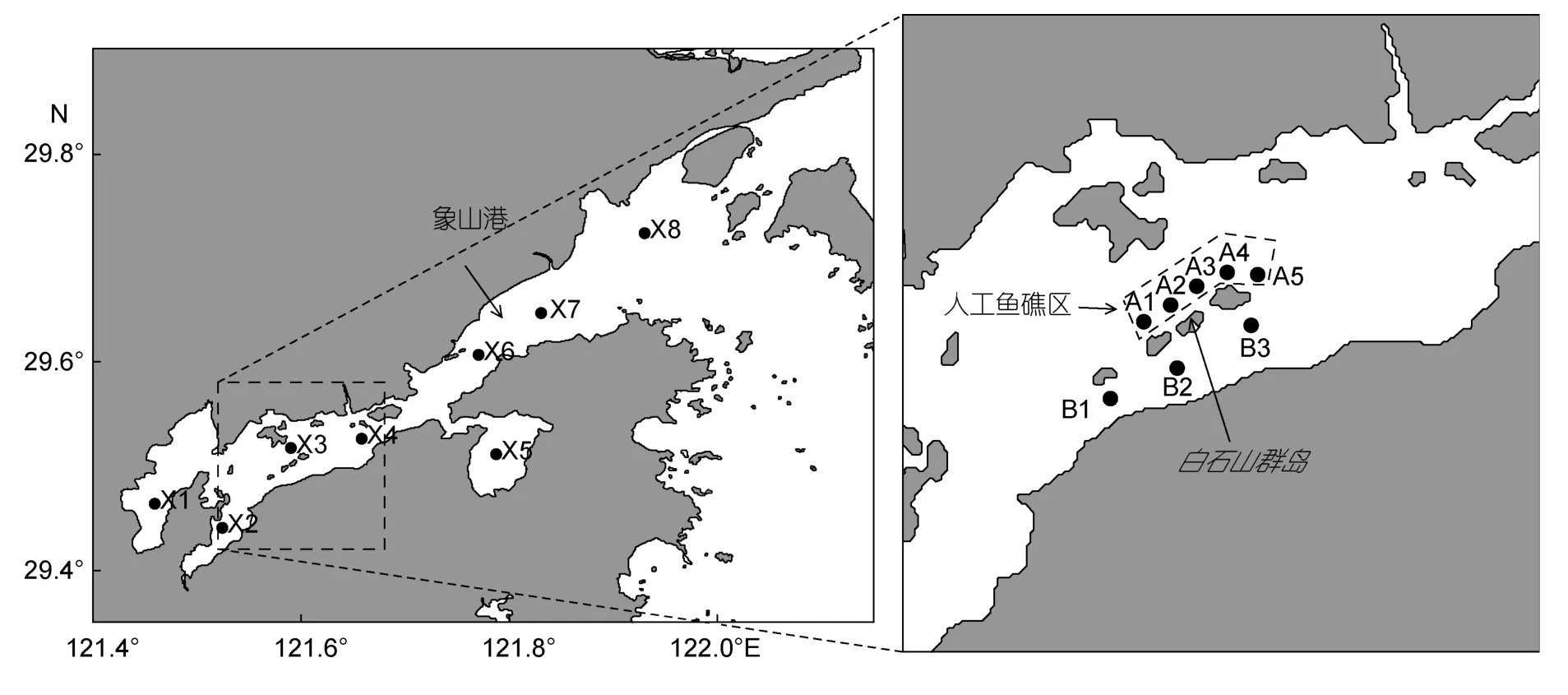
图1 研究区域和调查站位Fig.1 Study area and sampling stations in the Xiangshan Bay
1.2 样品采集与分析
象山港全港区的样品采集于2006年11月(秋季)、2007 年 1 月(冬季)、4 月(春季)和 7 月(夏季),鱼礁区和邻近区的大型底栖动物样品采集于2010年1月(冬季)、4 月(春季)、7 月(夏季)和 10 月(秋季),鱼礁区的站位选择尽量靠近人工鱼礁的投放位置。所有样品的采集均使用0.1m2的Van Veen型抓斗式底质采样器,每站重复采样2次。使用0.5mm孔径的网筛分选样品,所获的生物样品用 5%中性福尔马林固定后带回实验室进行种类鉴定、个体计数和称量。所有操作均按照《海洋调查规范》(GB/T 12763.6-2007)进行(国家质量监督检验检疫总局,2007)。
1.3 数据处理与分析
采用PRIMER 6.0软件计算Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)、Margalef丰富度指数(D)。利用STATISTICA 6.0统计软件包对环境参数和大型底栖动物群落参数进行以季节和研究区域为因子的双因子方差分析,在作参数统计分析前,对数据进行正态性(Kolmogorov-Smirnov test)和方差同质性(Bartlett test)检验,显著性水平设置为α=0.05。利用PRIMER 6.0软件对大型底栖动物的密度数据进行平方根转换,计算各站位间的 Bray-Curtis相似性系数,在此基础上进行非度量多维尺度排序(non-metric multidimensional scaling,nMDS)分析。不同季节和研究区域间的大型底栖动物群落比较用PRIMER 6.0软件提供的双因素相似性(ANOSIM)分析。同时,运用相似性百分比(similarity percentages,SIMPER)方法分别分析各区域大型底栖动物群落内相似性及群落间非相似性的关键贡献物种。
2 结果
2.1 大型底栖动物种类组成
象山港共采集到116种大型底栖动物,其中多毛类46种,占39.66%,软体动物35种,占30.17%,甲壳类18种,占15.52%,棘皮动物6种,占5.17%,其他类11种,包括真枝螅(Eudendriumsp.)、膝状薮枝螅(Obelia geniculata)、爱氏海葵(Edwardsiasp.)、黄海葵(Anthopleura xanthogrammia)、角海葵(Cerianthussp.)桂山希氏柳珊瑚(Hicksonella guishanensis)、沙箸海鳃(Virgulariasp.)、丁香珊瑚(Caryophylliasp.)、纽虫(Nemertea spp.)、曼哈顿皮海鞘(Molgula manhattensis)、红狼牙虎鱼(Odontamblyopus rubicundus),占9.48%。4季调查表明,鱼礁区大型底栖动物有58种,邻近区有59种,全港区有 69种,而鱼礁区和邻近区共计 81种,高于全港区。不同区域大型底栖动物的种类组成情况见图2,各区大型底栖动物的主要类群均为多毛类和软体动物。不同区域大型底栖动物种类数的季节变化明显(图3)。双因子方差分析结果表明(表1):大型底栖动物种类数不同季节间存在显著性差异(F3,52=3.58,P=0.020),不同区域间存在极显著差异(F2,52=16.85,P<0.01)。
2.2 密度和生物量
大型底栖动物年平均密度为鱼礁区(129ind./m2)=邻近区(129ind./m2)>全港区(35ind./m2);年平均生物量为邻近区(36.09g/m2)>鱼礁区(26.84g/m2)>全港区(13.85g/m2)。除冬季生物量外,鱼礁区和邻近区的大型底栖动物密度和生物量均高于全港区(图4)。对比鱼礁区和邻近区的大型底栖动物密度和生物量可以发现:密度除冬季外,其余各季节均为邻近区略高于鱼礁区;而生物量除秋季外,其余各季节均为鱼礁区高于邻近区。双因子方差分析结果表明(表1):大型底栖动物密度不同季节间存在显著性差异(F3,52=3.87,P=0.014),不同区域间存在极显著差异(F2,52=19.48,P<0.01);生物量不同区域间(F2,52=2.20,P=0.121)和季节间(F3,52=3.87,P=0.014)均无显著性差异。
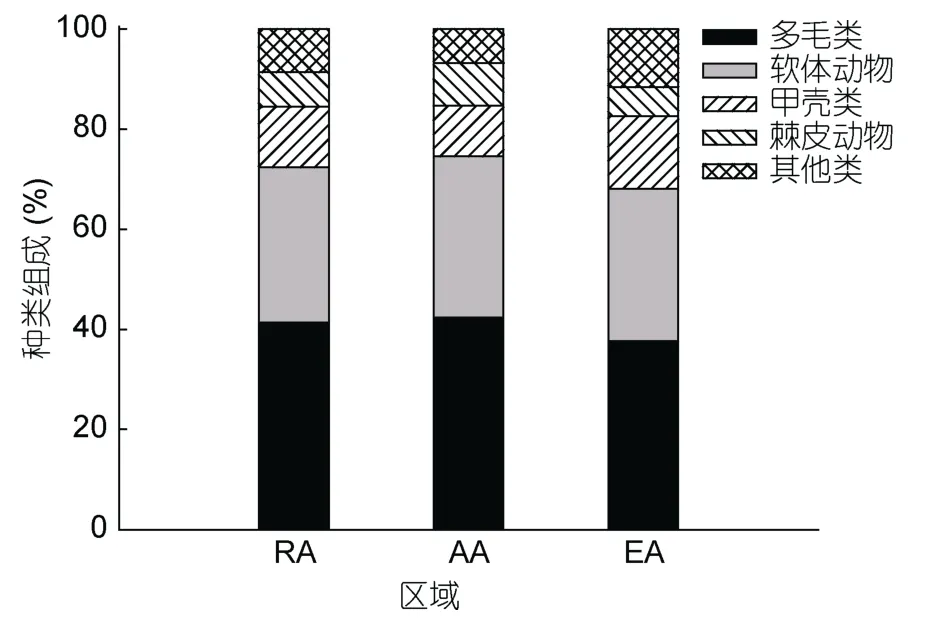
图2 人工鱼礁区(RA)、邻近海区(AA)和全港区(EA)大型底栖动物的种类组成Fig.2 Species composition of macrobenthos in reef area,the adjacent area,and entire bay area

图3 大型底栖动物种类数的季节变化Fig.3 Seasonal variation in number of species at reef area,the adjacent area,and entire bay area
2.3 生物多样性
不同区域大型底栖动物群落生物多样性指数的季节变化情况见图5。除 Pielou均匀度指数外,Shannon-Wiener多样性指数、Margalef丰富度指数均表现为邻近区>鱼礁区>全港区。均匀度指数则表现为春、夏季全港区>鱼礁区>邻近区,秋、冬季为全港区>邻近区>鱼礁区。双因子方差分析结果表明(表1):区域间,Pielou均匀度指数存在显著性差异(F2,52=4.27,P=0.019),Shannon-Wiener多样性指数(F2,52=8.20,P<0.01)和 Margalef丰富度指数(F2,52=10.56,P<0.01)存在极显著差异;季节间,Shannon-Wiener多样性指数、Margalef丰富度指数和 Pielou均匀度指数均无显著的季节性差异(P>0.05)。
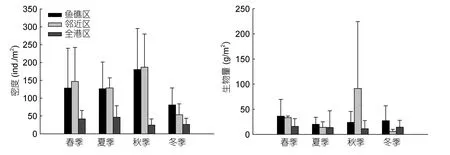
图4 大型底栖动物的密度和生物量Fig.4 Density and biomass of macrobenthos at reef area,the adjacent area,and entire bay area

图5 大型底栖动物群落的生物多样性指数Fig.5 Biodiversity indices of macrobenthic communities at reef area,the adjacent area,and entire bay area

表1 大型底栖动物群落参数的双因子方差分析Tab.1 Results of two-way ANOVA of macrobenthic community parameters
2.4 群落结构
根据 nMDS分析结果(图6),不同区域间大型底栖动物群落组成存在明显差异。其中各季节鱼礁区和邻近区的调查站位较集中,而与全港区各站位较离散,说明鱼礁区和邻近区的大型底栖动物群落组成相似度较高,而与全港区的相似度较低。双因素相似性分析(ANOSIM)结果表明(表2),大型底栖动物群落季节间存在显著性差异(综合检验R=0.109,P=0.012),区域间无显著性差异(综合检验R=0.075,P=0.086)。但区域间两两检验结果表明,鱼礁区和全港区的大型底栖动物群落存在显著性差异(R=0.144,P=0.014),鱼礁区和邻近区(R=0.099,P=0.178)以及邻近区与全港区(R=0.005,P=0.458)均无显著性差异。
根据SIMPER分析结果,鱼礁区大型底栖动物群落的平均相似性为 24.94%,其中,不倒翁虫(Sternaspis scutata)、薄云母蛤(Yoldia similis)和薄片镜蛤(Dosinia laminata)对平均相似性的累积贡献率为57.32%;邻近区大型底栖动物群落的平均相似性为24.01%,薄云母蛤、不倒翁虫、薄片镜蛤、花索沙蚕(Arabella iricolor)和多鳃齿吻沙蚕(Nephtys polybranchia)的累积贡献率为 51.09%;全港区群落的平均相似性为 8.31%,纵肋织纹螺(Nassariusvariciferus)、不倒翁虫和中锐吻沙蚕(Glycera rouxü)的累积贡献率为50.15%(表3)。鱼礁区和邻近区大型底栖动物群落间的平均非相似性为 77.19%,不倒翁虫为造成群落间差异的重要贡献物种;鱼礁区和全港区大型底栖动物群落间的平均非相似性为91.34%,不倒翁虫、薄云母蛤、纵肋织纹螺和洼颚倍棘蛇尾(Amphioplus depressus)为造成群落间差异的重要贡献物种;邻近区和全港区大型底栖动物群落间的平均非相似性为91.47%,不倒翁虫、薄片镜蛤和薄云母蛤为造成群落间差异的重要贡献物种(表4)。
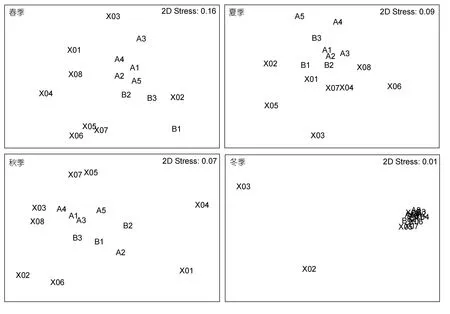
图6 大型底栖动物群落的多维尺度排序分析Fig.6 The nMDS plots for macrobenthic communities

表2 不同区域和季节间大型底栖动物群落的双因素相似性分析Tab.2 Results of a two-way analysis of similarity(ANOSIM) of macrobenthos in different areas and seasons
3 讨论
3.1 大型底栖动物群落的时空变化
象山港向西深入内陆,向东连接东海,是一个长期处于富营养化状态的典型海湾(郑云龙等,2000)。近年来,环象山港的人类活动愈加频繁,除传统的海水养殖业有所减少外,湾内两个电厂的相继建设与运行、港口的开发利用以及大桥的建设都对海湾生态环境和生物资源产生影响,故受到普遍关注(黄秀清等,2008;吕华庆等,2009;朱艺峰等,2012)。长期的气候变化和严重的人为干扰作用,加剧了沿海生境破碎化程度,导致了海洋生物存在明显的时空差异(Desroyet al,2007)。根据SIMPER分析结果,全港区大型底栖动物群落内相似性系数仅为8.31%,明显低于鱼礁区(24.94%)和邻近区(24.01%),说明象山港大型底栖动物群落具有较强的空间异质性。从群落参数比较结果来看,象山港大型底栖动物的时空分布较明显。空间上,鱼礁区和邻近区大型底栖动物的密度、生物量、Shannon-Wiener多样性指数和Margalef丰富度指数均高于全港区;季节上,鱼礁区和邻近区的各群落参数表现为秋季>春季>夏季>冬季,全港区则为夏季>春季>冬季>秋季。对比鱼礁区和邻近区可以发现,大型底栖动物的平均密度除冬季外,其余各季节均为邻近区略高于鱼礁区;而平均生物量除秋季外,其余各季节均为鱼礁区高于邻近区,秋季邻近区的平均生物量显著高于鱼礁区,这主要由于邻近区 B1站位出现细雕刻肋海胆(Temnopleurus toreumaticus),在该站位的生物量高达 242.07g/m2,如果去除该偶见种,则邻近区的平均生物量仅为10.67g/m2,将低于鱼礁区(23.92g/m2),则生物量的分布规律与其他季节一致。尽管存在一些季节上的变动,但是总体来说鱼礁区和邻近区大型底栖动物的密度和生物量差别并不明显,而且对不同区域群落的重要贡献物种也都为多毛类和双壳类,这与 Fabi等(2002)的研究结果一致。从长期变化来看,象山港大型底栖动物在种类数、密度和生物量等方面均发生了较大变化(表5),而且,人类活动相关区域(如养殖区、人工鱼礁区等)的大型底栖动物在数量上与全港平均水平存在明显差异,可见,大型底栖动物的长期变化较好地反映了人类活动干扰对海湾生态系统改变的影响。

表3 SIMPER分析结果:维持群落内相似性的重要物种及其贡献率Tab.3 Results of SIMPER analysis:Key species and their contributions to similarities among communities

表4 SIMPER分析结果:维持群落间非相似性的重要物种及其贡献率Tab.4 Results of SIMPER analysis:Key species and their contributions to dissimilarities among communities

表5 象山港大型底栖动物的时空变化Tab.5 Spatial-temporal pattern of macrobenthos in Xiangshan bay
3.2 人工鱼礁对大型底栖动物群落的影响
人工鱼礁的投放会增加生境的复杂性,从而提高该海域的生产力和多样性(Ambroseet al,1990),并在许多生态位和食物网中促进生物定居,增加物种丰富度(Reliniet al,1994)。本文研究发现,象山港人工鱼礁区的大型底栖动物平均密度约为全港区的 3.5倍,平均生物量约为全港区的 2倍,而且,Shannon-Wiener多样性指数和 Margalef丰富度指数均表现为人工鱼礁区显著高于全港区,说明人工鱼礁的投放为大型底栖动物提供了良好的栖息环境,促进了它们的生长繁殖。虽然全港区的样品采集于2006—2007年,人工鱼礁区和邻近区采集于 2010年,可能会存在年际间差异的误差,但是已有学者同样研究发现了类似的结果。Fabi等(2002)研究发现人工鱼礁区底栖生物的 Shannon-Wiener多样性指数显著高于对照区,另外,人工鱼礁区与对照区大型底栖动物的优势类群存在明显差异,鱼礁区内的优势类群有沉积物摄食者(deposit feeder)和悬浮物摄食者(suspension feeder),主要为多毛类,而鱼礁区外软体动物逐渐在数量上占据优势,并且与人工鱼礁的距离越远,砂质沉积物类型的物种比例逐渐升高。而本文中不同区域间的优势类群也存在相似的变化规律,从物种对各区域群落的贡献率来看,人工鱼礁区群落的最大贡献者为多毛类不倒翁虫(24.49%),其次为双壳类薄云母蛤(22.45%);邻近区的最大贡献者则为薄云母蛤(13.34%),其次为不倒翁虫(12.80%);全港区的最大贡献者为腹足类纵肋织纹螺(23.61%),其次为不倒翁虫(17.57%),不倒翁虫为沉积物摄食者,其对群落的贡献率从鱼礁区至外逐渐降低,取而代之的是悬浮物食者薄云母蛤和肉食者纵肋织纹螺。此外,有研究表明人工鱼礁的固着底栖生物群落随着时间的推移其演替规律更加明显,经过一年的发展,底栖生物主要优势类群有苔藓虫类、水螅虫类、海鞘类、管栖多毛类、双壳类等,至第二年,软珊瑚(Dendronephthya hemprichi)逐渐发展成为绝对优势类群,而 5—10年后,优势类群逐渐演替为海绵动物(如Crella cyatophora)或大型藻类(Reliniet al,1994;Perkol-Finkelet al,2005)。此外,双因素相似性分析中的两两比较检验结果表明,人工鱼礁投区和全港区大型底栖动物群落结构存在显著性差异,而与邻近区无显著性差异,与江志兵等(2012)对该海域网采浮游植物的研究结果一致,这可能与该海域人工鱼礁的投放时间较短,投放面积较小有关,影响范围局限于人工鱼礁区附近。Ambrose等(1990)研究结果同样发现,尽管有些种类的生物密度增加,有些减少,但是总体影响仅仅局限于人工鱼礁周围的较小范围内。
3.3 人工鱼礁投放对海洋生态系统的影响
Pickering等(1999)认为人工鱼礁投放导致沉积物有机质富集和水体营养物质增加,使之成为改善近海生态系统的一种潜在的有效方法。人工鱼礁投放会对其周围海域的流场结构产生影响,如迎流面附近产生上升涡流区,背流面产生涡动缓流区(Jianget al,2010),从而加速了沉积物中的营养物质向水体输送(Falcãoet al,2009),促进了海域生产力的提高(Falcãoet al,2007)。另一方面,人工鱼礁加速了水体中有机物的沉降,动植物死亡后不断产生的有机碎屑通过生物或化学降解进入到沉积物中,促进了底栖生物的活力增强,导致有机质在沉积物中的再矿化作用(Ambroseet al,1990;Gutiérrezet al,2000)。Falcão 等(2007)研究发现鱼礁区沉积物中的有机氮含量极低,可能与较高的氮转化效率有关。另外,由于人工鱼礁区的水流和涡流作用促进了浮游生物群落的增长,更多的浮游生物被带入底层海水,同时也提高了底层营养物质的再循环(Ambroseet al,1990;Harounet al,1994)。人工鱼礁区各种生物和非生物因素的变化均为大型底栖生物造就了良好的栖息环境,尤其是沉积物摄食者和悬浮物摄食者的数量显著增加,它们在沉积物以及水体-沉积物界面中发挥着重要作用。人工鱼礁作为鱼类良好的庇护场,提供丰富的食物来源,对鱼类的诱集和分布影响明显,可能会使大型底栖动物被捕食的压力增加。然而,Fabi等(2002)研究认为,相对于捕食等生物因素,人工鱼礁导致的物理因素变化对底栖生物群落的影响更加显著。综上所述,人工鱼礁的投放对近海生态系统的资源和生态环境起到了积极的作用,但有关生态环境效应机制需要进一步深入研究。
中国海湾志编纂委员会,1992.中国海湾志:第五分册.北京:海洋出版社,220—222
王伟定,梁 君,章守宇,2010.人工鱼礁建设对浙江嵊泗海域营养盐与水质的影响.水生生物学报,34(1):78—87
宁波市海洋渔业局,2009.2008年宁波市海洋环境公报,27
宁修仁,胡锡钢,2002.象山港养殖生态和网箱养鱼的养殖容量研究与评价.北京:海洋出版社,1—15
朱艺峰,施慧雄,金成法等,2012.象山港海域水质时空格局的自组织特征映射神经网络识别.环境科学学报,32(5):1236—1246
江志兵,陈全震,寿 鹿等,2012.象山港人工鱼礁区的网采浮游植物群落组成及其与环境因子的关系.生态学报,32(18):5813—5824
吕华庆,常抗美,石钢德,2009.象山港氮、磷营养盐环流和分布规律的研究.海洋与湖沼,40(2):138—144
吴忠鑫,张 磊,张秀梅等,2012.荣成俚岛人工鱼礁区游泳动物群落特征及其与主要环境因子的关系.生态学报,32(21):6737—6746
张 伟,李纯厚,贾晓平等,2009.环境因子对大亚湾人工鱼礁上附着生物分布的影响.生态学报,29(8):4053—4060
杨季芳,王海丽,陈福生等,2011.象山港海域细菌的分布特征及其环境影响因素.生态学报,31(14):4007—4018
郑云龙,朱红文,罗益华,2000.象山港海域水质状况评价.海洋环境科学,19(1):56—59
国家质量监督检验检疫总局,2007.海洋调查规范(GB/T 12763.6-2007).北京:中国标准出版社,41—44
赵 静,章守宇,汪振华等,2010.嵊泗人工鱼礁海域鱼类和大型无脊椎动物群落结构特征.中国水产科学,17(5):1045—1056
高爱根,陈全震,胡锡钢等,2005.象山港网箱养鱼区大型底栖生物生态特征.海洋学报,27(4):108—113
高爱根,杨俊毅,陈全震等,2003.象山港养殖区与非养殖区大型底栖生物生态比较研究.水产学报,27(1):25—31
顾晓英,陶 磊,施慧雄等,2010a.象山港大型底栖动物生物多样性现状.应用生态学报,21(6):1551—1557
顾晓英,陶 磊,尤仲杰等,2010b.象山港大型底栖动物群落特征.海洋与湖沼,41(2):208—213
黄秀清,王金辉,蒋晓山,2008.象山港海洋环境容量及污染物总量控制研究.北京:海洋出版社,278—310
章守宇,张焕君,焦俊鹏等,2006.海州湾人工鱼礁海域生态环境的变化.水产学报,30(4):475—480
曾相明,管卫兵,潘 冲,2011.象山港多年围填海工程对水动力影响的累积效应.海洋学研究,29(1):73—83
董礼先,苏纪兰,1999a.象山港水交换数值研究Ⅰ.对流-扩散型的水交换模式.海洋与湖沼,30(4):410—415
董礼先,苏纪兰,1999b.象山港水交换数值研究Ⅱ.模型应用和水交换研究.海洋与湖沼,30(5):465—470
廖一波,寿 鹿,曾江宁等,2011.象山港不同养殖类型海域大型底栖动物群落比较研究.生态学报,31(3):646—653
Ambrose R F,Anderson T W,1990.Influence of an artificial reef on the surrounding infaunal community.Marine Biology,107(1):41—52
Baine M,2001.Artificial reefs:a review of their design,application,management and performance.Ocean &Coastal Management,44(3—4):241—259
Boaventura D,Moura A,Leitão Fet al,2006.Macrobenthic colonisation of artificial reefs on the southern coast of Portugal(Ancão,Algarve).Hydrobiologia,555(1):335—343
Desroy N,Janson A L,Denis Let al,2007.The intra-annual variability of soft-bottom macrobenthos abundance patterns in the North Channel of the Seine estuary.Hydrobiologia,588(1):173—188
Dupont J M,2008.Artificial reefs as restoration tools:A case study on the West Florida Shelf.Coastal Management,36(5):495—507
Fabi G,Luccarini F,Panfili Met al,2002.Effects of an artificial reef on the surrounding soft-bottom community(central Adriatic Sea).ICES Journal of Marine Science,59(Supp1.):343—349
Falcão M,Santos M N,Vicente Met al,2007.Biogeochemical processes and nutrient cycling within an artificial reef off Southern Portugal.Marine Environmental Research,63(5):429—444
Falcão M,Santos M N,Drago Tet al,2009.Effect of artificial reefs(southern Portugal) on sediment-water transport of nutrients:importance of the hydrodynamic regime.Estuarine,Coastal and Shelf Science,83(4):451—459
Godoy E A S,Almeida T C M,Zalmon I R,2002.Fish assemblages and environmental variables on an artificial reef north of Rio de Janeiro,Brazil.ICES Journal of Marine Science,59(Supp1.):138—143
Gutiérrez D,Gallardo V A,Mayor Set al,2000.Effects of dissolved oxygen and fresh organic matter on the bioturbation potential of macrofauna in sublittoral sediments off Central Chile during the 1997/1998 El Niño.Marine Ecology Progress Series,202:81—99
Haroun R,Gómez M C,Hernández J Jet al,1994.Environmental description of an artificial reef site in Gran Canaria(Canary Islands,Spain) prior to reef placement.Bulletin of Marine Science,55(2—3):932—938
Jiang Z Y,Liang Z L,Tang Y Let al,2010.Numerical simulation and experimental study of the hydrodynamics of a modeled reef located within a current.Chinese Journal of Oceanology and Limnology,28(2):267—273
Perkol-Finkel S,Benayahu Y,2005.Recruitment of benthic organisms onto a planned artificial reef:shifts in community structure one decade post-deployment.Marine Environmental Research,59(2):79—99
Pickering H,Whitmarsh D,Jensen A,1999.Artificial reefs as a tool to aid rehabilitation of coastal ecosystems:investigating the potential.Marine Pollution Bulletin,37(8—12):505—514
Relini G,Zamboni N,Tixi Fet al,1994.Patterns of sessile macrobenthos community development on an artificial reef in the Gulf of Genoa(northwestern Mediterranean).Bulletin of Marine Science,55(2—3):745—771
Santos L N,Brotto D S,Zalmon I R,2010.Fish responses to increasing distance from artificial reefs on the Southeastern Brazilian Coast.Journal of Experimental Marine Biology and Ecology,386(1—2):54—60
Sherman R L,Gilliam D S,Spieler R E,2002.Artificial reef design:void space,complexity,and attractants.ICES Journal of Marine Science,59(Suppl.):196—200
Vicente M,Falcão M,Santos M Net al,2008.Environmental assessment of two artificial reef systems off southern Portugal(Faro and Olhão):A question of location.Continental Shelf Research,28(6):839—847
Whitmarsh D,Santos M N,Ramos Jet al,2008.Marine habitat modification through artificial reefs off the Algarve(southern Portugal):An economic analysis of the fisheries and the prospects for management.Ocean &Coastal Management,51(6):463—468
