菲律宾蛤仔脂多糖诱导的肿瘤坏死因子α VpLITAF基因克隆及其对微生物侵染的应答研究*
2014-03-09张林宝宁璇璇蔡文贵陈海刚马胜伟贾晓平
张林宝 孙 伟 宁璇璇 蔡文贵 张 喆 陈海刚 马胜伟 贾晓平①
(1.中国水产科学研究院南海水产研究所 农业部南海渔业资源开发利用重点实验室 广东省渔业生态环境重点实验室广州 510300;2.国家海洋局烟台海洋环境监测中心站 烟台 264003)
细胞因子(Cytokine)是多种细胞分泌的能调节细胞生长分化、调节免疫功能、参与炎症反应和创伤愈合的小分子多肽,它们是细胞和体液免疫反应不可缺少的介质(Kuby,1997)。无脊椎动物中关于细胞因子样物质的研究主要集中在白介素和肿瘤坏死因子TNF-α(Tumor necrosis factor alpha)上。TNF-α 作为前炎性细胞因子介导炎症反应和免疫调节反应(Bazzoniet al,1996),能直接导致肿瘤细胞死亡并参与机体内炎症和免疫应答调节(García-Castilloet al,2002)。脂多糖(Lipopolysaccharide,LPS)诱导的肿瘤坏死因子α LITAF(LPS-induced TNF a factor)是 TNF-α 重要的转录因子,在调节 LPS诱导 TNF-α的表达过程中起着非常重要的作用(Tanget al,2003)。LITAF在脊椎动物和无脊椎动物中均被分离出来(Bolcato-Belleminet al,2004;Honget al,2006;Yuet al,2007;Parket al,2008;Zhanget al,2009),并证实其可以特异结合人TNF-α启动子上位于-515到-511位的 CTCCC序列(Tanget al,2003),在受到LPS刺激后与STAT6B蛋白形成复合体进入细胞核调控TNF-α的表达(Tanget al,2005)。
迄今为止,在扇贝、牡蛎等贝类中相继报道了LITAF的基因克隆与功能研究(Yuet al,2007;Parket al,2008;Zhanget al,2009;赫崇波等,2012;Liet al,2012;Yanget al,2012;Yuet al,2012)。然而,有关菲律宾蛤仔(Venerupis philippinarum)LITAF基因的功能研究则未见报道。菲律宾蛤仔作为我国海水养殖业的重要经济贝类,年产量高达180万吨,是沿海居民最常食用的海产品之一(Zhanget al,2006)。但是,近年来频发的病害问题严重制约了蛤仔养殖业的健康发展,因此开展菲律宾蛤仔抗病及免疫相关基因的研究是非常重要和十分紧迫的。本研究在已构建的cDNA文库和大规模EST(expressed sequence tags,表达序列标签)分析的基础上,采用RACE(Rapid Amplification of cDNA Ends,cDNA末端快速扩增技术)等方法克隆菲律宾蛤仔LITAF基因序列,用生物信息学方法对基因和推测的蛋白进行结构分析和功能预测,同时通过实时荧光定量PCR技术分析该基因在蛤仔不同组织以及受到不同微生物刺激后的表达情况。研究旨在深入了解菲律宾蛤仔的免疫抗病机制,为其遗传改良和抗病品系选育工作提供参考资料。
1 材料与方法
1.1 实验样品及处理
实验所用菲律宾蛤仔购自广州市黄沙水产市场,选取壳长为3—4cm个体进行实验。正式实验开始前,在过滤海水中驯养一周,每日定时投喂小球藻,水温控制在20—22°C。微生物侵染实验中,设置对照组和鳗弧菌(Vibrio anguillarum)、藤黄微球菌(Micrococcus luteus)刺激组。鳗弧菌作为本研究中革兰氏阴性菌的代表,广泛存在于养殖环境,是海水鱼、虾、贝类的常见细菌性病原(Egidius,1987)。藤黄微球菌是一种典型的革兰氏阳性菌,属条件致病菌,目前有文献报道其在水体以及水生生物体内都有分布(Spanggaardet al,2001;彭彬等,2011)。对照组不做任何处理,随机取6只蛤仔,采集闭壳肌、外套膜、肝胰腺、鳃和血淋巴细胞五种组织。侵染组菲律宾蛤仔分别浸泡于含有 1×107CFU/mL鳗弧菌和藤黄微球菌的海水中,于6、12、24、48 h每组随机采集6只蛤仔血淋巴样品。血淋巴样品于4°C,3000r/min离心5 min收集血淋巴细胞,加入1mL Trizol(Invitrogen公司)后置于超低温冰箱,其余组织放入预先装有1mL Trizol的离心管中充分研磨,在4°C,5000r/min离心5min,取上清置于超低温冰箱中备用。
1.2 方法
1.2.1 菲律宾蛤仔LITAF基因的克隆 采用Trizol提取菲律宾蛤仔各组织以及鳗弧菌和藤黄微球菌侵染后的血淋巴细胞总RNA,用Dnase I(Promega公司)消化残留DNA,然后用M-MLV(Promega公司)反转录合成第一链cDNA。根据本实验室已构建的菲律宾蛤仔cDNA文库获得LITAFEST序列,并分别设计3′和5′ Race特异性引物(表1),以反转录的cDNA为模板,按 Race试剂盒(Clonetech公司)说明步骤分别扩增该基因的 3′和 5′端。PCR 产物经纯化后连接到pMD18-T载体上(TaKaRa公司),转化大肠杆菌TOP10F感受态,PCR检测阳性克隆后测序。
1.2.2 菲律宾蛤仔VpLITAF基因生物信息学分析序列同源性比对和相似性搜索利用 NCBI在线软件BLAST进行分析(http://www.ncbi.nlm.nih.gov/blast),多序列比对采用 CLUSTAL W 多重比对程序(http://www.ebi.ac.uk/clustalw/);信号肽查找用 SingalP 3.0 Server 软件(http://www.cbs.dtu.dk/services/ SignalP/);同时运用 MEGA 5.0软件包(Tamuraet al,2011)的Neighbor-joining法构建进化树(Saitouet al,1987)。
1.2.3 菲律宾蛤仔VpLITAF基因表达分析 采用PCR Sybrgreen Master Mix(TaKaRa)试剂盒,使用ABI公司7500Fast型荧光定量 PCR仪分析VpLITAF基因的组织分布特征以及在鳗弧菌和藤黄微球菌感染下的时序表达规律。根据扩增获得的VpLITAF基因序列,设计荧光定量引物VpLITAF-QF和VpLITAF-QR,以β-actin为内参照(引物信息见表1),采用相对定量方法检测VpLITAF基因的表达特征。PCR反应条件:第一步:50°C 2min,第二步:95°C 10min,第三步:95°C 15s,60°C 1min,共40个循环,反应完成后进行熔解曲线分析:95°C 15s,60°C 20s,然后缓慢升温至95°C,连续记录荧光信号的变化,将温度的变化与荧光信号的变化求负倒数后对温度作图,可得到产物的Tm值。实验过程中,每个反应均设3个重复,并在反应结束后进行熔解曲线分析确保产物的特异性。数据处理首先用β-actin作为内标基因对VpLITAF基因表达量进行标准化,计算ΔCT值。组织分布研究将闭壳肌组织的样品作为参照因子(calibrator),其倍数变化为1,对于其它组织样本,目标基因表达差异相对于参照因子基因表达的倍数为2–ΔΔCT。菌刺激样品VpLITAF基因相对表达水平用微生物处理组的表达量与海水对照组表达量的比值来计算(Zhanget al,2011)。所得数据采用SPSS 13.0软件包进行t-test统计分析。
2 结果
2.1 菲律宾蛤仔VpLITAF基因序列分析
通过5′和3′ RACE方法获得菲律宾蛤仔VpLITAF基因 cDNA序列(GenBank注册号 HQ174259),如图1 所示。该cDNA序列长为725 bp,含有393 bp的开放阅读框序列(Open Reading Frame,ORF),编码130个氨基酸残基,该多肽的理论分子量为 14.39 kDa,等电点为 7.47。VpLITAFcDNA 序列 5′非编码区(5′-UTR)为 23 bp,3′非编码区(3′-UTR)为 309 bp,包含一个加尾信号(AATAAA)和典型的 polyA尾巴。利用SignalP软件分析发现VpLITAF不具有信号肽序列。
2.2 VpLITAF同源性分析与进化分析
经BLASTP比对发现VpLITAF基因编码的蛋白与文蛤(Meretrix meretrix)和竹蛏(Solen grandis)LITAF蛋白同源性最高,分别为96%和84%,与栉孔扇贝(Chlamys farreri)、太平洋牡蛎(Crassostrea gigas)、中华圆田螺(Cipangopaludina chinensis)和鲍(Haliotis discus discus)等贝类 LITAF也有 55%—67%的一致性。利用SMART软件(http://cn.expasy.org)分析发现,VpLITAF蛋白C端含有一个保守的LITAF结构域和两个保守的 CXXC基序。多序列比对发现在该保守结构域内含有 8个保守的半胱氨酸残基(图1,图2),推测这些保守的半胱氨酸残基可能在维持蛋白的高级结构中发挥着重要作用。采用 Neighbor-joining方法构建系统进化树,发现 LITAF蛋白首先分为脊椎动物和无脊椎动物两大类,菲律宾蛤仔 VpLITAF与海洋软体动物LITAF聚类在一起,然后再与鱼类、鸟类及哺乳动物的 LITAF蛋白聚在一起,这与生物进化的远近关系基本一致(图3)。
2.3 VpLITAF基因在菲律宾蛤仔组织中的分布特征
以β-actin为对照,利用实时荧光定量PCR检测VpLITAFmRNA在菲律宾蛤仔鳃、肝胰腺、外套膜、血淋巴细胞和闭壳肌 5种正常组织中的表达情况(图4);结果显示,VpLITAFmRNA在5种组织中均可见不同丰度的表达。VpLITAF在肌肉中的表达量最低,血淋巴细胞、外套膜和鳃中VpLITAF的表达量相对较高,分别是闭壳肌组织中表达量的19.89、29.56和82.28倍。VpLITAF基因在菲律宾蛤仔肝胰腺中的表达量最高,为闭壳肌组织中表达量的315.90倍。

图1 菲律宾蛤仔VpLITAF基因核苷酸及推导的氨基酸序列Fig.1 The complete nucleotide and deduced amino acid sequence of VpLITAF

图2 VpLITAF与其它物种LITAF氨基酸序列的多序列比对Fig.2 Multiple sequence alignment of VpLITAF with LITAFs from other organisms

图3 不同物种LITAF进化树Fig.3 Phylogenetic tree of LITAF sequences from different organisms
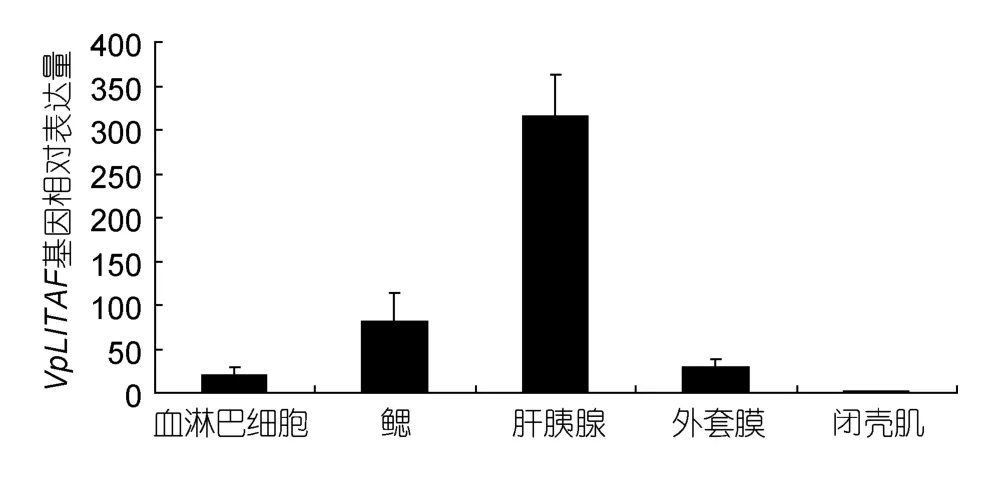
图4 VpLITAF在菲律宾蛤仔各组织中的相对表达情况Fig.4 Distribution of VpLITAF mRNA in different tissues of V.philippinarum
2.4 菌刺激后菲律宾蛤仔VpLITAF基因的时序表达特征
利用荧光定量 PCR方法,分析菲律宾蛤仔VpLITAF基因 mRNA在鳗弧菌和藤黄微球菌刺激后的时序表达情况(图5)。其中,对照组样品VpLITAF表达量在所检测的时间范围内未出现明显变化。鳗弧菌感染组菲律宾蛤仔VpLITAF基因表达量不断变化,12h和48h的表达量有着显著增加,分别为对照组的2.1倍和3.5倍。藤黄微球菌感染24h以内,VpLITAF基因 mRNA表达量有所升高,但与对照组表达水平并无显著差异。随着感染时间的延长,VpLITAF基因表达水平在48h被鳗弧菌显著诱导,表达量为对照组的1.9倍。

图5 菌刺激后菲律宾蛤仔血淋巴细胞中VpLITAF的时序表达特征Fig.5 Temporal expression of VpLITAF in haemocytes of V.philippinarum after bacterial infection
3 讨论
LITAF是一种重要的转录因子,在调节LPS诱导炎症因子TNF-α的表达过程中起着非常重要的作用。迄今为止,在扇贝、牡蛎、文蛤和中华圆田螺等贝类中相继报道了LITAF基因(Yuet al,2007;Liet al,2012;Yuet al,2012)。然而有关菲律宾蛤仔LITAF基因的相关研究则未见报道。本研究首次克隆了蛤仔的LITAF基因cDNA序列,并对其免疫调节作用进行了初步研究。
比对分析发现,VpLITAF氨基酸序列与其它贝类LITAF具有较高的相似性(Yuet al,2007,2012;Liet al,2012),都具有高度保守的LITAF结构域。LITAF结构域由N端的CXXC区、25个氨基酸长的疏水区和C端的(H)XCXXC区组成,N端和C端的CXXC基序结合在一起,形成紧密结合的 Zn2+结构(Pontinget al,2001),介导LITAF与DNA之间的结合启动相关基因转录(Yuet al,2012)。系统进化分析发现,VpLITAF首先与贝类 LITAF聚为一簇,然后与各类脊椎动物 LITAF聚在一起,这与物种进化的发生顺序基本一致。综上所述,同源比对、结构域和进化分析均表明菲律宾蛤仔VpLITAF为LITAF家族一员。
研究表明LITAF基因主要表达于脊椎动物外周血细胞、淋巴结和脾等淋巴组织中,在非淋巴器官中也有不同程度的表达(Bolcato-Belleminet al,2004;Tanget al,2005;Honget al,2006)。本研究中VpLITAF在菲律宾蛤仔所检测组织中均有表达,其中肝胰腺的表达量最高(图4),这与LITAF基因在中华圆田螺和太平洋牡蛎中的组织分布情况类似(Yanget al,2012;Yuet al,2012)。牡蛎全基因组研究揭示许多免疫相关基因高度表达于消化腺中(Zhanget al,2012),这表明消化系统与血淋巴细胞一样是软体动物对抗、清除病原体的重要一线防御器官(江静波,1982;Parket al,2008;Zhanget al,2009),因此推测菲律宾蛤仔肝胰腺中高表达的 VpLITAF在机体免疫反应中发挥着重要作用。然而,栉孔扇贝和文蛤LITAF的组织分布情况则有所不同,二者的最高表达量分别发生在性腺和鳃组织中(Yuet al,2007;Liet al,2012),表明LITAF基因组织分布特征随物种的不同而不同。
虽然本研究中VpLITAF在蛤仔血淋巴细胞中的表达量相较于其它组织来说偏低,然而血淋巴细胞在贝类固有免疫系统中发挥着重要的作用(王信超等,2012;刘世良等,2003),经常作为研究免疫相关基因的组织材料(Zhanget al,2011;Liet al,2012),因此本研究选取血淋巴细胞研究VpLITAF基因表达与微生物感染的相关性。研究结果表明鳗弧菌和藤黄微球菌侵染在某些时段均可显著诱导VpLITAF基因的表达水平(图5),类似的结论在太平洋牡蛎、虾夷扇贝、文蛤和珍珠贝中也有发现(Parket al,2008;Zhanget al,2009;赫崇波等,2012;Liet al,2012),表明LITAF参与了机体的免疫调节过程。鳗弧菌和藤黄微球菌侵染24 h,VpLITAF基因表达水平与12 h相比有所回落,这可能是因为随着微生物侵染时间的延长,蛤仔血淋巴系统中产生 VpLITAF的血细胞数量减少或转移至微生物增殖的其它组织中,如外套膜、消化腺和鳃等。微生物感染下,类似的诱导-降低-再诱导的表达模式在贝类其它免疫相关基因的表达分析中也有发现,如盘鲍(Haliotis discus discus)抗菌肽(De Zoysaet al,2010)和菲律宾蛤仔谷胱甘肽过氧化物酶(Zhanget al,2011)。另外,本研究中鳗弧菌对VpLITAF基因表达的诱导作用明显强于藤黄微球菌。鳗弧菌是一种革兰氏阴性菌,其细胞外膜的主要结构成分为LPS ,目前已有诸多研究表明LPS可显著诱导LITAF的转录水平(Bolcato-Belleminet al,2004;Honget al,2006;Yuet al,2007,2012)。藤黄微球菌是一种革兰氏阳性菌,其细胞壁主要结构成分为肽聚糖(peptidoglycan,PGN),研究表明PGN对栉孔扇贝LITAF基因表达无显著诱导作用(Yuet al,2007)。因此,不难理解菲律宾蛤仔VpLITAF基因表达对鳗弧菌感染更为敏感。藤黄微球菌侵染蛤仔48 h后,VpLITAF基因被显著诱导的原因需进一步深入研究。总之,VpLITAF基因克隆与表达分析表明 VpLITAF参与了菲律宾蛤仔的先天性免疫反应,这为进一步研究蛤仔分子水平的免疫防御机制研究提供了新的基础资料。
王信超,孙敬敬,范美华等,2012.厚壳贻贝血细胞的蛋白质组学分析.南方水产科学,8(2):7—14
刘世良,麦康森,2003.贝类免疫系统和机理的研究进展.海洋学报,25(2):95—105
江静波,1982.无脊椎动物学.北京:高等教育出版社
彭 彬,杨光友,陈晓利等,2011.黄鳝藤黄微球菌的分离鉴定及药敏实验.上海海洋大学学报,20(3):405—411
赫崇波,朱 宝,刘卫东等,2012.虾夷扇贝脂多糖诱导的肿瘤坏死因子 LITAF基因的克隆及表达分析.遗传,34(6):736—741
Bazzoni F,Beutler B,1996.The tumor necrosis factor ligand and receptor families.N Engl J Med,334(26):1717—1725
Bolcato-Bellemin A L,Mattei M G,Fenton Met al,2004.Molecular cloning and characterization of mouse LITAF cDNA:role in the regulation of tumor necrosis factor-alpha(TNF-alpha)gene expression.J Endotoxin Res,10(1):15—23
De Zoysa M D,Whang I,Lee Yet al,2010.Defensin from disk abaloneHaliotis discus discus:Molecular cloning,sequence characterization and immune response against bacterial infection.Fish Shellfish Immunol,28(2):261—266
Egidius E,1987.Vibriosis:pathogenicity and pathology,a review.Aquaculture,67:15—28
García-Castillo J,Pelegrín P,Mulero Vet al,2002.Molecular cloning and expression analysis of tumor necrosis factor α from a marine fish reveal its constitutive expression and ubiquitous nature.Immunogenetics,54(3):200—207
Hong Y H,Lillehoj H S,Lee S Het al,2006.Molecular cloning and characterization of chicken lipopolysaccharide-induced TNF-α factor(LITAF).Dev Comp Immunol,30(10):919—929
Kuby J,1997.Immune effect mechanisms,Immunology,3rd.W.H.Freeman and Company Press
Li H J,Yang Q,Gao X Get al,2012.Identification and expression of a putative LPS-induced TNF-α factor from Asiatic hard clamMeretrix meretrix.Mol Biol Rep,39(2):865—871
Park E M,Kim Y O,Nam B Het al,2008.Cloning,characterization and expression analysis of the gene for a putative lipopolysaccharide-induced TNF-alpha factor of the Pacific oyster,Crassostrea gigas.Fish Shellfish Immunol,24(1):11—17
Ponting C P,Mott R,Bork Pet al,2001.Novel protein domains and repeats inDrosophila melanogaster:insights into structure,function,and evolution.Genome Res,11(12):1996—2008
Saitou N,Nei M,1987.The neighbor-joining method:a new method for reconstructing phylogenetic trees.Mol Bio Evol,4(4):406—425
Spanggaard B,Huber I,Nielsen E Bet al,2001.The probiotic potential against vibriosis of the indigenous microflora of rainbow trout.Environ Microbiol,3(12):755—765
Tamura K,Peterson D,Peterson Net al,2011.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods.Mol Biol Evol,28(10):2731—2739
Tang X R,Fenton M J,Amar S,2003.Identification and functional characterization of a novel binding site on TNF-α promoter.Proc Natl Acad Sci USA,100(7):4096—4101
Tang X R,Marciano D L,Leeman S Eet al,2005.LPS induces the interaction of a transcription factor,LPS-induced TNF alpha factor,and STAT6(B)with effects on multiple cytokines.Proc Natl Acad Sci USA,102(14):5132—5137
Yang S,Li P,Mi Z,2012.LPS-induced TNFa factor(LITAF)in the snailCipangopaludina chinensis:gene cloning and its apoptotic effect on NCI-H446 cells.Fish Shellfish Immunol,32(2):268—272
Yu F,Zhang Y,Yu Z,2012.Characteristics and expression patterns of the lipopolysaccharide-induced TNF-α factor(LITAF)gene family in the Pacific oyster,Crassostrea gigas.Fish Shellfish Immunol,33(4):899—908
Yu Y D,Qiu L M,Song L Set al,2007.Molecular cloning and characterization of a putative lipopolysaccharide-induced TNF-alpha factor(LITAF)gene homologue from Zhikong scallopChlamys farreri.Fish Shellfish Immunol,23(2):419—429
Zhang D C,Jiang J J,Jiang S Get al,2009.Molecular characterization and expression analysis of a putative LPS-induced TNF-alpha factor(LITAF)from pearl oysterPinctada fucata.Fish Shellfish Immunol,27(3):391—396
Zhang G F,Yan X W,2006.A new three-phase culture method for Manila clam,Ruditapes philippinarum,farming in northern China.Aquaculture,258(1—4):452—461
Zhang G,Fang X,Guo Xet al,2012.The oyster genome reveals stress adaptation and complexity of shell formation.Nature,490:49—54
Zhang L,Liu X,Chen Let al,2011.Transcriptional regulation of selenium-dependent glutathione peroxidase fromVenerupis philippinarumin response to pathogen and contaminants challenge.Fish Shellfish Immunol,31(6):831—837
