疑患EMS/AHPNS对虾中检出黄头病毒的一种新株型*
2014-03-09杨昊霖笋王海亮王勤涛张庆利
刘 群 黄 倢 杨昊霖 杨 冰 刘 笋王海亮 王勤涛 刘 飞 张庆利
(1.农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;2.上海海洋大学 上海 201306)
2010年以来,越南和我国海南养殖的凡纳滨对虾(Litopenaeus vannamei)相继出现不明原因的疫病,并导致了较高的对虾死亡率,对越南对虾养殖业造成了毁灭性打击。2011年在马来西亚发现该疫病,2012年泰国也出现流行。因该不明疾病最初的表现是,养成期投苗30d左右后的对虾出现不寻常的高死亡率,因此被称为早期死亡综合征(early mortality syndrome,EMS)。2012年8月,亚太水产养殖中心网络(NACA)针对此次突发的对虾疾病,召集全球知名对虾病害专家在泰国召开紧急咨询会,确定该疫病已感染的对虾种类包括凡纳滨对虾、斑节对虾(Penaeus monodon)、中国明对虾(Fenneropenaeus chinensis)等,表观症状为肝胰腺苍白、萎缩,软壳,胃肠空或内容物不连续,放苗后最早10d就能发病死亡,濒死虾不常出现在池边或水面,而是沉入池底;组织病理学表现为对虾肝胰腺盲管从中段到末端进行性变性,B、F和R细胞功能紊乱,部分细胞核膨大,肝胰腺盲管上皮细胞坏死或脱落,在后期肝胰腺盲管间或盲管内血细胞浸润,肝胰腺被细菌二次感染,因此该疫病被定义为急性肝胰腺坏死综合征(Acute hepatopancreas necrosis syndrome,AHPNS),但在该会上以及至今国际上尚未能确定该疫病是由某种特定病原引起还是由毒素所致(NACA,2012)。
黄头病毒(yellow-head virus,YHV)属于头甲病毒属(Okavirus),杆套病毒科(Roniviridae),套式病毒目(Nidovirales)(Cowleyet al,2012),于1990年首次在泰国养殖斑节对虾中被发现,YHV基因型1所引起的黄头病(Yellow head disease,YHD)被世界动物卫生组织(World Organization for Animal Health,OIE)水生动物疫病名录收录,引起斑节对虾(Chantanachookinet al,1993)、凡纳滨对虾(Sittidilokratnaet al,2009)等大量死亡。此前在我国养殖对虾中没有检出过,也没有针对中国明对虾宿主的相关报道。本研究在我国发生疑似AHPNS的凡纳滨对虾及中国明对虾样品中检测到YHV的新基因型毒株,为揭示AHPNS的病原提供了重要信息,也表明我国对虾养殖产业已面临了新的疫病威胁,值得高度关注。
1 材料与方法
1.1 样品采集与处理
2012年 6月自河北某对虾养殖场采集发病中国明对虾成虾,对虾大小8—10cm;2013年1月自福建某对虾养殖场采集发病凡纳滨对虾幼虾,个体大小4—5cm;2013年3月自广东某对虾育苗场采集凡纳滨对虾亲虾,个体大小 16—18cm。采集的河北对虾新鲜样品保存于-80°C,留作RNA提取用,而另外两地对虾肝胰腺样品使用RNAlater(Qiagen)保存于1.5mL RNase-free离心管,留作提取RNA使用,三地对虾样品均取头胸部,用 Davidson’s AFA 固定液固定 24h,换75%乙醇长期保存,组织留作组织病理切片使用。
1.2 组织病理切片制作
Davidson’s AFA 固定液固定的对虾样品进行石蜡组织切片和苏木精-伊红染色(Bell,1988),封片后,于光学显微镜(Nikon E800,日本)下观察结果。
1.3 RNA的提取
从 RNAlater保存的样品上切取一小块于RNase-free水中10min后,放入800μL TRIzol Reagent(Invitrogen)中;冰冻样品切取小块后直接放入 800μL TRIzol Reagent(Invitrogen)中。使用RNase-free研磨棒对样品进行组织研磨,研磨后向其中加入160μL氯仿,振荡混匀后室温静置15min,4°C,12000rpm离心15min;取上层水相,加入等体积冰浴异丙醇,混匀后室温放置5min,4°C,12000rpm离心10min,沉淀加入1mL冰浴75%乙醇小心混匀,室温静置5min,4°C,12000rpm 离心 5min,沉淀晾干,加入 50μL RNasefree水溶解,并经核酸蛋白测定仪(NANO Drop 2000,USA)测定其浓度与纯度,置于-80°C保存。
1.4 YHV的套式RT-PCR
1.4.1 cDNA的合成 参考《Manual of Diagnostic Tests for Aquatic Animals》(OIE,2012)推荐的关于YHV的标准检测方法进行样品检测,同时设置凡纳滨对虾 β-actin基因作为内参对照。所使用的引物的目标基因为YHV-PmA replicase polyprotein 1ab gene(EU977578),序列见表1。
取 2μL RNA,加入引物 Y1 和 Y2(50μmol/L)各0.7μL、2.6μL RNase-free H2O,混匀后离心,70°C 反应 10min后,向体系中加入 2μL 5×MMLV Buffer、1μL RNase inhibitor(40U/uL,TaKaRa)、 0.5μL dNTP(10mmol/L),42°C预热2min,加入0.5μL MMLV逆转录酶(200U/μL,TaKaRa),42°C 保温 1h,70°C 反应10min。以此合成的cDNA作为检测YHV用模板。
于此同时,按照 Prime Script®1ststrand cDNA synthesis Kit(TaKaRa)说明书进行基因组cDNA的合成,将逆转录样品预混置于65°C 5min后,冰上淬冷,配制逆转录酶反应液,缓慢混匀,30°C 10min,42°C 1h,95°C 5min。以此合成的cDNA作为设置内参对照用模板。

表1 用于PCR扩增的引物序列Tab.1 Primers sequences for PCR amplification
1.4.2 第 1步 PCR 在 PCR 管中加入 2.5μL 10×Taq PCR Buffer(Mg2+free,TaKaRa)、1.5μL MgCl2(25mmol/L)、0.5μL dNTP(10mmol/L)、引物 Y1 和 Y2(50μmol/L)各 0.35μL、0.25μL Taq DNA 聚合酶(5U/μL)、19.05μL RNase-free H2O,85°C 预热 3min 后,加入 0.5μL cDNA,扩增反应程序为:95°C 30s、66°C 30s、72°C 45s,35 个循环;72°C 7min,4°C 保温。
1.4.3 第 2步 PCR 在 PCR 管中加入 2.5μL 10×Taq PCR Buffer(Mg2+free,TaKaRa)、1.5μL MgCl2(25mmol/L)、0.5μL dNTP(10mmol/L)、引物 Y2 和 Y3(50μmol/L)各 0.35μL、0.25μL Taq DNA 聚合酶(5U/μL)、18.55μL RNase-free H2O,85°C 预热 3min 后,加入 1μL第 1步 PCR反应产物,扩增反应程序为:95°C 30s、66°C 30s、72°C 45s,35 个循环;72°C 7min,4°C保温。并对两步PCR产物进行1%琼脂糖凝胶电泳,使用凝胶成像仪(培清)进行照相。
1.5 三地样品的快速高灵敏度检测试剂盒检测
采用 YHV快速高灵敏度检测试剂盒(张庆利等,2011)的改进型号(中国水产科学研究院黄海水产研究所海水养殖生物疾病控制与分子病理学实验室),分别对来自三地的样品所提取的RNA按试剂盒说明书进行检测。
2 结果
2.1 对虾症状
在河北某对虾养殖场发病池边的浅水区不容易看到濒死虾,通过撒网捞取发病的中国对虾,观察对虾发病症状,与正常对虾相比,发现对虾肝胰腺区域颜色变浅发黄,部分对虾肝胰腺明显萎缩,空胃,空肠,肠道略微肿胀,腹节肌肉轻微浑浊。在福建某对虾养殖场池边捞取的发病凡纳滨对虾通体白浊,甲壳软,与肉之间有分离感,肝胰腺颜色浅。在广东某对虾育苗场发现凡纳滨对虾亲虾肝胰腺颜色浅,部分出现萎缩,空肠空胃,腹节肌肉轻微浑浊,部分对虾呈现黑鳃或黄鳃。
2.2 病理组织切片
河北某对虾养殖场样品的肝胰腺盲管间以及肝胰腺区域中肠上皮血淋巴细胞浸润,部分盲管完全被细菌感染,并被大量血淋巴细胞包裹形成结节(图1a),肝胰腺盲管上皮的B、R和F细胞消失,部分上皮细胞核肿大(图1b),中肠和肝胰腺浸润的血淋巴细胞以及淋巴器官中可观察到较多的核固缩、破裂和嗜碱性细胞质包涵体(图1c)。福建对虾样品的肝胰腺组织盲管间存在血细胞浸润,部分肝胰腺盲管上皮细胞层萎缩变薄(图1d),肝胰腺盲管上皮的B、R和F细胞消失,部分细胞核肿大,并存在细胞核仁膨大形成包涵体样(图1e、图1f)。在广东对虾样品的肝胰腺盲管间也观察到血淋巴细胞浸润(图1g),肝胰腺盲管上皮的B、R和F细胞消失(图1g、图1h),部分细胞核肿大(图1h),肝胰腺盲管上皮层萎缩,与盲管膜分离(图1g、图1i)。
2.3 套式PCR检测结果
采用OIE手册推荐的YHV检测的套式PCR方法,检测来自河北、广东、福建的对虾样品(图2),第1步 PCR反应结果表明,来自河北对虾样品可得到794bp目的条带,而其余两地来源对虾样品在第1步PCR后未能得到此目的条带;第1步PCR反应后,三地样品均可扩增得到277bp目的条带。
2.4 三地样品中未知病原与YHV/鳃联病毒(GAV)的同源性及其系统发育分析
将以上目的产物测序,经NCBI BLAST后(表2)可以看出,河北疑患 AHPNS样品的 YHV检测第 1步PCR反应产物的引物间的748bp目的条带的序列(YHV_AHPNS_hb2012,KF278563)与 YHV 1992(FJ848673.1)相应区段的相似性为 87%;河北(YHV_AHPNS_hb2012,KF278563)、福建(YHV_AHPNS_fj2013,KF278564)及广东(YHV_AHPNS_gd2013,KF278565)疑患 AHPNS样品中的 YHV检测第 2步PCR反应产物的引物间的 229bp目的条带的序列与YHV1995(FJ848674.1)的相应区段的相似性分别为89%、86.4%和76.5%。
由第1步PCR产物序列构建系统发育树,结果表明,YHV_AHPNS_hb2012(KF278563)与 YHV(EU487200)、YHV 1995(FJ848674)、YHV-PmA(EU977578)、YHV 1992(FJ848673)、YHV(FJ627274)、YHV 1999(FJ848675)等 6株 YHV 一起首先从 GAV(NC_010306)和 YHV type4(EU170438)亲缘关系中分离出来,位于一条主分支。但在这一主分支上,YHV_AHPNS_hb2012(KF278563)明显与6株YHV表现出较远的分离关系(图3a)。
由第2步PCR产物序列构建的系统发育树总体维持了上述关系,三地来源的YHV属同一次分支,但在这3株之间,YHV_AHPNS_hb2012(KF278563)与YHV_AHPNS_fj2013(KF278564)亲缘关系较近,而 YHV_AHPNS_gd2013(KF278565)又有较远的延伸(图3b)。

图1 肝胰腺病理组织观察Fig.1 Pathologic histology diagnosis in hepatopancreas

图2 套式PCR检测YHV结果Fig.2 Result of detecting YHV(yellow-head virus)by nested-PCR

表2 三地来源的YHV检测产物序列与YHV1992、YHV1995对应序列的比对Tab.2 Alignment between the sequences of the products of YHV(yellow-head virus)detections and those of YHV1992 and YHV 1995
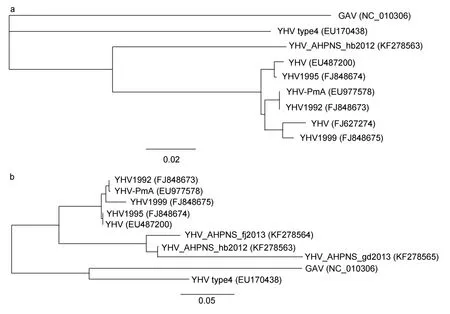
图3 疑患AHPNS对虾检出的YHV阳性片段序列与YHV/GAV相应序列的系统发育树Fig.3 Phylogenetic tree of the PCR products of the shrimp suspicious of suffering from AHPNS and the relevant sequences of YHV/GAV(gill-associated virus)

图4 三地样品YHV快速高灵敏度检测试剂盒检测结果Fig.4 Results of highly sensitive and rapid detection kit for YHV with the samples from three locations
2.5 三地样品的快速高灵敏度检测试剂盒检测
三地样品提取的RNA用YHV快速高灵敏度检测试剂盒进行80min的LAMP反应检测后显色,阳性对照颜色显示为强绿色,阴性对照颜色显示为橙黄色,表明试剂盒检测正常结果有效。三个地区取样的样品的 RNA经检测,结果全部显示强绿色,均为YHV强阳性。
3 讨论
YHD是 OIE收录的甲壳动物疫病,我国将其列为二类动物疫病。YHV基因型1是黄头病毒群的已知 6个基因型之一,也是黄头病的唯一病原(OIE,2012),GAV是黄头病毒群的基因型2,GAV和其他4个基因型(基因型3—6)通常只在东非、亚洲和澳大利亚养殖的健康斑节对虾中出现,很少与疫病相关(Walkeret al,2001;Wijegoonawardaneet al,2008;Wijegoonawardaneet al,2009)。经我们多年的流行病学监测,从未在我国养殖的对虾中检出过 YHV,从我国各地的水生动物流行病学监测数据中也从未发现我国有发生 YHD的情况,我国 2005年曾报道过YHV的检出,该样品是泰国入境的斑节对虾(熊炜等,2006)。本文采用 OIE标准,从我国养殖对虾中检测到 YHV的阳性,是我国养殖的对虾样品中首次检出YHV的存在。这一结果得到确认后,我们立即向农业部作了报告,随后,我国于 2012年底向 OIE通报了该疫病在我国的存在。
2010年以来,新发生的 EMS/AHPNS给对虾养殖业带来了严重损失,在国际上引起了广泛关注,虽然国际上对这一疫病的病症和病理特征给出了明确的定义,但该疫病的病原病因一直没有明确结论(Flegel,2012;Leanoet al,2012;Lightneret al,2012;NACA,2012),使疫病防控无从下手。本文观察到的症状与NACA对AHPNS的症状定义相符,且组织病理学特征也符合 AHPNS的组织病理学定义(NACA,2012),表明这些对虾确实罹患 AHPNS,在这些患病对虾中均一致检出我国从未检出过的 YHV新毒株,即引起AHPNS的病原可能是这一新基因型的YHV。
国际上有观点认为 AHPNS最早于2009年在中国南方发生(Flegel,2012;Leanoet al,2012)。我们在2009年的流行病学调查中采集到与AHPNS相似的凡纳滨对虾“偷死病”样品,但对所采集的样品的组织病理学与AHPNS病理学特征不符,其发病症状也有所差异,“偷死病”与AHPNS可能是2种不同病害(Huang,2012)。2010年越南对虾养殖业遭受了 AHPNS的严重打击,而我国当年对虾养殖产量并没有如越南那样受到严重影响,目前并没有确切的证据表明该病最早发生于我国。我国养殖对虾在此之前从未检出过YHV,该疫病病原得到确认以后,这一疫病的真正源头也将有可能逐步得以揭示。
在AHPNS的病因分析中,国内外学者都进行了多种病原的筛查,白斑综合征病毒(WSSV)等病原在很多检测中都表现出与该疫病不相关(Flegel,2012;Huang,2012;Lightneret al.2012),虽然从患病对虾中分离到了有致病力的副溶血弧菌(Vibrio parahaemolyticus)等细菌性病原(张宝存等,2012),但病理学和人工感染研究表明细菌的感染应该是继发感染(Flegel,2012;Lightneret al,2012;NACA,2012),我们的前期调查和国外研究者也排除了YHV感染的可能(Flegel,2012;Huang,2012;NACA,2012)。但本文研究结果显示,新检测到的 YHV遗传差异介于YHV致病1型与非致病4型之间,与已报道的YHV存在明显的差异,所测的基因片段的相似性在 90%以下,且对虾肝胰腺呈现与患AHPNS对虾相似的病理。用OIE手册的标准进行检测时,只有河北来源的样品在套式 RT-PCR的第 1步反应中得出目的产物,而福建和广东样品都只在套式的第2步扩增中得到微弱的产物条带,基因序列分析表明样品间存在明显的YHV变异,这符合 RNA病毒变异的特点,可能也导致 OIE标准方法灵敏度低,甚至检测不到,更多的序列分析和分子流行病学调查将最终揭示这个猜测。
YHV现场快速高灵敏检测试剂盒利用等温扩增检测方法,实现了对特异性对虾病毒病的快速、简便、高特异性、高灵敏度的检测,可应用于生产现场(张庆利等,2011)。试剂盒反应的绿色荧光的强弱对指示病毒量有一定参考价值,与 OIE标准方法的套式RT-PCR结果相比,对这一新的YHV毒株来说,快速高灵敏度检测试剂盒更适应于灵敏地检测,这对于在产业上更广泛地确认 YHV新毒株是否是 AHPNS的病原有重要意义,也将为AHPNS的防控提供关键技术。
致谢感谢河北、福建、广东相关单位及个人在本文样品采集方面提供的便利。
张庆利,黄 倢,杨 冰等,2011.对虾黄头病毒现场快速高灵敏检测试剂盒及检测方法.P:ZL 201010147946.2,国家知识产权局,2011-07-01
张宝存,刘 飞,边慧慧等,2012.一株凡纳滨对虾病原菌的分离、鉴定及其致病力分析.渔业科学进展,33(2):56—62
熊 炜,邱 璐,李 健等,2006.上海检验检疫局从泰国进境草虾中检出虾黄头病毒.检验检疫科学,16(6):61—63
Bell T A,Lightner D V,1988.A handbook of normal penaeid shrimp histology.Lawrence,Kansas
Chantanachookin C,Boonyaratpalin S,Kasornchandra Jet al,1993.Histology and ultrastructure reveal a new granulosislike virus inPenaeus monodonaffected by yellow-head disease.Dis Aquat Org,17(2):145—157
Cowley J A,Walker P J,Flegel T Wet al,2012.Family Roniviridae.In:Virus Taxonomy,IXth Report of the International Committee on Taxonomy of Viruses.King A,ed.Elsevier,Academic Press,London:797—801
Flegel T W,2012.Historic emergence,impact and current status of shrimp pathogens in Asia.J Invert Pathol,110(2):166—173
Huang J,2012.Experiences in EMS/AHPNS from China.In:Report of the Asia Pacific Emergency Regional Consultation on the Emerging Shrimp Disease:Early Mortality Syndrome(EMS)/ Acute Hepatopancreatic Necrosis Syndrome(AHPNS),9-10 Aug 2012.Published by the Network of Aquaculture Centres in Asia-Pacific,Bangkok,Thailand.2012:112—117
Leano E M,Mohan C V,2012.Early mortality syndrome threatens Asia’s shrimp farms.Global Aquaculture Advocate,July/August 2012:38—39
Lightner D V,Redman R M,Pantoja C Ret al,2012.Early mortality syndrome affects shrimp in Asia.Global Aquaculture Advocate,2012:40
NACA,2012.Report of the Asia Pacific emergency regional consultation on the emerging shrimp disease:early mortality syndrome(EMS)/ acute hepatopancreatic necrosis syndrome(AHPNS),9-10 Aug 2012.Published by the Network of Aquaculture Centres in Asia-Pacific,Bangkok,Thailand
OIE,2012.Manual of Diagnostic Tests for Aquatic Animals.World Organisation for Animal Health,http://www.oie.int/international-standard-setting/aquatic-manual/access-online/
Sittidilokratna N,Chotwiwatthanakun C,Wijegoonawardane P K Met al,2009.A virulent isolate of yellow head nidovirus contains a deformed envelope glycoprotein gp116.Virology,384(1):192—200
Walker P J,Cowley J A,Spann K Met al,2001.Yellow head complex viruses:Transmission cycles and topographical distribution in the Asia-Pacific Region.In:The New Wave,Proceedings of the Special Session on Sustainable Shrimp Culture,Aquaculture 2001,Browdy C.L.&Jory D.E.,ed.The World Aquaculture Society,Baton Rouge,LA,USA:292—302
Wijegoonawardane P K M,Cowley J A,Phan Tet al,2008.Genetic diversity in the yellow head nidovirus complex.Virology,380(2):213—225
Wijegoonawardane P K M,Cowley J A,Sittidilokratna Net al,2009.Homologous genetic recombination in the yellow head complex of nidoviruses infectingPenaeus monodonshrimp.Virology,390(1):79—88
