茶叶籽中黄酮的分离及HPLC-MS联用分析
2014-03-08杨安琪吕丽爽王华清李建林郑铁松
杨安琪,吕丽爽,王华清,李建林,郑铁松*
(南京师范大学金陵女子学院食品科学与营养系,江苏 南京 210097)
茶叶籽中黄酮的分离及HPLC-MS联用分析
杨安琪,吕丽爽,王华清,李建林,郑铁松*
(南京师范大学金陵女子学院食品科学与营养系,江苏 南京 210097)
用大孔吸附树脂HPD826分离纯化茶叶籽总黄酮的粗提物,对影响HPD826树脂动态吸附、解吸的各因素进行系统研究。最终确定最佳条件为:上样液质量浓度1.8 mg/mL、上样速率2 mL/min、体积分数50%乙醇作为洗脱剂、洗脱剂流速1 mL/min。纯化后的茶叶籽黄酮纯度为40.81%,比纯化前提高了7.63 倍。通过高效液相色谱-质谱联用分析大孔吸附树脂纯化后样品,初步确定茶叶籽中4 种黄酮的结构,均为柚皮素的多糖苷。
茶叶籽;总黄酮;纯化;高效液相色谱-质谱联用
茶叶籽是茶树(Camellia sinensis (L.) O. Kuntze, Theaceae)的种子,为茶叶生产的副产品[1-3]。茶叶籽资源丰富,但长期以来,人们对于茶叶的种植、加工和研究较多,而对茶叶籽这一茶叶生产副产品的开发利用不太重视,造成了资源的极大浪费。茶叶籽中富含山奈酚和柚皮素类的黄酮类化合物[2-8]。Gao Dafeng等[4]利用SephadexLH-20、硅胶柱层析从油茶饼粕中分离出8 种黄酮类化合物均为山奈酚衍生物。Chen[5]采用异丙醇盐析法从油茶籽饼粕中分离出7 种黄酮苷,其中3 种为山奈酚的糖苷,3 种为柚皮素的糖苷。Du[6]采用硅胶H柱从油茶籽中分离得到2 种山奈酚的衍生物,对肝癌细胞BEL-7402有较好的抑制作用。大孔树脂具有物理化学稳定性高、选择性好、可重复使用、能耗低、分离设备简单方便、适合工业化生产等优点,是一类有效的分离纯化黄酮类化合物的方法[9-11]。高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用技术是将HPLC对复杂样品的高分离能力与MS的高选择性、高灵敏度有效结合起来,可迅速地分析确定成分的结构,并且所需样品量少,是在缺乏标准品的情况下,分析天然产物等复杂体系中的化合物的重要工具,广泛应用于植物中黄酮类物质的分析[7,12-16]。
本研究将用大孔吸附树脂分离纯化茶叶籽总黄酮的粗提物,从AB-8、D101等12 种常用于分离纯化植物黄酮类化合物的树脂中,筛选出最适合分离纯化茶叶籽黄酮的树脂类型,对其纯化工艺条件进行研究,并用HPLCMS联用技术分析茶叶籽黄酮的结构,以期为茶叶籽黄酮的深入研究提供理论依据。
1 材料与方法
1.1 材料与试剂
茶叶籽(储叶种)由溧水县健茗茶厂提供;聚酞胺(60~90目) 浙江省台州市路桥四甲生化塑料厂;D101型、AB-8型、NKA-9型、X-5型大孔树脂 南开大学化工厂;DM130型、HPD450型、HPD600型、HPD722型、HPD750型、HPD826型大孔树脂 沧州宝恩吸附材料科技有限公司;各种大孔树脂型号、物理性能见表1;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、浓盐酸、石油醚等均为国产分析纯。
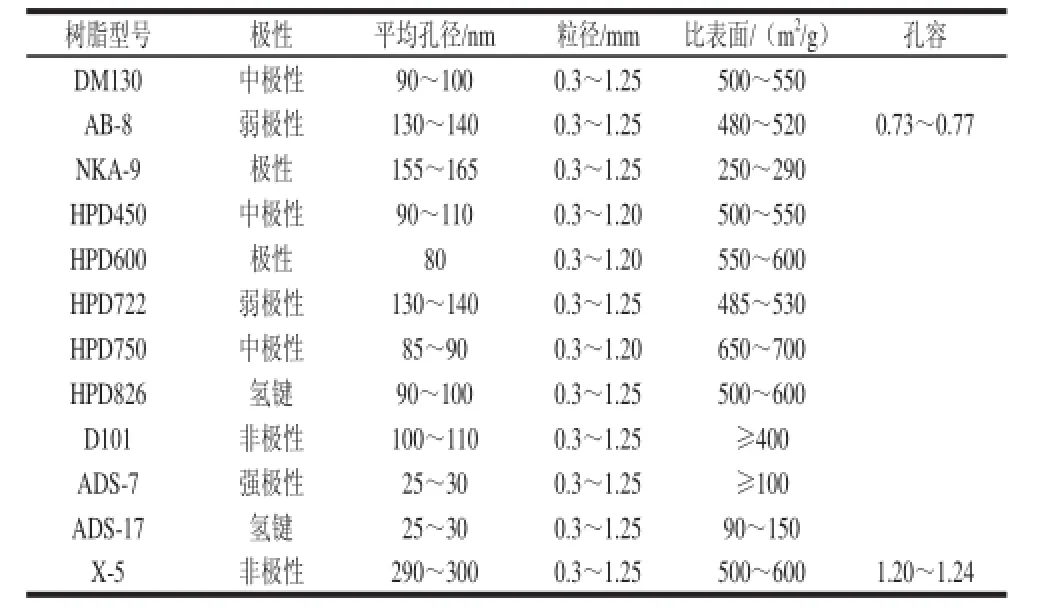
表1 大孔树脂的主要物理性质Table 1 Physical properties of macroporous resins
1.2 仪器与设备
N-1001型旋转蒸发仪 日本Eyela公司;Cary5000型紫外-可见-近红外分光光度计 美国Varian公司;DBS-100自动部分收集器、DHL-A恒流泵、HD-3型紫外检测仪 上海沪西分析仪器厂;1100 Series高效液相色谱仪、9460型四极杆串联质谱 美国安捷伦公司。
1.3 方法
1.3.1 总黄酮含量测定
采用硝酸铝络合分光光度法[17]。以芦丁为标准品,茶叶籽中总黄酮的提取量以mg/g表示[3]。
1.3.2 茶叶籽黄酮除杂液的制备
茶叶籽粉在液料比为26∶1(mL/g)、乙醇体积分数58%、提取温度82 ℃,提取时间2 h条件下提取2次,粗提液4 ℃冷藏静置12 h后过滤,经旋转蒸发浓缩。浓缩液用石油醚进行萃取以除去色素和油脂等杂质,连续萃取3 次至醚相无色后收集下层浓缩液。再加3 倍体积乙醇,搅拌均匀,4 ℃冷藏静置12 h以除去多糖、蛋白质等水溶性杂质,旋转蒸发浓缩,去除乙醇,用蒸馏水配制成所需的不同黄酮质量浓度的样品液,即为纯化用茶叶籽黄酮除杂液,4 ℃冷藏备用。
1.3.3 紫外光谱扫描
取2~3 mL适当质量浓度的茶叶籽黄酮除杂液于甲醇中,以甲醇作参比,在紫外-可见光分光光度计中扫描,扫描波长范围为200~500 nm。
1.3.4 各种树脂的静态吸附解吸
取一定量预处理好的树脂真空抽滤,准确称量2.0 g树脂于250 mL锥形瓶中,加入茶叶籽黄酮除杂液30 mL,密封后置于振荡培养箱(25 ℃,120 r/min)中振荡24 h。充分吸附后,过滤,测定滤液中总黄酮的质量浓度,计算各树脂的静态吸附率和吸附量。吸附后的树脂过滤抽干,置于250 mL锥形瓶中,加入体积分数60%的乙醇30 mL,密封后置于振荡培养箱(25 ℃,120 r/min)中振荡24 h,使总黄酮解吸附,过滤,测定洗脱液中黄酮质量浓度,计算各树脂的吸附率(%)、吸附量(mg/g)和解吸率(%)[8,11]。1.3.5 大孔树脂HPD826动态吸附和解吸
取1.6 cm×30 cm玻璃层析柱,装入预处理好的30 mL HPD826型树脂,将浓缩的除杂液加水稀释成一定质量浓度的上样液上柱吸附,控制流速,用紫外检测仪检测流出液,当流出液的吸光度基本没有变化时,认为大孔树脂达到动态吸附平衡,停止进样。收集流出液测定总黄酮含量,分别以吸附率、吸附量或解吸率为指标考察进样质量浓度(0.85、1.30、1.78、2.21、2.66 mg/mL)、上样流速(1、2、3、4、5 mL/min)、洗脱剂(乙醇)体积分数(20%、30%、40%、50%、60%、70%)及流速(0.5、1、1.5、2、2.5、3 mL/min,体积分数60%乙醇溶液)对树脂性能的影响,确定最佳条件。
将按最佳工艺得到的茶叶籽黄酮纯化液和粗提液减压浓缩,真空冷冻干燥至恒质量。分别精密称取一定质量的2 种样品溶于体积分数60%乙醇中,按黄酮含量计算方法测定其质量浓度,并按下式计算其纯度。
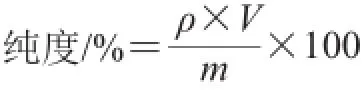
式中:ρ为样液中黄酮质量浓度/(mg/mL);V为定容体积/mL;m为样品质量/mg。
1.3.6 茶叶籽黄酮纯化液HPLC-MS分析条件
色谱条件:Zorbax XDB-C18色谱柱(4.6 mm× 250 mm,5 øm);DAD检测器;进样量3 μL;流速0.6 mL/min;柱温25 ℃;检测波长280 nm;流动相A:体积分数0.05%甲酸水溶液;流动相B:乙腈;流动相梯度:0 min(30% B),12 min(30% B),20 min(60% B)。
质谱条件:电喷雾离子(electrospray ionization,ESI)源,正、负离子模式检测;雾化压力20 psi;干燥气体的流速11 L/min;毛细管温度350 ℃;毛细管电压3.5 kV;扫描范围m/z 100~1 500。
2 结果与分析
2.1 样品紫外光谱扫描
对茶叶籽黄酮除杂液进行紫外光谱扫描,其最大吸收波长在280 nm左右,由于提取液经预处理已除去蛋白质,故可排除蛋白质在此波长条件下的干扰,因此在后期的分离纯化过程中采用280 nm波长条件下紫外跟踪检测上样和洗脱过程。
2.2 大孔吸附树脂的静态吸附和解吸
2.2.1 大孔吸附树脂对茶叶籽黄酮静态吸附率和吸附率测定
考察12 种树脂对茶叶籽黄酮的选择性,得到不同树脂的静态吸附率和解吸率,结果见表2。
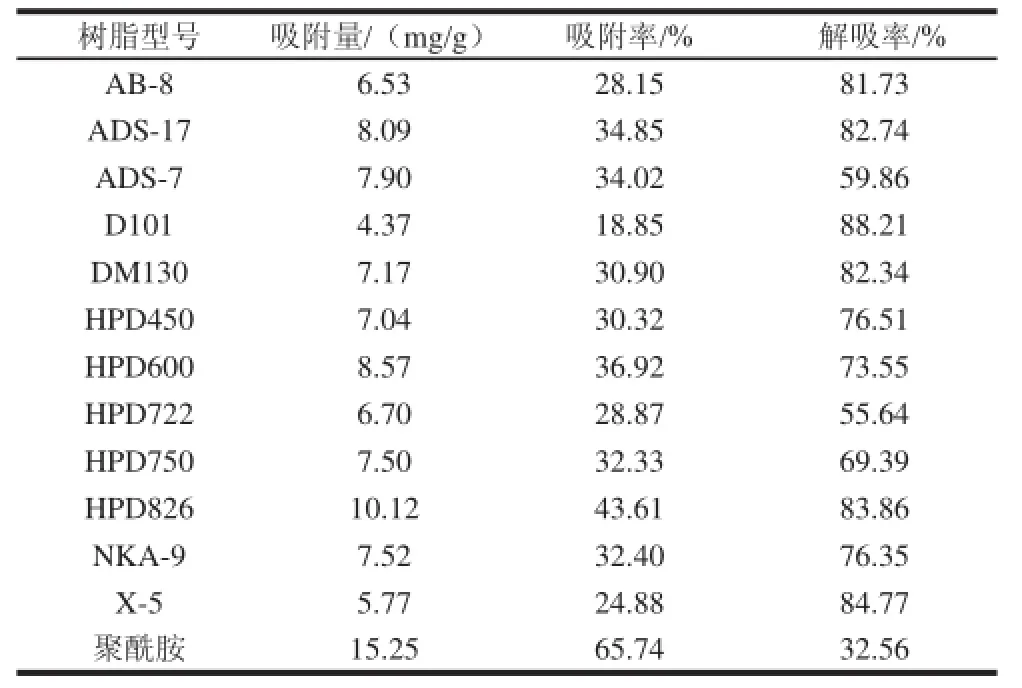
表2 各种树脂静态吸附率和解吸率Table 2 Absorption and desorption rates of different resins
树脂的吸附能力由树脂的极性、孔径、比表面积等多方面因素决定,对其性能的评价要从吸附量、解吸率以及动力学等方面综合考虑。本实验所选的树脂有非极性、弱极性、中极性、极性和氢键等类型。通过表2可以看出,非极性和弱极性的树脂吸附量很低,而氢键和极性的树脂吸附量相对较高,这可能是由于茶叶籽黄酮的极性相对较大,更有利于氢键和极性树脂吸附[18-19]。从表2可知,所选树脂中吸附量超过10 mg/g的仅聚酰胺和HPD826树脂2 种,且均为氢键吸附型树脂,说明氢键吸附型树脂更有利于茶叶籽黄酮的纯化。而聚酰胺树脂虽然吸附量最高,但解吸率仅32.56%,死吸附较大。而HPD826树脂对茶叶籽黄酮不仅有较好的吸附性而且有良好的解吸性,可以作为纯化茶叶籽黄酮的材料。进一步的实验表明,HPD826树脂吸附3 h基本已达到吸附饱和,属于快速平衡型。该结果与刘江波等[18]的报道一致。综合上述实验结果,选择吸附、解吸效果较好的、且吸附速率较大的HPD826大孔吸附树脂进行茶叶籽黄酮纯化实验。
2.2.2 大孔吸附树脂HPD826的动态吸附和解吸
2.2.2.1 进样质量浓度的确定
从图1可以看出,随着进样质量浓度的增加,黄酮吸附量也随之增加。但当进样质量浓度增加到1.78 mg/mL以后,进样质量浓度再增加,黄酮吸附量反而逐渐下降。这是因为进样质量浓度较低时,提高进样质量浓度可增加黄酮分子与大孔树脂的接触,加速黄酮分子进入树脂内部并迅速扩散[11,20]。但随着进样质量浓度的增大,与黄酮竞争吸附的杂质量也随之加大[11,20]。综合考虑应选择进样质量浓度为1.8 mg/mL左右进行上柱为宜。
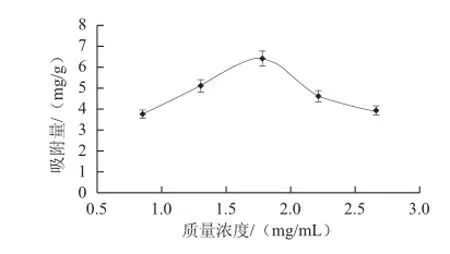
图1 进样质量浓度对树脂性能的影响Fig.1 Effects of sample concentration on the absorption efficiency of HPD826

图2 进样流速对树脂性能的影响Fig.2 Effect of sample loading flow rate on the absorption efficiency of HPD826
2.2.2.2 进样流速的确定不同进样流速的吸附量如图2所示,随着流速的增大,树脂对茶叶籽总黄酮的吸附量逐渐降低。树脂对黄酮的吸附需要一个扩散和接触的过程,进样流速过快,目标分子与树脂还未充分接触就已下移到下一个吸附层面,以至于很快通过层析柱流出柱外,这样就无法形成有效的吸附,从而影响分离效果[20-21]。较小的流速则有利于黄酮分子充分与树脂接触结合,被树脂吸附。但流速太小,会造成操作周期长,因此要选择合适的流速[18,20,22-23]。从结果来看,当流速大于2 mL/min时,吸附量迅速下降,因此选择2 mL/min的流速为上样速度。
2.2.2.3 洗脱剂乙醇体积分数的确定
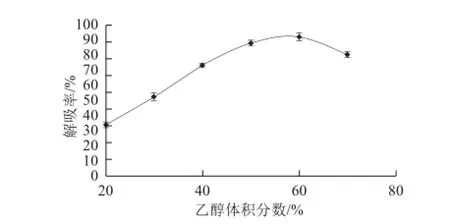
图3 乙醇体积分数对树脂性能的影响Fig.3 Effect of ethanol concentration on the desorption efficiency of HPD826
从图3可看出,随着乙醇体积分数的增加,茶叶籽黄酮的解吸率逐渐增加,当乙醇体积分数达到50%时,解吸率的变化趋于平缓,乙醇体积分数60%时解吸率达到最大,再增加乙醇体积分数解吸率反而成下降趋势。虽然用体积分数60%的乙醇洗脱时解吸率最高,但乙醇体积分数越高,洗脱液中醇溶性杂质就越多,成本也更高。所以综合考虑解吸率、纯度和成本等因素,选择体积分数50%乙醇作为本实验的洗脱剂。

图4 洗脱流速对树脂性能的影响Fig.4 Effect of ethanol flow rate on the desorption efficiency of HPD826
2.2.2.4 洗脱剂流速的确定从图4可看出,随着洗脱流速的增大,茶叶籽黄酮的解吸率逐渐降低,乙醇还没有把大孔吸附树脂吸附的黄酮完全洗脱就流出了柱子,造成了原料的浪费。另外,流速太低又使生产周期延长,降低效率。通常情况下控制洗脱流速为吸附流速的1/3~1/2[22-23]。因此,洗脱液流速选择1 mL/min。
2.2.2.5 动态洗脱曲线

图5 动态洗脱曲线Fig.5 Dynamic elution curve of HPD826 resin
动态洗脱曲线如图5所示,该洗脱曲线峰形良好,无明显拖尾现象,表明用体积分数50%乙醇溶液以2 mL/min的速度洗脱效果良好。先用蒸馏水洗柱可以除去多糖、茶皂素等水溶性杂质。再用体积分数50%乙醇洗脱,6 h后洗脱液的吸光度降到与乙醇洗脱前基本相同且长时间保持不变,可认为树脂上的黄酮已基本被洗脱下来,可以停止洗脱。
2.2.2.6 大孔树脂HPD826纯化效果
茶叶籽黄酮粗提物,经初步除杂、大孔树脂纯化、真空浓缩干燥得到的茶叶籽黄酮纯化物的纯度为40.81%,比纯化前4.73%提高了7.63 倍,说明HPD826树脂纯化效果较好,适合茶叶籽黄酮的富集纯化。
2.2.3 HPLC-MS分析鉴定茶叶籽黄酮纯化液
茶叶籽黄酮纯化液经HPLC-MS联用仪分析,所得HPLC图和总离子流图如图6所示,根据一、二级质谱图和紫外吸收光谱图分析其中主要成分,结合文献[7]初步确定图中4 个峰均为黄酮类化合物。

图6 纯化液总离子流图(A)和高效液相色谱图(B)Fig.6 Total ion chromatogram (A) and HPLC chromatogram (B) of purified flavonoids
2.2.3.1 化合物Ⅰ的结构分析
为更确切地获得目标分子的质谱信息,本实验采用正、负离子双重模式获得电喷雾电离质谱图。在HPLC条件下,ESI正离子模式(ESI+-MS)中,会出现[M+ Na]+、[M+K]+、[M+H]等离子峰[9,13,15];ESI负离子模式(ESI--MS)中,会出现[M+Cl]-、[M-H]-等离子峰[24-26]。化合物Ⅰ的一、二级质谱图见图7(A、B、C),在ESI+-MS图中离子峰m/z 897.4为[M+Na]+峰,m/z 913.3为[M+K]+峰,在ESI-MS图中,m/z 873.4为准分子离子峰[M-H]-,m/z 909.3为[M+Cl]-峰,说明化合物Ⅰ的相对分子质量为874.4。继续对m/z 873.4离子进行二级质谱分析,碎片离子m/z 271.0[M-H-162-132-162-146]-为[M-H]-脱去4 个糖配基的产物,m/z 753.1[M-H-120]-为[M-H]-通过逆狄尔斯-阿德尔(Retro Diels-Alder,RDA)裂解反应脱去B环产生,此碎片说明该分子母核B环上有—OH取代,另有m/z 150.8的碎片离子,这与柚皮素的裂解规律一致[27-28],联系该物质的紫外吸收光谱,推测其可能为苷元为柚皮素的四糖苷。此外,在ESI-MS-MS图谱中,碎片离子m/z 710.2[M-H-162]-为[M-H]-脱去一分子葡萄糖基的产物,碎片离子m/z 577.2[M-H-162-132-H]-为m/z 710.2脱去一分子吡喃木糖基的产物。结合文献[7]推断该物质为柚皮素-7-O-[β-D-吡喃木糖基(1→6)] [β-D-葡萄糖基(1→3)-α-L-鼠李糖基(1→2)]-β-D-葡萄糖苷(naringenin-7-O-[β-D-xylopyranosyl(1→6)] [β-D-glucopyranosyl(1→3)-α-L-rhamnopyranosyl(1→2)]-β-D-glucopyranoside)。
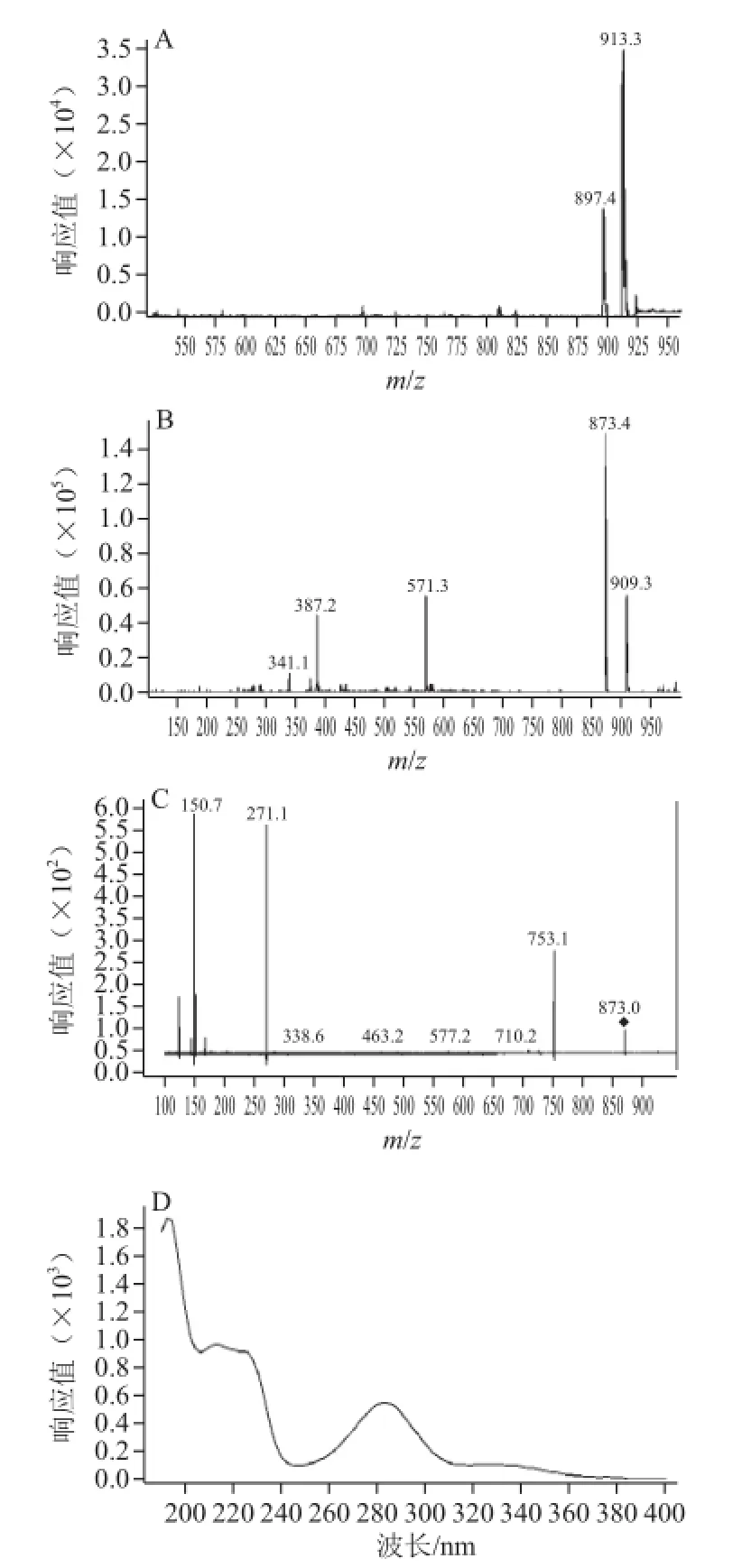
图7 化合物Ⅰ的一级(A、B)、二级(C)质谱图及紫外吸收光谱图(D)Fig.7 Primary (A, B) and secondary (C) MS spectra as well as ultraviolet (UV) spectrum (D) of compound Ⅰ
2.2.3.2 化合物Ⅱ的结构分析
化合物Ⅱ的一、二级质谱图见图8(A、B、C),在ESI+-MS图中离子峰m/z 735.3为[M+Na]+峰,m/z 751.3为[M+K]+峰,在ESI-MS图中,m/z 711.2为准分子离子峰[M-H]-,m/z 747.1为[M+Cl]-峰,说明化合物Ⅱ的相对分子质量为712.2。继续对m/z 712.2离子进行二级质谱分析,碎片离子m/z 271.0[M-H-132-162-146]-为[M-H]-脱去3 个糖配基的产物,m/z 591.2[M-H-120]-为[M-H]-通过RDA裂解反应脱去B环产生,此碎片说明该分子母核B环上有-OH取代,另有m/z 150.8和119.1的碎片离子,这与柚皮素的裂解规律一致[27-28],联系该物质的紫外吸收光谱,推测其可能为苷元为柚皮素的三糖苷。此外,在ESIMS-MS图谱中,碎片离子m/z 458.7[M-H-120-132]-为m/z 591.2脱去一分子吡喃木糖基的产物。结合文献[7],推测其结构为柚皮素-7-O-α-L-鼠李糖基(1→2)-[β-D-吡喃木糖基(1→6)]-β-D-葡萄糖苷(aringenin-7-O-α-L-rhamnopyranosyl(1→2)-[β-D-xylopyranosyl(1→6)]-β-D-glucopyranoside)。

图8 化合物Ⅱ的一级(A、B)、二级(C)质谱图及紫外吸收光谱图(D)Fig.8 Primary (A, B) and secondary (C) MS spectra as well as UV spectrum (D) of compound Ⅱ
2.2.3.3 化合物Ⅲ的结构分析
化合物Ⅲ的一、二级质谱图见图9,在ESI+-MS图中离子峰m/z 765.0为[M+Na]+峰,m/z 781.2为[M+K]+峰,在ESI--MS图中,m/z 741.3为准分子离子峰[M-H]-,m/z 777.3为[M+Cl]-峰,说明化合物Ⅲ的相对分子质量为742.3。继续对m/z 741.3离子进行二级质谱分析,碎片离子m/z 271.0[M-H-162-162-146]-为[M-H]-脱去3个糖配基的产物,m/z 621.3[M-H-120]-为[M-H]-通过RDA裂解反应脱去B环产生,此碎片说明该分子母核B环上有-OH取代,另有m/z 151.0的碎片离子,这与柚皮素的裂解规律一致[27-28],联系该物质的紫外吸收光谱,推测其可能为苷元为柚皮素的三糖苷。此外,在ESI--MS-MS图谱中,碎片离子m/z 579.2[M-H-162]-为[M-H]-脱去一分子葡萄糖基的产物,碎片离子m/z 433.1[M-H-162-146]-为m/z 579.2脱去一分子鼠李糖基的产物。结合文献[7],推测其结构为柚皮素-7-O-β-D-葡萄糖基(1→3)-α-L-鼠李糖基(1→2)-β-D-葡萄糖苷(naringenin-7-O-β-D-glucopyranosyl(1→3)-α-L-rhamnopyranosyl(1→2)-β-D-glucopyranoside)。

图9 化合物Ⅲ的一级(A、B)、二级(C)质谱图及紫外吸收光谱图(D)Fig.9 Primary (A, B) and secondary (C) MS spectra as well as UV spectrum (D) of compound Ⅲ
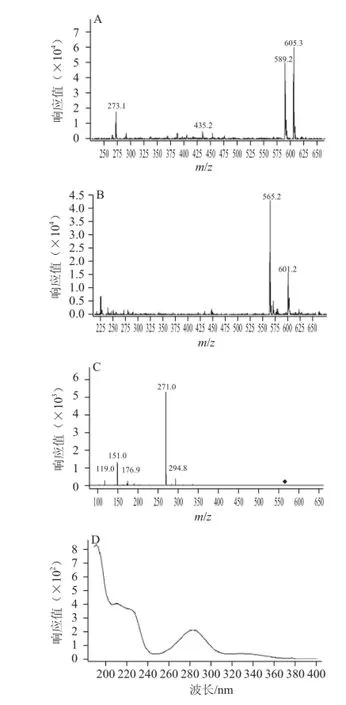
图10 化合物Ⅳ的一级(A、B)、二级(C)质谱图及紫外吸收光谱图(D)Fig.10 Primary (A, B) and secondary (C) MS spectra as well as UV spectrum (D) of compound Ⅳ
2.2.3.4 化合物Ⅳ的结构分析
化合物Ⅳ的一、二级质谱图见图10(A、B、C),在ESI+-MS图中离子峰m/z 589.2为[M+Na]+峰,m/z 605.2为[M+K]+峰,在ESI--MS图中,m/z 565.2为准分子离子峰[M-H]-,m/z 601.2为[M+Cl]-峰,说明化合物Ⅳ的相对分子质量为566.2,继续对m/z 565.2离子进行二级质谱分析,产生碎片离子m/z 271.0为[M-H-132-162]-离子,另有m/z 151.1、176.9、119.0的碎片离子,这与柚皮素的裂解规律一致[27-28],联系紫外吸收光谱,推测其可能为柚皮素的二糖苷。此外,在ESI-MS中还得到m/z 435.2的碎片离子,表明该物质的外侧糖基可能为木糖。结合文献[7],推测其结构为柚皮素-7-O-β-D-吡喃木糖基(1→6)-β-D-葡萄(naringenin-7-O-β-D-xylopyranosyl(1→6)-β-D-glucopyranoside)。
3 结 论
通过考察12 种树脂对茶叶籽总黄酮的吸附、解吸特性,综合考虑吸附率、解吸率、静态动力学等因素,HPD826树脂有较高的吸附率和解吸率,适合用来纯化茶叶籽总黄酮。对影响HPD826树脂吸附解吸的各因素进行了系统研究,最终确定最佳条件为:上样液质量浓度为1.8 mg/mL、上样流速2 mL/min、体积分数50%的乙醇作为洗脱剂、洗脱剂流速1 mL/min。此条件下的洗脱曲线峰形对称,分离较为完全。样品纯化后的茶叶籽黄酮纯度为40.81%,比纯化前提高了7.63 倍,说明HPD826树脂纯化效果较好。通过HPLC-MS对茶叶籽黄酮做了分析,初步确定茶叶籽中的4 种黄酮结构,均为柚皮素的多糖苷。
[1] 曹国锋, 邬冰, 钟守贤. 茶叶籽油、油茶籽油与茶树油的区别[J]. 中国油脂, 2008, 33(8): 17-20.
[2] 侯留鑫, 王华清, 郑铁松, 等. 一种新型茶叶籽黄酮单体的分离鉴定及其抗氧化活性研究[J]. 食品科学, 2013, 34(21): 115-120.
[3] 王华清, 李起弘, 郑铁松. 茶叶籽中总黄酮的提取及结构的初步鉴定[J]. 食品工业科技, 2012, 33(7): 282-286.
[4] GAO Dafeng, XU Min, ZHAO Ping, et al. Kaempferol acetylated glycosides from the seed cake of Camellia oleifera[J]. Food Chemistry, 2011, 124(2): 432-436.
[5] CHEN J H, WU H Y, LIAU B C, et al. Identification and evaluation of antioxidants defatted Camellia oleifera seeds by isopropanol saltingout pretreatment[J]. Food Chemistry, 2010, 121(4): 1246-1254.
[6] DU L C, WU B L, CHEN J M. Flavonoid triglycosides from the seeds of Camellia oleifera Abel[J]. Chinese Chemical Letters, 2008, 19(11): 1315-1318.
[7] LI N, MORIKAWA T, MATSUDA H, et al. New flavanone oligoglycosides, theaflavanosides Ⅰ, Ⅱ, Ⅲ, and Ⅳ, with hepatoprotective activity from the seeds of tea plant (Camellia sinensis)[J]. Heterocycles, 2007, 71(5): 1193-1201.
[8] PARK J S, RHO H S, KIM D H, et al. Enzymatic preparation of kaempferol from green tea seed and its antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2006, 54(8): 2951-2956.
[9] WAN P F, SHENG Z L, HAN Q, et al. Enrichment and purification of total flavonoids from Flos Populi extracts with macroporous resins and evaluation of antioxidantactivities in vitro[J]. Journal of Chromatography B, 2014, 945/946: 68-74.
[10] KIM J, YOON M, YANG H, et al. Enrichment and purification of marine polyphenol phlorotannins using macroporous adsorption resins[J]. Food Chemistry, 2014, 162: 135-142.
[11] 邓荣华, 郭宇星, 李晓明, 等. 芦蒿秸秆总黄酮富集纯化及产物鉴定[J].食品科学, 2013, 34(9): 85-89.
[12] ZHANG J Y, LU J Q, GAO X Y, et al. Characterization of thirtynine polymethoxylated flavonoids (PMFs) in the branches of Murraya paniculata by HPLC-DAD-ESI-MS/MS[J]. Chinese Journal of Natural Medicines, 2013, 11(1): 63-70.
[13] 李晨, 姜子涛, 李荣. 高效液相色谱-串联质谱联用技术鉴定樱桃叶中的黄酮成分[J]. 食品科学, 2013, 34(16): 226-229.
[14] de RIJKE E, OUT P, NIESSEN W, et al. Analytical separation and detection methods for flavonoids[J]. Journal of Chromatography A, 2006, 1112(1): 31-63.
[15] BERTIN R L, GONZAGA L V, BORGES G S C, et al. Nutrient composition and, identification/quantification of major phenolic compounds in Sarcocornia ambigua (Amaranthaceae) using HPLCESI-MS/MS[J]. Food Research International, 2014, 55: 404-411.
[16] KRUGER A, GANZERA M. Oroxylum indicum seeds-Analysis of flavonoids by HPLC-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 70: 553-556.
[17] 李敏, 杨建华, 李渊, 等. 酒花黄酮提取工艺和含量测定[J]. 食品科学, 2011, 32(6): 16-19.
[18] 刘江波, 傅婷婷, 吕秀阳. 大孔树脂分离纯化三叶青总黄酮的工艺研究[J]. 中国药学杂志, 2011, 46(4): 287-292.
[19] 张素华, 王正云. 大孔树脂纯化芦笋黄酮工艺的研究[J]. 食品科学, 2006, 27(2): 182-186.
[20] 徐怀德, 陈佳, 包蓉, 等. 大孔吸附树脂分离纯化洋葱皮黄酮的研究[J].食品科学, 2011, 32(12): 133-138.
[21] 尹忠平, 上官新晨, 张月红, 等. 大孔树脂吸附纯化青钱柳叶三萜化合物[J]. 食品科学, 2011, 32(6): 61-65.
[22] 王孟楚, 李超. AB-8型大孔吸附树脂分离纯化鼠曲草总黄酮工艺[J].食品科学, 2011, 32(24): 88-91.
[23] 李超, 王乃馨, 郑义, 等. AB-8型大孔吸附树脂分离纯化大叶金花草总黄酮[J]. 食品科学, 2011, 32(16): 31-35.
[24] 张永, 严安定, 高建. 液质联用技术鉴定甘草提取物中的主要化学成分[J]. 中草药, 2012, 34(6): 1111-1115.
[25] 彭红, 林鹿, 刘玉环, 等. 负离子模式下纤维低聚糖的ESI-MS分析[J]. 食品科学, 2009, 30(12): 147-149.
[26] 王源园, 张尊建, 徐向阳, 等. 密花石斛与马鞭石斛不同药用部位的色谱指纹图谱研究[J]. 中药材, 2005, 28(7): 563-566.
[27] 杨洁, 陈纯, 邢建军, 等. 油菜蜂花粉中黄酮类化合物的提取与鉴定[J].食品科学, 2010, 31(22): 273-278.
[28] FABRE N, RUSTAN I, de HOFFMANN E, et al. Determination of flavone, flavonol, and flavanone aglycones by negative ion liquid chromatography electrospray ion trap mass spectrometry[J]. Journal of the American Society for Mass Spectrometry, 2001, 12(6): 707-715.
Purification of Total Flavonoids from Tea (Camellia sinensis L.) Seeds and Composition Analysis by HPLC-MS
YANG An-qi, LÜ Li-shuang, WANG Hua-qing, LI Jian-lin, ZHENG Tie-song*
(Department of Food Science and Nutrition, Ginling College, Nanjing Normal University, Nanjing 210097, China)
HPD826 resin was selected to purify flavonoids from tea seeds and the optimum chromatographic conditions were determined as follows: sample concentration 1.8 mg/mL, sample loading flow rate 2 mg/mL, and 50% ethanol as the eluent at a flow rate of 1 mL/min. Under these conditions, the purity of flavonoids from tea seeds was increased 7.63 times to 40.81% compared with that before optimization. The composition and structures of the extracted flavonoids were analyzed by HPLC-MS. The four flavonoid compounds purified from tea seeds were all characterized as aglycon naringenin.
tea seed; total flavonoids; purification; high performance liquid chromatography-mass spectrometry (HPLC-MS)
TS201.2
A
1002-6630(2014)24-0228-07
10.7506/spkx1002-6630-201424044
2014-06-26
江苏省自然科学基金项目(BK2012850);江苏省高校自然科学研究项目(12KJB5500005);
浙江省自然科学基金项目(LY12C15001)
杨安琪(1991—),女,硕士研究生,研究方向为食品化学与加工。E-mail:yanganqi91528@163.com
*通信作者:郑铁松(1963—),男,教授,博士,研究方向为食品生物化学。E-mail:tiesongzheng@sina.com
