陈皮中川陈皮素的提取分离及改性
2014-03-08罗世坤王家欢徐兰英李士明
罗世坤,王家欢,徐兰英,龙 涛,*,李士明,2,*
(1.黄冈师范学院化工学院,催化材料制备及应用湖北省重点实验室,湖北 黄冈 438000;2.罗格斯大学食品科学系,美国 新泽西州 新布朗士维克 08901)
陈皮中川陈皮素的提取分离及改性
罗世坤1,王家欢1,徐兰英1,龙 涛1,*,李士明1,2,*
(1.黄冈师范学院化工学院,催化材料制备及应用湖北省重点实验室,湖北 黄冈 438000;2.罗格斯大学食品科学系,美国 新泽西州 新布朗士维克 08901)
以陈皮中川陈皮素的提取、分离纯化以及改性为目的,采用无水乙醇浸提陈皮得浸膏,以氯仿为萃取剂萃取浸膏,得到多甲氧基黄酮混合物,再以硅胶为吸附剂、乙酸乙酯和石油醚的混合液为洗脱剂,采用柱色谱法分离多甲氧基黄酮化合物,经高效液相色谱和气相色谱-质谱检测并与标准品对比,最终确证得到川陈皮素纯品。研究从川陈皮素到5-去甲基川陈皮素的合成路线,优化了改性条件,在浓盐酸与无水乙醇体积比为1∶9条件下,将川陈皮素加热回流反应24 h,可以得到纯度大于97%的5-去甲基川陈皮素。
陈皮;分离纯化;多甲氧基黄酮;川陈皮素;5-去甲基川陈皮素
陈皮为芸香科(Rutaceae)植物橘(Citrus reticulata Blanco)及其栽培变种的干燥成熟果皮,分为陈皮和广陈皮[1]。陈皮中含有黄酮类、柠檬苦素类、生物碱类、挥发油及其他成分[2],能有效地改善和提高小肠的消化功能,对心脏有兴奋作用,还具有抗氧化、抗过敏、抗肿瘤等作用[3]。
陈皮中的黄酮化合物种类与含量非常丰富,其活性与内含化合物的黄酮种类和含量都有着直接关系。已有研究[4-8]发现橘皮中多羟基黄酮和黄烷酮具有很好的抗氧化作用,能够有效清除自由基,降低慢性疾病的发病率,并且具有很强的抗炎、抗癌活性。而多甲氧基黄酮的生物活性在最近几年开始引起重视。多甲氧基黄酮具有抗炎、防癌抗癌、降低胆固醇和防止胆固醇氧化等生物学活性[9-15]。最近研究表明,多甲氧基混合物的衍生物,5-去甲基多甲氧基化合物不但有更强的抗炎抗癌活性[9-10],还具有很好的抗癌作用[16-17]。目前研究较多的是橘皮中3个主要多甲氧基黄酮化合物,即陈皮素、川陈皮素和3,5,6,7,8,3’,4’-七甲氧基黄酮,以及它们的5-去甲基衍生物,即5-去甲基陈皮素、5-去甲基川陈皮素和5-羟基-3,6,7,8,3’,4’-六甲氧基黄酮[16-18]。
目前分离提取黄酮类化合物的方法主要有超声提取法、大孔吸附树脂法、硅胶柱层析法、超临界流体萃取法、高速逆流色谱法[19-24]。赵雪梅等[23]采用反复硅胶柱层析的方法,从常山胡柚中分离出了橙皮苷、5,7,4’-三羟基二氢黄酮、川陈皮素、柑橘黄酮、5-羟基-6,7,8,3’,4’-五甲氧基黄酮、5-羟基-3,6,7,8,3’,4’-六甲氧基黄酮6种黄酮类化合物。
本研究采用硅胶柱层析法,以乙酸乙酯-石油醚为淋洗液,对陈皮中黄酮类化合物进行了分离纯化,得到较高纯度的川陈皮素,含量达到99.7%。对川陈皮素进行修饰,得到含量大于97%的5-去甲基川陈皮素,为陈皮的作用机理研究提供重要的理论依据。
1 材料与方法
1.1 材料与试剂
陈皮 湖北黄州百联大药房。
无水乙醇、氯仿、石油醚、乙酸乙酯(分析纯)、乙腈(色谱纯) 国药集团化学试剂有限公司;浓盐酸(分析纯) 中国平煤神马集团开封东大化工有限公司试剂厂。
1.2 仪器与设备
2XZ-1型旋片式真空泵 临海市谭氏真空设备有限公司;CCA-20低温冷却水循环泵、SHZ-DⅢ循环水真空泵 巩义市予华仪器有限责任公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;DZTW调温电热套 北京市永光明医疗仪器厂;2695型高效液相色谱(high performance liquid chromatograpy,HPLC)仪美国Waters公司;5975C型气相色谱-质谱(gas chromatograpy-mass spectrometry,GC-MS)联用仪 美国Agilent公司。
1.3 方法
1.3.1 色谱分离条件
HPLC条件:Waters C18(4.6 mm×250 mm,5 μm)液相色谱柱;流动相:乙腈-水(梯度:0~15 min,40%~55%乙腈;15~20 min,55%~70%乙腈;20~25 min,70%~80%乙腈;25~30 min,80%~40%乙腈);流速:1.0 mL/min;柱温:35 ℃;检测波长:326 nm;进样量:20 μL。
GC-MS条件:HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气,柱流速1 mL/min,进样口温度280 ℃,分流比50∶1;起始温度60 ℃,以50 ℃/min速率升温至300 ℃,保持10 min;进样体积1 μL,质谱离子扫描范围为m/z 50~550。
1.3.2 川陈皮素的提取分离
提取:将陈皮粉末和无水乙醇按固液比1∶10进行混合,浸泡48 h后过滤,将得到的滤液旋蒸至稠膏状。
萃取:将稠状物用适量氯仿-水(体积比为1∶1)溶液溶解,振荡一段时间后静置,取氯仿层旋转蒸发,得多甲基黄酮混合物。
装柱:将1.6 g多甲基黄酮混合物溶于少量氯仿。取100 g硅胶(200~300目)于烧杯中,加入适量石油醚,搅拌,以湿法将硅胶装入6 cm×30 cm的层析柱中,上层加入适量海沙,待石油醚液面降至海沙表面时,加入多甲基黄酮混合物溶液。
洗脱:依次用350 mL乙酸乙酯-石油醚溶液进行洗脱,其中乙酸乙酯含量分别为35%、55%、75%、85%、95%,每50 mL收集一瓶,从第1瓶开始按顺序编号,直到95%的洗脱液洗脱完毕。
检测:分别将样品瓶中的溶液旋转蒸发,得到的固体物质用无水乙醇定容至25 mL,用HPLC进行测定。
1.3.3 川陈皮素标准溶液工作曲线
称取川陈皮素标准品,用无水乙醇配制成0.4 mg/mL储备液,然后将储备液逐级稀释成质量浓度分别为0.04、0.08、0.10、0.20 mg/mL的工作溶液,用HPLC进行检测,绘制工作曲线。
1.3.4 5-去甲氧基川陈皮素的制备
取20 mg川陈皮素置于100 mL圆底烧瓶中,加入18 mL无水乙醇和2 mL浓盐酸,加热回流一定时间,将回流后的溶液进行旋转蒸发,得到金黄色固体;将固体用50 mL乙酸乙酯-水(体积比1∶1)溶液溶解,将溶液转移至分液漏斗,静置,溶液分层。取上层溶液,加入20 mL水,振荡分液漏斗,使溶液充分混合,静置,取上层溶液;将此溶液旋蒸得到固体物,用无水乙醇溶解并定容至100 mL。
2 结果与分析
2.1 川陈皮素标准溶液的工作曲线
将配制好的川陈皮素工作溶液进行HPLC检测,以溶液质量浓度为纵坐标、对应峰面积为横坐标作图,得工作曲线,线性方程为Y=0.001 6X+0.001 4,其中Y为溶液质量浓度,X为吸收峰面积。方程的相关系数R2为0.999 9,表明质量浓度与峰面积线性关系良好。
2.2 正相色谱分离多甲氧基黄酮
用5 种不同乙酸乙酯质量分数的洗脱剂(乙酸乙酯与石油醚组成)洗脱,分别收集到37 个样品瓶中,由洗脱过程中用薄层色谱(thin layer chromatography,TLC)跟踪判断1~3号样品瓶为石油醚,4~10、11~17、18~24、25~31、32~37号样品瓶分别是质量分数为35%、55%、75%、85%、95%乙酸乙酯的洗脱剂洗脱所得溶液。
HPLC检测结果中,35%乙酸乙酯洗脱剂洗脱之后主要得到5 种物质,其中第8号样品瓶的液相色谱分离结果见图1A。该组分中保留时间在13 min以后的化合物含量很高,说明35%乙酸乙酯洗脱剂可将极性较小的物质洗脱下来,根据文献[9,16]判断,这部分化合物是5-去甲基多甲氧基黄酮。由对川陈皮素标准品的检测结果可知,川陈皮素的保留时间约为11.5 min,所以此溶液中的物质都是极性较弱的物质,与黄酮类化合物标准品的保留时间对比,可以确定保留时间为13.6 min的物质为橘皮素,因而可以加大洗脱剂极性,使保留时间较短的物质洗脱出来。
用55%乙酸乙酯洗脱剂洗脱之后主要得到两种物质,其中第15号样品的色谱分离结果见图1B。保留时间为13.6 min的橘皮素在35%乙酸乙酯洗脱剂的洗脱液中也有出现;保留时间为12.7 min的物质是新洗脱下来的一种物质,经与黄酮类化合物标准品对比液相色谱保留时间,确定其为3,5,6,7,8,3’,4’-七甲氧基黄酮。 由图1B还可明显看出,55%的乙酸乙酯洗脱剂几乎不能将川陈皮素洗脱下来,川陈皮素含量仅为0.48%,所以进一步加大了洗脱剂极性。

图1 多甲基黄酮液相色谱图Fig.1 HPLC of polymethoxylated flavonoids
用75%乙酸乙酯洗脱剂洗脱下来的主要有3 种物质,其中第18号样品的色谱分离结果见图2A。由图2可知,洗脱液中还有橘皮素和3,5,6,7,8,3’,4’-七甲氧基黄酮,保留时间为11.1 min处出现了新的色谱峰,经对比黄酮类化合物标准品保留时间初步确定为川陈皮素。图2B为75%乙酸乙酯洗脱剂继续洗脱得到的第24号样品液相色谱图,可以看出,此时保留时间大于11 min的黄酮化合物已几乎全部被洗脱下来,保留时间为9.2 min的物质已经出现,对比黄酮类化合物标准品的图谱可知该物质为3,5,6,7,3’,4’-六甲氧基黄酮,此时川陈皮素的峰面积很小,可以判断川陈皮素已几乎被完全洗脱下来。

图2 75 2 75%乙酸乙酯洗脱多甲基黄酮液相色谱图Fig.2 HPLC of polymethoxylated flavonoids eluted by 75% EtOAc/25% petroleum ether

图3 第20号样品液相色谱图(A)及质谱图(B)Fig.3 HPLC (A) and mass spectrum (B) of sample 20
从第20号样品的液相色谱图(图3A)可以看出,溶液中几乎只有川陈皮素一种物质峰,通过峰面积归一化法进行计算,其纯度高达99.7%。取该样品同时进行GC-MS检测,结果见图3B,其分子离子峰为402.1,和川陈皮素(标准品)一致,进一步证实分离得到的物质为川陈皮素。
2.3 5-去甲基川陈皮素的制备
称取3 份20 mg川陈皮素粉末于100 mL圆底烧瓶中,分别加入20 mL浓盐酸与无水乙醇混合液(无水乙醇-浓盐酸体积比9∶1),加热回流分别反应12、24 h和30 h。然后将反应液减压浓缩,浓缩物溶于乙酸乙酯,水洗,再减压浓缩,将产物溶解于无水乙醇并定容至100 mL,考察反应时间对5-去甲基川陈皮素产率的影响。
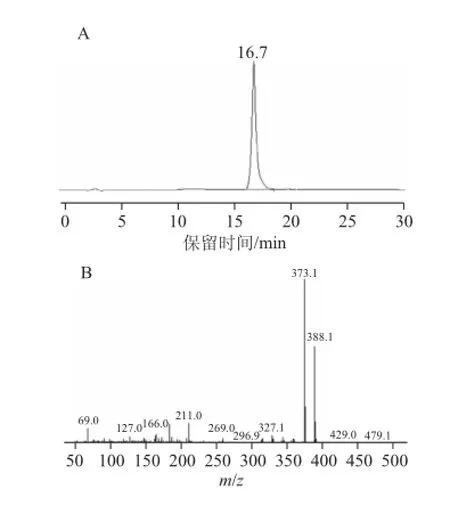
图4 5-去甲氧基川陈皮素液相色谱图(A)及质谱图(B)Fig.4 HPLC (A) and mass spectrum (B) of 5-demethynobiletin
图4A为反应液反应24 h后的液相色谱图和质谱图。可以看出,保留时间为11.1 min的川陈皮素峰已基本消失,保留时间为16.7 min处出现明显的色谱峰,对照标准品的保留时间,初步确定此物质为5-去甲基川陈皮素,采用面积归一化法得其纯度达97.5%。取该样品同时进行GC-MS检测,结果如图4B,其分子离子峰为388.1,和5-去甲基川陈皮素标准品一致,证实制备得到的物质为5-去甲基川陈皮素。

表1 反应时间对5-去甲基川陈皮素制备的影响Table 1 Effect of reaction time on the preparation of 5-demethynobiletin
结合表1分析可知,回流反应12 h后5-去甲基川陈皮素转化率不高,回流24 h后已基本反应完全,当回流时间达到30 h时,反应产物的转化率提高并不明显。鉴于环保节能的理念,今后大量合成最佳反应时间应控制为24 h,这样既节约合成时间,也能有一个较高的产率。
3 结 论
陈皮和川陈皮素具有很强的生物活性[25],而川陈皮素是陈皮中3 个主要多甲氧基黄酮之一,含量高于其他多甲氧基黄酮,因此,从陈皮中分离鉴定川陈皮素,对于陈皮的生物活性机理研究具有重意义。 本实验通过对陈皮中川陈皮素纯品的提取分离等条件的研究,成功地用硅胶柱,以25%石油醚和75%乙酸乙酯为洗脱剂,分离得到了川陈皮素纯品,并对其结构进行了鉴定。
已有研究[9]指出了5-去甲基川陈皮素具有比川陈皮素更强的生物活性,因此,本实验研究了从川陈皮素到5-去甲基川陈皮素的合成路线,并优化了实验条件,确定了较优的合成方案。在浓盐酸与无水乙醇体积比为1∶9的溶液中,将川陈皮素加热回流反应24 h,可以得到纯度大于97%的5-去甲基川陈皮素。
[1] 赵小艳, 吕武清. 陈皮的研究概况[J]. 中国药业, 2006, 15(15): 68-69.
[2] 杨洁. 陈皮化学成分的研究[D]. 长春: 吉林大学, 2013.
[3] 欧立娟, 刘启德. 陈皮药理作用研究进展[J]. 中国药房, 2006, 17(10): 787-788.
[4] IWASE Y, TAKEMURA Y, FURUKAWA H, et al. Inhibitory effect of flavonoids from citrus plants on Epstein-Barr virus activation and two-stage carcinogenesis of skin tumors[J]. Cancer Letters, 2000, 154(1): 101-105.
[5] LOPEZ-LAZARO M. Flavonoids as anticancer agents: structureactivity relationship study[J]. Current Medicinal Chemistry-Anti-Cancer Agents, 2002, 2(6): 691-714.
[6] MANTHEY J A, GUTHRIE N, GROHMANN K. Biological properties of citrus flavonoids pertaining to cancer and inflammation[J]. Current Medicinal Chemistry, 2001, 8(2): 135-153.
[7] WILCOX L J, BORRADAILE N M, HUFF M W. Secretion of hepatocyte apoB is inhibited by the flavonoids, naringenin and hesperetin, via reduced activity and expression of ACAT2 and MTP[J]. Journal of Lipid Research, 2001, 42(5): 725-734.
[8] GARG A, GARG S, ZANEVELD L J D, et al. Chemistry and pharmacology of the citrus bioflavonoid hesperidin[J]. Phytotherapy Research, 2001, 15(8): 655-669.
[9] LI S M, PAN M H, LAI C S, et al. Isolation and syntheses of polymethoxyflavones and hydroxylated polymethoxyflavones as inhibitors of HL-60 cell lines[J]. Bioorganic and Medicinal Chemistry, 2007, 15(10): 3381-3389.
[10] PAN M H, LAI Y S, LAI C S, et al. 5-Hydroxy-3,6,7,8,3’,4’-hexamethoxyflavone induces apoptosis through reactive oxygen species production, growth arrest and DNA damage inducible gene 153 expression, and caspase activation in human leukemia cells[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5081-5091.
[11] SERGEEV I N, LI S M, COLBY J, et al. Polymethoxylated flavones induce Ca2+-mediated apoptosis in breast cancer cells[J]. Life Sciences, 2006, 80(3): 245-253.
[12] PAN M H, LI S M, LAI C S, et al. Inhibition of citrus flavonoids on 12-O-tetradecanoylphorbol 13-acetate-induced skin inflammation and tumorigenesis in mice[J]. Food Science and Human Wellness, 2012, 1(1): 65-73.
[13] LAI C S, LI S M, LIU C B, et al. Effective suppression of azoxymethane-induced aberrant crypt foci formation in mice with citrus peel flavonoids[J]. Molecular Nutrition and Food Research, 2013, 57(3): 551-555.
[14] LAI C S, LI S M, MIYAUCHI Y, et al. Potent anti-cancer effects of citrus peel flavonoids in human prostate xenograft tumors[J]. Food and Function, 2013, 4(6): 944-949.
[15] LI S M, SANG S M, PAN M H, et al. Anti-inflammatory property of the urinary metabolites of nobiletin in mouse[J]. Bioorganic and Medicinal Chemistry Letters, 2007, 17(18): 5177-5181.
[16] LI S M, PAN M H, LO C Y, et al. Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxyflavones[J]. Journal of Functional Foods, 2009, 1(1): 2-12.
[17] LAI C S, LI S, CHAI C Y, et al. Inhibitory effect of citrus 5-hydroxy-3,6,7,8,3’,4’-hexamethoxyflavone on 12-O-tetradecanoylphorbol 13-acetate-induced skin inflammation and tumor promotion in mice[J]. Carcinogenesis, 2007, 28(12): 2581-2588.
[18] 邱培菊. 5-羟基多甲氧基黄酮抗结肠癌活性及其分子机制研究[D].青岛: 中国海洋大学, 2010.
[19] 王华, 任廷远, 安玉红. 超声波辅助乙醇提取柑橘皮渣发酵液总黄酮工艺探究[J]. 食品科学, 2009, 30(24): 206-212.
[20] 麻明友, 刘建本, 吴显明, 等. 超声微波双辅助提取柑橘皮总黄酮的研究[J]. 食品科学, 2010, 31(20): 266-269.
[21] 黄明发, 苏学素, 焦必宁, 等. 柑橘多甲氧基黄酮的检测及分离纯化技术研究进展[J]. 食品科学, 2009, 30(1): 275-281.
[22] 尹嵩, 张莉, 黄超, 等. 橙皮中生物类黄酮的分离纯化工艺研究[J].贵州化工, 2008, 33(1): 19-22.
[23] 赵雪梅, 朱大元. 胡柚皮中的黄酮类化合物[J]. 中草药, 2003, 34(1): 11-13.
[24] 过利敏, 张平, 张谦, 等. 雪菊化学成分分析、提取、鉴定及其生物活性研究进展[J]. 食品科学, 2014, 35(7): 298-304.
[25] LI S M, WANG H, GUO L M, et al. Chemistry and bioactivity of nobiletin and its metabolites[J]. Journal of Functional Foods, 2014, 6(1): 2-10.
Extraction and Modification of Nobiletin from Tangerine Peel
LUO Shi-kun1, WANG Jia-huan1, XU Lan-ying1, LONG Tao1,*, LI Shi-ming1,2,*
(1. Hubei Key Laboratory for Processing and Application of Catalytic Materials, College of Chemical Technology, Huanggang Normal University, Huanggang 438000, China; 2. Department of Food Science, Rutgers University, New Brunswick 08901, USA)
The aim of this research is to extract, purify and modify nobiletin from dried orange peel. The extraction process was carried out by means of infiltration. The extract was further extracted with chloroform to obtain a fraction rich in polymethoxylated fl avonoids and the target compounds were separated on a silica gel column with a mobile phase consisting of a mixture of ethyl acetate and petroleum ether. Pure nobiletin was obtained as indicated by reversed phase HPLC and GC-MS and through comparison with reference standards. The conversion conditions from nobiletin to 5-demethylnobiletin was optimized and it was found that 5-demethylnobiletin with a purity higher than 97% was produced when the reaction was performed for 24 h under heat refl uxing condition with a volume ratio of 1:9 between concentrated hydrochloric acid and absolute ethanol.
citrus peel; separation and purification; polymethoxylated flavonoids; nobiletin; 5-demethynobiletin
O6-332
A
1002-6630(2014)24-0020-04
10.7506/spkx1002-6630-201424004
2014-07-15
国家自然科学基金青年科学基金项目(21205046);湖北省科技厅对外合作项目(2014BHE036);经济林木种质改良与资源综合利用湖北省重点实验开放基金项目(2013001603)
罗世坤(1990—),男,学士,研究方向为天然产物化学。E-mail:326966605@qq.com
*通信作者:龙涛(1979—),男,讲师,博士,研究方向为天然产物化学。E-mail:longtao@hgnu.edu.cn李士明(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:Shiming@rutgers.edu
