蒽酮法测定红枣可溶性糖含量条件的优化
2014-03-08吴翠云王合理
位 杰,吴翠云,2,蒋 媛,王合理,*
(1.塔里木大学植物科学学院,新疆 阿拉尔 843300;2.新疆生产建设兵团塔里木盆地生物资源保护利用兵团重点实验室,新疆 阿拉尔 843300)
蒽酮法测定红枣可溶性糖含量条件的优化
位 杰1,吴翠云1,2,蒋 媛1,王合理1,*
(1.塔里木大学植物科学学院,新疆 阿拉尔 843300;2.新疆生产建设兵团塔里木盆地生物资源保护利用兵团重点实验室,新疆 阿拉尔 843300)
以红枣为试材,通过单因素试验研究反应温度、蒽酮质量浓度、蒽酮用量、显色反应时间、冷却时间对红枣可溶性糖含量测定的影响,并采用正交试验优化测定红枣可溶性糖含量的最佳反应条件。结果表明,红枣可溶性糖含量测定的最佳条件为:蒽酮质量浓度25 mg/mL、蒽酮试剂用量3 mL、室温反应时间1 min、冷却时间25 min。该方法操作简便、快速、灵敏度高。验证实验结果表明,蔗糖标准液含量在20~240 μg/mL范围内有较好的线性关系(A=0.004 5C-0.013 4,相关系数为R2=0.999 2,式中,A为吸光度;C为糖含量)。实验重现性好,相对标准偏差(relative standard deviation,RSD)为0.20%(n=3);平均回收率达102.87%,RSD为0.84%(n=3)。最佳优化条件下测得的红枣可溶性糖含量为68.43%(以干质量计)。
蒽酮法;红枣;可溶性糖;优化
枣(Zizyphus jujube Mill.)原产于我国,又名大枣、枣子、红枣,栽培历史悠久,是最具代表性的民族果树。枣的营养价值和药用价值都很高,具有多种营养保健功能。新疆红枣近年来发展迅速,得天独厚的地理条件和气候环境造就了新疆红枣的优良品质,使得新疆红枣受到越来越多的消费者的青睐。因此,充分运用现代科技手段提取和开发红枣功能成分,对其进行深加工和新产品研究,提高附加值,具有重要的意义。糖是红枣中重要的天然活性成分,对抗氧化、抗衰老、抗肿瘤、调血脂、降血糖以及提高机体免疫力具有重要作用[1-3],总糖能反映出食品营养素的组成,还可以计算食品中由糖类物质提供的热量[4]。此外,可溶性糖也是高等植物光合作用的主要产物,是决定枣果实品质和风味的重要指标,其含量的多少直接影响枣果的口感和甜度,而不同的枣品种其糖含量也不尽相同。多糖的检测通常采用比色法测定,影响显色的因素主要有显色剂用量、显色剂浓度、显色温度及显色时间等[5-6]。蒽酮法是目前常用的糖定量测定方法,其原理是糖在浓硫酸作用下,经脱水反应生成的糠醛或羟甲基糠醛与蒽酮反应,生成蓝绿色化合物,在一定的范围内,颜色深浅与糖的含量成正比[7]。蒽酮法测定可溶性糖因其准确性高、重现性好、操作简便、快速、灵敏[8]等优点而被广泛应用于各种植物组织中可溶性糖含量的测定。
学者们对蒽酮法的反应条件进行研究,林炎坤[9]提出利用浓硫酸与水反应放热的“水合热法”来代替外加热法,张妙霞等[10]也提出蒽酮硫酸法室温显色的灵敏度高,显色充分,测定误差小;但大多数的研究还是采用外加热法[11-14]。不同的测定方法其测定结果往往差异很大,同一种方法应用于不同的植物其差异也很大。关于蒽酮法测定红枣可溶性糖含量反应条件的研究还鲜见报道,因此有必要对其测定条件进行探讨和优化,以期获得蒽酮法测定红枣可溶性糖的最佳条件,并将其应用到实践中去,为红枣可溶性糖的深入研究、应用以及枣种质资源品种性状的评价提供一定的实验依据。
1 材料与方法
1.1 材料与试剂
成熟后自然风干的灰枣,采自塔里木大学园艺试验站。果实成熟度一致,大小均匀。蔗糖、浓硫酸、蒽酮均为分析纯。
1.2 仪器与设备
BP211D电子分析天平 广州广一科学仪器有限公司;HH-S数显恒温水浴锅 江苏省金坛市医疗仪器厂;UV1800紫外-可见分光光度计 上海菁华科技仪器有限公司;Multifuge X1R高速冷冻离心机 德国Heraeus公司。
1.3 方法
1.3.1 红枣可溶性糖提取液的制备
红枣可溶性糖提取液的制备参考郭明等[15]方法:温度84℃、时间32 min、料液比1∶12。
1.3.2 试验设计
通过对反应温度、蒽酮试剂质量浓度、蒽酮试剂用量、反应时间、冷却时间等影响红枣可溶性糖含量测定的条件进行单因素试验,并在单因素试验的基础上进行正交优化设计试验,确定红枣可溶性糖含量测定的最佳条件。在最优条件下制作蔗糖标准曲线和回归方程,并测定精密度和回收率。
1.3.3 精密度与回收率
精密度:将同一红枣可溶性糖提取液样品分成3份,每份在最佳反应条件下测定其可溶性糖含量,求3次测定结果的平均值和相对标准偏差(relative standard deviation,RSD)。
回收率:向已知可溶性糖含量的红枣可溶性糖提取液中加入定量的无水蔗糖,按最佳优化条件测定其可溶性糖含量,计算回收率。
2 结果与分析
2.1 单因素试验
2.1.1 反应温度对吸光度的影响
分别取样液1 mL于试管中,同时另取一支试管,向其中加入1 mL蒸馏水作为空白对照管,各管中分别加入5 mL质量浓度20 mg/mL蒽酮试剂,每处理3 次重复。分别于室温(18)、10、20、30、40、50、60、70、80、90、100 ℃水浴中反应10 min,冷水中冷却10 min,在620 nm波长处测吸光度,测定结果见图1。

图1 反应温度对吸光度的影响Fig.1 Effect of reaction temperature on absorbance
由图1可知,在室温条件下,显色反应即可达到完全,随着水浴温度的升高,样液吸光度逐渐下降,80℃后又缓慢升高,但吸光度仍低于室温的吸光度。在室温条件下,浓硫酸与水发生水合反应放出大量热量,使反应系统自行升温,即可达到充分显色,因此,试验中采用水合热法免去了外加热,使操作更为简便,即节约了能源又提高了工作效率。
2.1.2 蒽酮试剂质量浓度对吸光度的影响

图2 蒽酮试剂质量浓度对吸光度的影响Fig.2 Effect of anthrone concentration on absorbance
分别配制不同质量浓度的蒽酮试剂(5、10、15、20、25、30、40 mg/mL),分别取样液1 mL于试管中,同时另取一支试管,向其中加入1 mL蒸馏水作为空白对照管,各试管中分别加入5 mL不同质量浓度的蒽酮试剂,每处理3 次重复。室温条件下反应10 min,冷水中冷却10 min,在620 nm波长处测吸光度。测定结果见图2。
由图2可知,随着蒽酮试剂质量浓度的增加,样品吸光度逐渐增大。蒽酮试剂质量浓度达到20 mg/mL时,吸光度趋于稳定,说明此时可溶性糖与蒽酮试剂已经反应完全,此后再增加蒽酮的量,吸光度也不再增大。而在蒽酮试剂质量浓度低于20 mg/mL时,蒽酮的量不足,反应不完全,致使吸光度偏低。从充分反应和经济角度两方面来看,蒽酮试剂的最佳质量浓度为20 mg/mL。
2.1.3 蒽酮试剂用量对吸光度的影响
分别取样液1 mL于试管中,同时另取一支试管,向其中加入1 mL蒸馏水作为空白对照管,各管中分别加入1、2、3、5、7、9、10 mL质量浓度20 mg/mL的蒽酮试剂,每处理3 次重复。室温条件下反应10 min,冷水中冷却10 min,在620 nm波长处测吸光度,测定结果见图3。

图3 蒽酮试剂用量对吸光度的影响Fig.3 Effect of anthrone reagent consumption on absorbance
由图3可知,蒽酮试剂使用量不同,对红枣可溶性糖的显色效果也不同,用量在1~3 mL时,随着用量的增加,吸光度逐渐增大,蒽酮试剂用量为3 mL时,样品吸光度达到最大。此后再增加蒽酮试剂的用量,吸光度逐渐下降。结果表明,蒽酮试剂最佳用量为3 mL。
2.1.4 反应时间对吸光度的影响
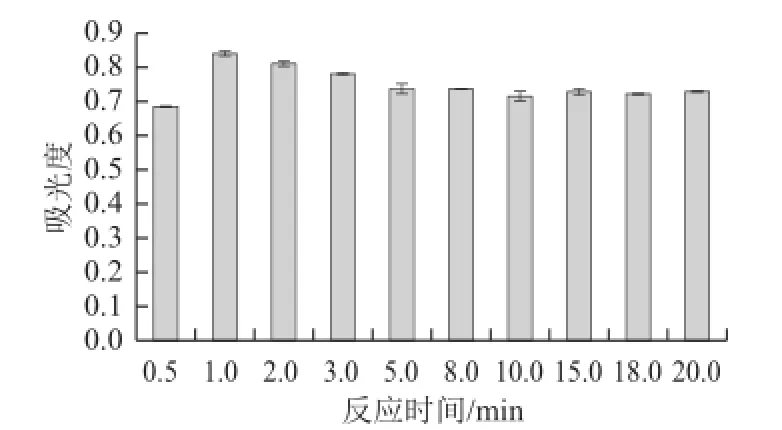
图4 反应时间对吸光度的影响Fig.4 Effect of reaction time on absorbance
分别取样液1 mL于试管中,同时另取一支试管,向其中加入1 mL蒸馏水作为空白对照管,各管中分别加入3 mL质量浓度20 mg/mL的蒽酮试剂,每处理3 次重复。室温条件下显色反应0.5、1、2、3、5、8、10、15、18、20 min,冷水中冷却10 min,在620 nm波长处测吸光度,测定结果见图4。
由图4可知,反应时间对样品可溶性糖含量测定的影响较大,显色反应时间短,反应不完全,随着反应时间的延长,样品吸光度逐渐下降,15 min后吸光度变化差异不大。因此,宜将显色反应时间控制在1~3 min内。反应1 min后冷却所测定的总糖含量最高。因此,最佳反应时间确定为1 min。
2.1.5 冷却时间对吸光度的影响
分别取样液1 mL于试管中,同时另取一支试管,向其中加入1 mL蒸馏水作为空白对照管,各管中分别加入3 mL质量浓度20 mg/mL蒽酮试剂,每处理3 次重复。室温条件下反应1 min,冷水中冷却10、15、20、25、30、35、40 min,在620 nm波长处测吸光度,测定结果见图5。

图5 冷却时间对吸光度的影响Fig.5 Effect of cooling time on absorbance
从图5可以看出,随着冷却时间的延长,样液吸光度先升高然后下降,冷却时间30 min时吸光度达到最大。冷却时间太短,反应不能立即终止,就会出现反应聚合过度,从而使测量结果偏小。反之,冷却时间过长,也会造成比较大的误差。因此,确定最佳冷却时间为30 min。
2.2 正交试验
2.2.1 正交试验设计优化红枣可溶性糖测定

表1 正交试验LL9(334)设计及结果Table 1 Results of orthogonal experiments
在单因素试验的基础上,结合单因素试验结果,根据正交试验设计原理,以蒽酮质量浓度(20、25、30 mg/mL)、蒽酮试剂用量(2、3、5 mL)、反应时间(1、2、3 min)、冷却时间(20、25、30 min)设计四因素三水平正交试验,试验结果见表1,方差分析结果见表2。
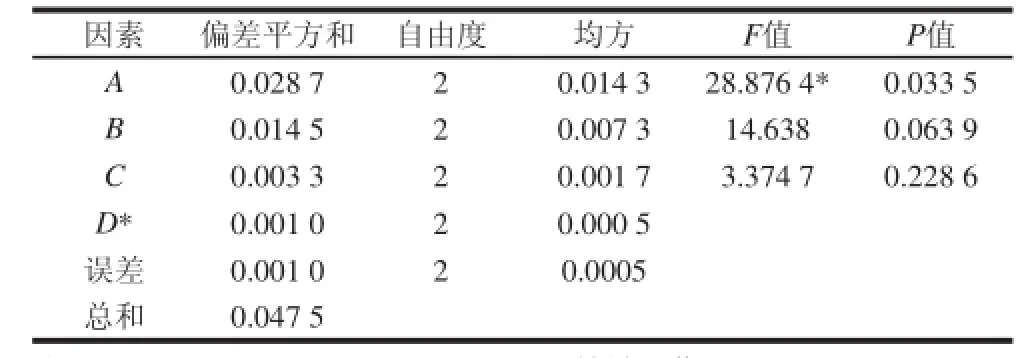
表2 正交试验设计方差分析表Table 2 Analysis of variance of the orthogonal experimental results
从表1和表2的极差、方差分析结果表明,各影响因子的主次顺序为:A蒽酮试剂质量浓度>B蒽酮试剂用量>C显色反应时间>D冷却时间,蒽酮试剂质量浓度对测定结果有显著影响,蒽酮试剂用量、显色反应时间、冷却时间对测定结果的影响不显著。正交试验确蒽酮法测定红枣可溶性糖最优组合为A3B2C1D2,即:蒽酮质量浓度25 mg/mL、蒽酮试剂用量3 mL、室温显色反应1 min、冷却时间25 min。由于正交试验最优组合A3B2C1D2未在L9(34)正交表中,因此,在最优化的测定条件下对其进行验证,3 次重复的平均吸光度结果为1.013,高于正交试验号所有组合的试验结果,表明正交优化试验确定的最优组合结果准确可靠。
2.2.2 验证实验
将分析纯蔗糖在80 ℃条件下烘至恒质量,精确称取2.000 g,加少量水溶解并定容至100 mL,取出1 mL再定容至100 mL,即得0.2 mg/mL的蔗糖标准液。分别取蔗糖标准液0、0.1、0.2、0.4、0.6、0.8、1.0、1.2 mL,蒸馏水定容至2.0 mL,然后各加入20 mg/mL蒽酮试剂5 mL,室温显色1 min后冷却25 min,然后在620 nm波长处比色。以吸光度为纵坐标,糖含量为横坐标,绘制标准曲线。蔗糖标准液的含量在20~240 μg/mL范围内有较好的线性关系,其回归方程为:A=0.004 5C-0.013 4,相关系数为R2=0.999 2;传统的蒽酮比色法(沸水浴加热)的回归方程为:A=0.003 2C-0.002,相关系数为R2=0.998 3。优化条件下的回归系数(0.004 5)高于传统蒽酮比色法的回归系数(0.003 2),优化条件的灵敏度高于传统的蒽酮比色法灵敏度的1.41 倍,表明优化方法具有较高的灵敏度。根据最佳优化条件测得的吸光度以及回归方程可得,红枣可溶性糖含量为68.43%(以干质量计)。
2.2.3 优化条件对水浴温度的验证
分别取样液1 mL于试管中,同时另取一支试管,向其中加入1 mL蒸馏水作为空白对照管,各管中分别加入3 mL质量浓度25 mg/mL蒽酮试剂,每处理3 次重复。分别于室温、10、20、30、40、50、60、70、80、90、100 ℃水浴中反应1 min,冷水中冷却25 min,在620 nm波长处测吸光度,测定结果见图6。

图6 优化条件下反应温度对吸光度的影响Fig.6 Effect of reaction temperature on absorbance under the optimum conditions
从图6可以看出,在最优化的实验条件下,样品液的吸光度随温度的升高先逐渐降低,后又缓慢升高至稳定,沸水浴的吸光度略低于室温反应的吸光度,表明蒽酮法测定枣可溶性糖在室温条件下显色即可达到完全。因此,可以采用室温显色以节约能源和简化操作,提高工作效率。
2.2.4 精密度与回收率实验

表3 红枣可溶性糖含量精密度实验结果(n=3)Table 3 Precision for replicate determinations of soluble sugar content in red jujubess ((n = 3)

表4 红枣可溶性糖含量回收率实验结果(n==33)Table 4 Recovery rates of soluble sugar in red jujubes spiked with sucrose (n = 3)
由表3可知,同一红枣样品3 次重复测得的可溶性糖平均含量为68.20%,RSD为0.20%,表明优化的实验方法具有较好的重现性。由表4可知,按优化的实验方法测得的红枣可溶性糖含量的平均回收率102.87%,RSD为0.84%,说明按上述优化的测定条件和回归方程,测定红枣可溶性糖含量的准确性较好。
3 讨论与结论
蒽酮法测定红枣可溶性糖不需要昂贵的仪器,简便快速,完全可以满足常规的分析要求。但此法干扰因素较多,如蒽酮试剂质量浓度、蒽酮试剂用量、显色反应时间、冷却时间以及外源加热与否都影响其显色,操作条件控制不好易引起误差。
经典的蒽酮比色法需使用沸腾的水浴[16-17],李利军等[18]在测定甘蔗含糖量时免去了水浴加热步骤,发展了新的蒽酮-硫酸法。本研究表明,直接利用硫酸与水发生水合反应时释放的热量,使反应体系自行升温,即可达到充分显色。从方法的简易程度比较,蒽酮法测定红枣可溶性糖室温显色省去了外加热一项,更为简便,提高了测定速度,对取样较多,测定任务较大的科研而言,这是一种较好的方法。
蒽酮不溶于水,易溶于浓硫酸,难溶于稀硫酸。蒽酮试剂的质量浓度和用量对显色有较大影响。蒽酮试剂质量浓度小,反应不完全,蒽酮试剂质量浓度过大,蒽酮难以溶解。蒽酮试剂用量少,不够反应消耗,多余糠醛没有参与反应,从而使结果偏小;蒽酮试剂用量多,稀释了显色液,使溶液光通透性减小,也会使结果偏小,这与王宏军等[19]的研究结果相吻合。
传统的蒽酮比色法采用沸水浴,显色时间从2~15 min不等[20-23]。本研究发现显色时间与糖含量之间呈负相关,随着显色时间的延长,可溶性糖含量逐渐下降。这可能是反应生成的糠醛衍生物不稳定,反应时间过长,糠醛衍生物被浓硫酸氧化破坏,颜色发生消退,造成吸光度减小[24-25]。因此,实验过程中要注意控制好沸水浴的时间。
常用的蒽酮比色法在测定可溶性糖含量时,很少考虑冷却时间对结果的影响,实验时在待测液温度下降之后就直接进行测定。若冷却时间不够,测定时反应还未终止,使测定结果不准确,稳定性也较差;冷却时间过长,将使络合反应过度,生成的蓝绿色化合物会发生进一步聚合,产生其他物质,造成结果偏小[26]。
本实验采用单因素试验设计考察了蒽酮试剂质量浓度、蒽酮试剂用量、显色反应时间、冷却时间对蒽酮法测定红枣可溶性糖含量的影响,并在此基础上,利用正交试验设计优化了反应条件,发展了蒽酮硫酸水合热法测定红枣可溶性糖含量的最佳条件:蒽酮质量浓度25 mg/mL、蒽酮试剂用量3 mL、室温显色反应1 min、冷却时间25 min。在此优化条件下得蔗糖标准曲线A=0.004 5C-0.013 4,相关系数为R2=0.999 2,灵敏度高。实验重现性好,RSD为0.20%(n=3),平均回收率达102.87%,RSD为0.84%(n=3)。最佳优化条件下测得的红枣可溶性糖含量为68.43%(以干质量计)。
[1] 李小平, 陈锦屏, 邓红, 等. 红枣多糖沉淀特性及抗氧化作用[J]. 食品科学, 2005, 26(10): 214-216.
[2] YOSHIDA T. Synthesis of polysaccharides having specific biological activities[J]. Progress in Polymer Science, 2001, 26(3): 379-441.
[3] CHO C H, MEI Q B, SHANG P, et al. Study of the gastrointestinal protective effects of polysaccharides from Angelica sinensis in rats[J]. Planta Medica, 2000, 66(4): 348-351.
[4] 周春丽, 钟贤武, 范鸿冰, 等. 果蔬及其制品中可溶性总糖和还原糖的测定方法评价[J]. 食品工业, 2012, 33(5): 89-92.
[5] 张红, 王腾, 李翠清. 响应面分析优化蒽酮-硫酸法测定桑叶中多糖的含量[J]. 食品工业科技, 2012, 33(24): 62-65.
[6] GABRIELA C, NORMA S, MARIA I B, et al. Quantitative determination of pneumococcal capsuar polysaccharide serotype 14 using a modification of phenol-sulfuric acid method[J]. Journal of Microbiological Methods, 2003, 52(1): 69-73.
[7] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 202-204.
[8] 杨柳, 王建立, 王淑英, 等. 糖类物质测定方法评价[J]. 北京农学院学报, 2009, 24(4): 68-71.
[9] 林炎坤. 常用的几种蒽酮比色定糖法的比较和改进[J]. 植物生理学通讯, 1989(4): 53-55.
[10] 张妙霞, 孔祥生, 郭秀璞, 等. 蒽酮法测定可溶性糖显色条件的研究[J].洛阳农专学报, 1997, 17(4): 24-28.
[11] 王黎明, 夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学, 2005, 26(7): 185-188.
[12] 翁霞, 辛广, 李云霞. 蒽酮比色法测定马铃薯淀粉总糖的条件研究[J].食品研究与开发, 2013, 34(17): 86-88.
[13] 李芳亮, 王锐, 孙磊, 等. 响应面法优化蒽酮-硫酸法测定水溶性沙棘叶多糖含量[J]. 光谱实验室, 2012, 29(1): 185-190.
[14] 李晓旭, 李家政. 优化蒽酮比色法测定甜玉米中可溶性糖的含量[J].保鲜与加工, 2013, 13(4): 24-27.
[15] 郭明, 吴翠云, 蒋卉. 响应面法优化骏枣可溶性糖提取工艺[J]. 中国酿造, 2012, 31(8): 51-54.
[16] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 195-197.
[17] 高俊凤. 植物生理学实验技术[M]. 西安: 世界图书出版社, 2000: 145-148.
[18] 李利军, 孔红星, 陆丹梅. 蒽酮-硫酸法快速测定蔗糖的研究及应用[J].食品工业科技, 2003, 24(10): 145-149.
[19] 王宏军, 邓旭明, 蒋红, 等. 蒽酮-硫酸比色法检测多糖条件的优化[J].中国饲料, 2011(4): 39-41.
[20] 李艳玲, 张显忠, 苗苗, 等. 蒽酮-硫酸法测定海藻糖含量显色条件的改进[J]. 食品工业科技, 2009, 30(2): 296-298.
[21] 李巧云, 居红芳, 翟春. 五味子粗多糖提取工艺的研究[J]. 食品科学, 2004, 25(5): 105-109.
[22] 黄生权, 敖宏, 郭爱玲. 真菌保健食品中多糖含量测定方法的比较[J].现代食品科技, 2010, 26(7): 767-771.
[23] 魏晓明, 符红, 万幼平. 硫酸蒽酮比色法测定鹿龟酒中多糖的含量[J].中成药, 2000, 22(5): 380-382.
[24] 李润丰, 常学东, 狄小丽. 蒽酮-硫酸法测定板栗多糖含量[J]. 河北科技师范学院学报, 2010, 24(2): 54-59.
[25] 梁丽君, 曾哲灵, 熊涛, 等. 蒽酮-硫酸法测定大蒜多糖含量[J]. 食品科学, 2008, 29(9): 499-502.
[26] 崔宏春. 绿茶水溶性多糖含量测定方法研究[D]. 北京: 中国农业科学院, 2009: 39-40.
Sample Preparation Optimization for Determination of Soluble Sugar in Red Jujube Fruits by Anthrone Method
WEI Jie1, WU Cui-yun1,2, JIANG Yuan1, WANG He-li1,*
(1. College of Plant Science, Tarim University, Alar 843300, China; 2. Xinjiang Production and Construction Corps Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Alar 843300, China)
This paper reports the optimization of sample preparation conditions including reaction temperature, anthrone concentration and amount, color development time and cooling time for the determination of soluble sugar in red jujube fruits using a combination of single factor and orthogonal array designs. The results showed that 1 min reaction at room temperature in the presence of 3 mL of 25 mg/mL anthrone reagent followed by 25 min of cooling was found to be optimal. The established analytical method was characteristics of simple operation, rapidity and high sensitivity. Verification experiments showed that the standard curve of sucrose standard solution in the range of 20–240 μg/mL had good linearity (A = 0.004 5C - 0.013 4, R2= 0.999 2), with a good reproducibility. The accuracy, expressed as RSD, was 0.20% (n = 3) and the average recovery was 102.87% (n = 3) with a RSD of 0.84%. Dried red jujubes contained 68.43% soluble sugar as determined by this method.
anthrone method; red jujube; soluble sugar; optimization
S665.1
A
1002-6630(2014)24-0136-05
10.7506/spkx1002-6630-201424026
2014-04-02
国家自然科学基金地区科学基金项目(31260459);新疆研究生科研创新项目(XJGRI2013153);兵团重大产学研合作科技专项(2010ZX02);塔里木大学创新群体研究项目(TDZXCX1001)
位杰(1987—),男,硕士研究生,研究方向为果树栽培生理生态。E-mail:627weijie@sina.com
*通信作者:王合理(1958—),男,教授,学士,研究方向为设施园艺、蔬菜栽培生理生态。E-mail:waheli@sina.com
