富硒灵芝对非酒精性脂肪性肝病大鼠酰基辅酶A氧化酶水平的影响*
2014-03-08武俊紫牛世伟贾亚敏沈平瑞胡跃高陶文艳李树德
武俊紫,牛世伟,2,贾亚敏,沈平瑞,胡跃高,陶文艳,李 燕△,李树德▲
(1.云南省第一人民医院干部保健科,昆明650036;2.昆明理工大学生命科学与技术学院,昆明650504;3太原理工大学现代科技学院,太原030021;4.沈阳康硒生物工程研究所,沈阳110015;5.中国农业大学农学与生物技术学院,北京100094;6.昆明医科大学基础医学院,昆明650504)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)主要是指无酒精或其他明确损肝因素的、一种以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,有研究显示,当前我国城市人口NAFLD的发生率约31%,贫困地区NAFLD的患病率也在12%左右,NAFLD已经成为威胁我国人民健康的一大疾病[1-2]。硒是人体必需的微量元素之一,其在机体内有明显的抗氧化能力,提高肝脏的谷胱甘肽含量,对肝脏具有一定的保护作用,灵芝对某些微量元素特别是硒具有高度的富集作用,并把无机硒转化为有机硒,利于人体摄入[3-4]。本实验以富硒灵芝干预NAFLD模型大鼠,测定其对大鼠硬脂酰辅酶A去饱和酶及酰基辅酶A氧化酶1(acyl-coenzyme a oxidase 1,ACOX1)的影响,探讨富硒灵芝对NAFLD的治疗作用,现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物来源及分组 雄性SD大鼠60只、基础饲料以及饲养用垫料均购自昆明医科大学动物实验中心,大鼠体质量为160~180g,在适应性喂养2周后分为空白对照组、模型对照组及富硒灵芝组3组,每组各20只。
1.1.2 高脂溶液配制与灌胃量 用97%猪油、2%胆固醇与1%胆酸钠配制100%高脂溶液,大鼠灌胃量按每100g大鼠体质量灌1mL高脂溶液,灌胃时间为每天8:00~10:00。另外,日常给予大鼠红糖水自由饮用,红糖浓度为10%。
1.1.3 药品与试剂 富硒灵芝(含硒量为3.162mg/kg)由沈阳康硒生物工程研究所提供;胆酸钠购自上海金穗生物公司;胆固醇购自北京鼎国生物技术公司;猪油与红糖市场自购;胆碱酯酶(CHE)、总胆红素(TBIL)及总胆汁酸(TBA)试剂盒购自南京建成生物工程研究所;总RNA提取试剂盒与逆转录试剂盒购自天根公司,多克隆抗体ACOX1和ECL发光试剂盒购自美国Santa Cruz公司,相应二抗购于中杉金桥公司。
1.2 方法
1.2.1 NAFLD模型的建立及给药方法 大鼠分组后,模型对照组与富硒灵芝组在喂食普通饲料的基础上给予高脂溶液灌胃12周以促使其建立NAFLD模型,空白对照组只喂食普通饲料,造模成功后,富硒灵芝组给予富硒灵芝水(每天2次,每只大鼠每次5mL,富硒灵芝水配方为:每1g富硒灵芝用10 mL水煮沸30min,过夜浸泡)灌胃治疗。
1.2.2 标本采集 分别于6、12周处死大鼠各半,测定其相应指标。处死时用3%水合氯醛2mL腹腔内注射,麻醉后无菌操作暴露腹腔,10mL注射器心脏迅速取血;血液5 000r/s离心,取上清液,-86℃保存;称300mg肝脏置于RNA保存液中,其余-86℃保存。
1.2.3 病理学检查方法 取肝左叶300mg,用4%的中性福尔马林溶液固定,乙醇脱水,石蜡包埋、切片,HE染色,光镜下观察肝脏病理学改变。
1.2.4 实时荧光定量PCR(RT-PCR)检测ACOX1的mRNA表达 (1)取肝脏组织,用总RNA提取试剂盒提取总RNA;(2)定量后每组各取2μg逆转录cDNA,用2μL cDNA为模板进行PCR扩增ACOX1目的片段;(3)PCR扩增反应条件如下:98℃预变性2min,98℃变性10s、48℃退火30s和72℃延伸35s,循环34次;(4)PCR反应产物在含核酸染料(1μL配比100mL琼脂糖溶液)的1.6%琼脂糖凝胶中电泳30min,电压110V,电泳完成后用凝胶成像仪拍照采集图像;(5)Image J软件计算各条带的荧光强度值,以β-actin作为内参进行标准对照。每组实验重复3次。ACOX1引物设计为,PrimerA:5′-GAG ATG GAT AAC GGC TAC CT-3′,PrimerB:5′-AAT TCC GTG AGC TCG GTG AC-3′,产物长度为190bp。β-actin引物设计为,PrimerA:5′-AAG CCT TGG ACA GAC TCT GA-3′,PrimerB:5′-ACG CAG CTC ATT GTA GAA GGT GTG G-3′,产物长度为123bp。
1.2.5 蛋白免疫印迹法(Western blot)检测 ACOX1的表达(1)取肝脏组织用组织细胞裂解液制作匀浆;(2)蛋白质定量试剂盒(BCA)法测定蛋白质含量;(3)取各样本80μg进行聚丙烯酰胺凝胶电泳(SDS-PAGE);(4)半干转法将蛋白转移至聚偏二氟乙烯(PVDF)膜;(5)5%的脱脂牛奶封闭2h;(6)3μL抗体相应多克隆一抗联合6 000μL TBST缓冲液配成抗体溶液封闭;(7)4℃过夜,洗膜后加入相应的辣根酶标记的二抗孵育,洗涤3次,每次15min;(8)洗涤后与ECL发光试剂反应,曝光洗片;(9)扫描图像后用Image J软件计算各条带的灰度值,以β-actin作为内参进行标准对照。每组实验重复3次。
1.3 统计学处理 采用SPSS19.0统计软件进行分析。计量资料以±s表示,采用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 肝脏HE染色比较 HE染色图片可以明显地看出,空白对照组6周及12周切片表面光滑,看不到任何脂滴及坏死特征;模型对照组6周表面有不同程度的脂肪变性及空泡样变,肝细胞极度肿胀呈圆形,肝细胞体积较空白对照组明显要大,模型对照组12周与6周比较有一定好转,但脂肪浸润面积仍然较大;富硒灵芝组6周脂肪变性程度及细胞肿胀明显减轻,坏死灶较HFD明显减少,但在汇管处仍有小部分面积脂肪颗粒堆积,富硒灵芝组12周大鼠肝脏基本恢复到正常水平,与空白对照组12周几乎没有差异,见图1。
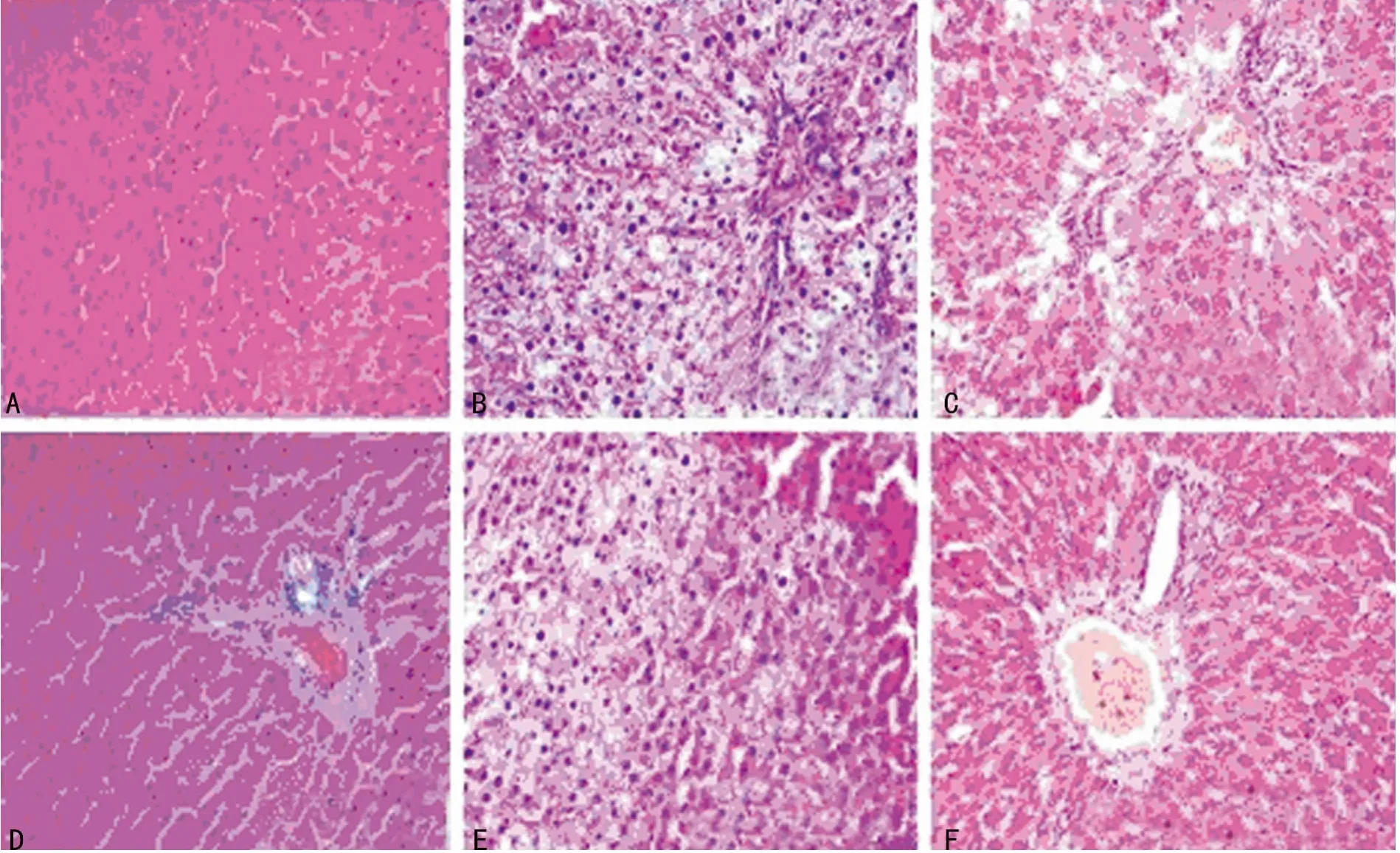
图1 肝脏HE染色变化
2.2 大鼠血清CHE、胆红素的变化分析 6周时,大鼠CHE富硒灵芝组比模型对照组显著降低(P<0.05),TBIL、直接胆红素及间接胆红素均得到了好转,几乎恢复到正常的水平(P<0.05),见表1。12周时,大鼠CHE模型对照组比6周时有一定降低,富硒灵芝组相较于6周时基本恢复到正常的水平,TBIL、直接胆红素及间接胆红素空白对照组相较于6周时呈现出下降的趋势,富硒灵芝组基本维持在空白对照组附近,见表2。
表1 各组大鼠6周时CHE、胆红素比较(±s)

表1 各组大鼠6周时CHE、胆红素比较(±s)
*:P<0.05,与模型对照组比较。
组别 CHE TBIL 直接胆红素 间接胆红素模型对照组225.00±47.00 1.65±0.51 1.23±0.48 0.48±0.12空白对照组 142.00±28.00 0.51±0.17 0.41±0.16 0.10±0.04富硒林芝组 155.00±21.00* 0.52±0.33* 0.42±0.27* 0.10±0.04*
表2 各组大鼠12周时CHE、胆红素比较(±s)

表2 各组大鼠12周时CHE、胆红素比较(±s)
*:P<0.05,与模型对照组比较。
组别 CHE TBIL 直接胆红素 间接胆红素模型对照组173.00±39.00 0.30±0.16 1.32±0.46 0.25±0.10空白对照组 142.00±28.00 0.37±0.28 0.35±0.19 0.02±0.01富硒林芝组 146.00±19.00* 0.38±0.27 0.34±0.21* 0.04±0.02*
2.3 大鼠血清总胆汁酸、总蛋白、清蛋白和球蛋白的变化分析6周时,大鼠总胆汁酸模型对照组和空白对照组基本一致,富硒林芝组与上述两组比较有一定的降低;总蛋白、清蛋白及球蛋白模型对照组与空白对照组差异微小,但经富硒灵芝治疗后,其值居于中间,见表3。12周时,模型对照组大鼠总胆汁酸要明显高于空白对照组,同时12周与6周比较,其值明显升高,而富硒灵芝组与上述两组比较,差异有统计学意义(P<0.01)。同时,富硒灵芝组与6周时比较基本没有变化,总蛋白、清蛋白及球蛋情况与6周时较为相似,见表4。
表3 各组大鼠6周总胆汁酸、总蛋白、清蛋白和球蛋白的比较(±s)

表3 各组大鼠6周总胆汁酸、总蛋白、清蛋白和球蛋白的比较(±s)
*:P<0.05,与模型对照组比较。
组别 总胆汁酸 总蛋白 清蛋白 球蛋白模型对照组 10.83±2.14 73.75±4.58 26.00±3.12 47.75±4.18空白对照组 6.65±0.93 64.50±5.72 22.50±1.89 42.00±2.14富硒林芝组 5.40±0.72*67.17±4.73 23.50±2.17 43.67±2.96
表4 各组大鼠12周时总胆汁酸、总蛋白、清蛋白和球蛋白的比较(±s)

表4 各组大鼠12周时总胆汁酸、总蛋白、清蛋白和球蛋白的比较(±s)
*:P<0.05,与模型对照组比较。
组别 总胆汁酸 总蛋白 清蛋白 球蛋白模型对照组 24.38±6.24 72.75±5.12 24.75±2.83 48.50±5.44空白对照组 11.50±2.13 62.67±4.92 21.67±4.17 41.00±2.87富硒林芝组 4.34±0.89*67.20±5.16 22.40±2.74 43.40±3.10

图2 各组大鼠肝脏ACOX1的Western blot表达

图3 各组大鼠肝脏组织ACOX1的Western blot表达
2.4 ACOX1的mRNA表达 RT-PCR发现,与模型对照组相比,6周时富硒灵芝组大鼠肝脏ACOX1的mRNA表达稍有改善,但差异无统计学意义(P>0.05)。但12周时ACOX1的mRNA表达几乎恢复到正常水平,其与模型对照组相比差异有统计学意义(P<0.05),见图2。Western blot检测发现,与模型对照组相比,6周时富硒灵芝组ACOX1蛋白表达有一定的改善,但改善不明显,见图2。12周时富硒灵芝组的蛋白表达明显升高,差异有统计学意义(P<0.05),见图3。
3 讨 论
NAFLD是指除酒精和其他明确的损肝因素外所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,其疾病谱包括单纯性脂肪肝(simple fatty liver,SFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)及其相关肝硬化等[1]。当前NAFLD已经成为威胁我国人民健康的一大疾病,NAFLD男性发病率稍高于女性,且患病率随年龄增加而升高,特别是中年人群发病率高达26%,另外多项研究提示,约15%~50%的肝纤维化和肝硬化与脂肪肝有关,脂肪肝纤维化患者中约30%于10年后可发展为肝硬化,甚至进一步发展有可能导致肝癌[5-6]。
血清CHE是近年来诊断脂肪肝的一个新型指标,多项研究均显示,NAFLD发病时,其体内CHE明显升高,其原因为脂肪肝发生时,体内脂肪酸合成和转换增加,导致血液中酰基辅酶A增加,继而产生酰基胆碱等,这与本文的研究相符合。本研究发现,模型对照组大鼠CHE平均水平要明显地高于空白对照组,治疗第6周时差异有统计学意义(P<0.05),表明富硒灵芝可以改善血清中CHE的代谢,从而减轻肝脏负担,达到保护肝脏的作用[7]。
TBIL是用来诊断脏或胆道是否发生异常的一个重要指标。血清胆红素升高,表明肝细胞处理和处理后胆红素从胆道的排泄发生障碍。总胆红素由直接胆红素和间接胆红素构成。间接胆红素经过肝脏代谢又可变为直接胆红素,随胆汁排入胆道,最后经大便排出。肝细胞受损后,直接胆红素就不能排入肠道,使直接胆红素偏高[8]。但最新的研究发现,NAFLD患者血清总胆红素呈下降趋势[9]。而本研究发现,模型对照组大鼠TBIL、间接胆红素及直接胆红素比空白对照组明显升高,经过富硒灵芝治疗后,在6周时发生了明显的改变(P<0.05),提示富硒灵芝可以改善肝脏功能,使其胆红素代谢恢复正常,但在12周时血清TBIL却呈明显的下降趋势,明显的低于空白对照组和富硒灵芝治疗组,分析原因可能是灌胃时加入胆酸钠造成血清胆红素明显增高,在6周时大鼠机体并不能完全代谢,到12周时即恢复到正常水平,符合最新研究报道。
一般而言,血液中血清胆汁酸含量极微,当肝细胞受损时胆汁酸代谢就会出现异常,血清总胆汁酸就会升高[10]。本研究发现:6周时,模型对照组大鼠总胆汁酸比空白对照组要高、经过富硒灵芝治疗后,发生了明显的改变,同时也略低于空白对照组(P<0.05);12周时,富硒灵芝组、模型对照组及空白对照组胆汁酸比6周时明显升高,这可能与大鼠逐渐成熟有关,但12周时富硒灵芝组胆汁酸水平明显低于空白对照组和模型对照组(P<0.01),提示富硒灵芝可能对NAFLD模型大鼠胆汁酸的降低起着积极的作用。总蛋白是由清蛋白和球蛋白组成,慢性肝病及一些慢性感染类疾病会造成总蛋白略微偏高。本研究结果证明,NAFLD发生时,其总蛋白、清蛋白及球蛋白均有略微升高,经富硒灵芝治疗后,均得到改善。
1978年Osumi等[11]发现,ACOX1是脂肪细胞内与脂肪酸氧化相关的酶,同时也是过氧化酶体内β-氧化系统的起始酶。还有研究显示,ACOX1基因缺乏小鼠可发生严重的NASH,表明长链和极长链乙酰辅酶A可导致此病变的发生[12]。本实验结果表明,模型对照组6周和12周的ACOX1 mRNA表达明显降低,富硒灵芝治疗后ACOX1mRNA表达6周时变化微小,12周时发生了显著的变化,几乎达到了空白对照组的水平,而ACOX1蛋白的表达与mRNA的表达一致,因此推测富硒灵芝可激活ACOX1的基因转录,同时增加其蛋白表达,以促进肝脏脂肪代谢,保护肝细胞,这可能是其治疗NAFLD的分子机制。
综上所述,本研究发现富硒灵芝可明显改善NAFLD大鼠ACOX1的表达,通过其ACOX1的表达来调节NAFLD大鼠血清CHE、胆红素、胆汁酸及总蛋白的变化,从而达到治疗NAFLD的目的。
[1] Smith BW,Adams LA.Non-alcoholic fatty liver disease[J].Crit Rev Clin Lab Sci,2011,48(3):97-113.
[2] 沈峰,汪余勤,范建高.2012上海国际消化系统疾病会议纪要[J/CD].中国医学前沿杂志:电子版,2012,4(7):1-4.
[3] 陈璐,罗霞,曾谨,等.不同灵芝类群药效的特异性研究[J].中国食用菌,2007,26(6):40-43.
[4] 程红艳,孙绪春,孟俊龙,等.灵芝富硒栽培研究[J].安徽农业科学,2012,40(5):2626-2627.
[5] Jokal D,Wahll K,Moeller S,et al.Prospective biopsycontrolled evaluation of cell death biomarkers for prediction of liver fibrosis and nonalcoholic steatohepatitis[J].Hepatology,2012,55(2):455-464.
[6] Arora A,Sharma P.Non-invasive diagnosis of fibrosis in non-alcoholic fatty liver disease[J].J Clin Exper Hepatol,2012,2(2):145-155.
[7] Ghareeb DA,Hafez HS,Hussien HM,et al.Non-alcoholic fatty liver induces insulin resistance and metabolic disorders with development of brain damage and dysfunction[J].Metab Brain Dis,2011,26(4):253-267.
[8] Kwak MS,Kim D,Chung GE,et al.Serum bilirubin levels are inversely associated with nonalcoholic fatty liver disease[J].Clin Mol Hepatol,2012,18(4):383-390.
[9] Jang BK.Elevated serum bilirubin levels are inversely associated with nonalcoholic fatty liver disease[J].Clin Mol Hepatol,2012,18(4):357-359.
[10] Gabbi C,Bertolotti M,Anzivino C,et al.Effects of bile duct ligation and cholic acid treatment on fatty liver in two rat models of non-alcoholic fatty liver disease[J].Dig Liver Dis,2012,44(12):1018-1026.
[11] Osumi T,Hashimoto T.Acyl-CoA oxidase of rat liver:a new enzyme for fatty acid oxidation[J].Biochem Biophys Res Commun,1978,83(2):479-485.
[12] Fan CY,Pan J,Chu R,et al.Hepatocellular and hepatic peroxisomal alterations in mice with a disrupted peroxisomal fatty acyl-coenzyme A oxidase gene[J].J Biol Chem,1996,271(40):698-710.
