大鼠肢体缺血再灌注急性肺损伤细胞自噬及其相关蛋白的表达
2014-03-08李跃兵康于庆赵振龙林春水秦再生古妙宁
李跃兵,康于庆,叶 靖,赵振龙,林春水,秦再生,古妙宁△
(1.南方医科大学附属南方医院麻醉科,广州510515;2.浙江中医药大学附属第二医院麻醉科,杭州310005)
肢体缺血再灌注(limb ischemia-reperfusion,LIR)在临床外科中较常见,如动脉损伤或栓塞后再通、断肢再植、肢体创伤及止血带的长时间应用等;特别是在地震灾难中,肢体缺血损伤的致死、致残率非常高,值得关注。挽救缺血肢体的关键是尽快恢复血液循环,但大量研究证明,LIR不仅影响局部缺血组织的存活和功能,还可造成全身炎症反应综合征(SIRS),并可能导致多脏器功能衰竭(MODS),其中肺是最易受损的器官之一,易造成急性肺损伤(acute lung injury,ALI)[1]。近年来人们对LIR所致ALI的机制研究多集中在损伤与氧化应激方面,凋亡、坏死被认为是缺血再灌注(ischemia-reperfusion,I/R)组织细胞的病理结局[2-5]。但随着研究的深入,自噬被认为能够被各种损伤及氧化应激等诱发[6-8]。本研究旨在观察大鼠LIR-ALI肺组织细胞早期自噬及其相关蛋白的表达。
1 材料与方法
1.1 材料 选取健康雄性SPF级SD大鼠12只,体质量220~250g,由南方医科大学实验动物中心提供[许可证号:SCXK(粤)2011-0015]。所有动物饲养和实验操作程序符合南方医科大学实验动物福利伦理委员会相关规定,并经南方医科大学动物伦理委员会批准。
1.2 试剂和仪器 Trizol(Invitrogen公司)、第1链cDNA的合成试剂盒(TaKaRa公司)、SYBR实时荧光定量PCR(RTPCR)试剂盒(TaKaRa公司)、RT-PCR逆转录试剂盒(Invitrogen公司产品)、GDS7600(DF-23B)凝胶扫描系统(英国UVP公司)、Stratagene Mx3000PReal time PCR仪(美国Agilent公司)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)垂直电泳槽(美国Bio-Rad公司)。
1.3 方法
1.3.1 模型制备 采用大鼠双下肢缺血3h再灌注4h制备LIR-ALI模型。实验前大鼠在实验室适应性饲养1d,术前禁食12h,自由饮水,实验前2h禁水。随机数字表法分为假手术(Sham)组及I/R组,每组6只。称质量后大鼠3%戊巴比妥钠(首剂40mg/kg,维持剂量20mg/kg)腹腔注射麻醉后固定于动物手术台上。Sham组仅双侧股三角处切开皮肤,分离出股动脉,丝线标记不结扎,缝合创口。I/R组分离出股动脉后,于近腹股沟韧带处用无创微动脉夹夹闭股动脉使双下肢缺血,缝合创口再以适度松紧的橡皮带环绕结扎双下肢根部以防侧支循环,以扪不到足背动脉搏动、双足变暗变凉为缺血成功的标志;3h后打开原切口,去除动脉夹恢复双下肢血流再灌注4 h,动脉搏动恢复及双足逐渐变红变暖为建立LIR模型成功。
1.3.2 观察指标 (1)再灌注4h末即刻剖开胸腔,直视下经心尖部穿刺抽取3~4mL全血,4℃、3 000r/min离心10min后取上清液,置于-70℃冻存待测乳酸脱氢酶(lactate dehydrogenase,LDH),并放血处死大鼠。(2)取双肺组织,4℃的冰0.9%NaCl溶液浸泡,肺变白后取下左肺放置于4%的多聚甲醛固定24h以上,石蜡包埋后切片行免疫荧光染色测量,采用盲法由专科医师在倒置荧光显微镜下阅片,观察肺组织免疫荧光特异性标记抗体的表达,并利用Image J2x软件进行免疫荧光强度分析。(3)利用RT-PCR法检测各组肺组织Beclin1和自噬相关基因(autophagy related genes,ATG)5mRNA表达:取右侧肺组织100mg,采用Trizol试剂盒抽提总RNA,逆转录反应合成cDNA,然后采用PCR仪进行扩增。引物序列如下 GAPDH 正向引物:5′-CCT CGT CTC ATA GAC AAG ATG GT-3′,反向引物:5′-GGG TAG AGT CAT ACT GGA ACA TG-3′;Beclin1正向引物:5′-GGG GCC TAA AGA ATG GAG GG-3′,反向引物:5′-CGT GTC CAG TTT CAG AGG CT-3′;ATG5正向引物:5′-ACT GAA CGA GAA GCA GAG CC-3′,反向引物:5′-TGT TCC AAG GCA GAG CTG AG-3′,引物是由Invitrogen公司合成。PCR反应条件:95℃30s,95℃5s,60℃30s,40个循环,用 Agilent Stratagene RT-PCR仪Mx3000P进行RT-PCR实验,测定Beclin1和ATG5mRNA的表达定量。(4)蛋白免疫印迹法(Western blot)检测LC3蛋白表达:取下剩余右侧肺组织100mg,-80℃保存,Western blot测量肺组织LC3蛋白含量,并计算LC3-Ⅱ/GAPDH的蛋白含量比值。目的蛋白采用SDS-PAGE,转膜结束后,取出PVDF膜和凝胶,将凝胶用靠马斯亮蓝染色观察转移效率;将PVDF膜分别放入装有3mL抗LC3-Ⅰ、LC3-Ⅱ抗体中,洗膜后再放入含有3mL辣根过氧化物酶标记的山羊抗小鼠IgG,1%BSA-TBS 1∶5 000稀释;最后进行化学发光、显影及定影,将胶片进行扫描或拍照,用凝胶图像处理系统分析条带净光密度值。
1.4 统计学处理 采用SPSS16.0统计软件进行分析,计量资料以±s表示,组间比较采用独立样本t检验,并做方差齐性检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠血清LDH测定 血清LDH Sham组为(2.35±0.01)U/L,I/R组为(6.66±0.03)U/L,两组比较差异有统计学意义(t=119.242,P=0.000);I/R组血清LDH 的活性显著升高,提示大鼠LIR-ALI模型制备成功。
2.2 肺组织免疫荧光病理变化及特异性标记抗体表达 免疫荧光染色镜下Sham组可见正常肺组织且结构清晰,而I/R组肺组织结构紊乱且肺泡壁增厚;免疫荧光强度值Sham组为5.54±0.09,I/R组为9.58±0.21,两组比较差异有统计学意义(t=17.979,P=0.000);I/R组的肺组织免疫荧光特异性标记抗体高表达,见图1。
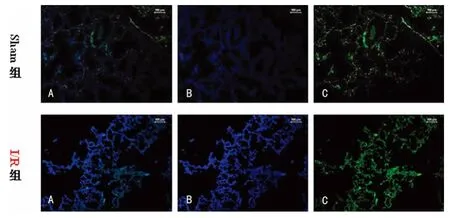
图1 两组大鼠的肺组织免疫荧光图(×10)
2.3 肺组织Beclin1和ATG5mRNA相对定量表达 I/R组与Sham组Beclin1和 ATG5mRNA 2-△△CT比值分别为12.72±0.13、18.34±0.08,两组比较差异均有统计学意义(P<0.01),见表1。
表1 两组大鼠的肺组织Beclin1和ATG5mRNA相对定量表达结果(±s)

表1 两组大鼠的肺组织Beclin1和ATG5mRNA相对定量表达结果(±s)
?
续表1 两组大鼠的肺组织Beclin1和ATG5mRNA相对定量表达结果(±s)

续表1 两组大鼠的肺组织Beclin1和ATG5mRNA相对定量表达结果(±s)
2-△△CT:I/R组目的基因表达相对于Sham组的变化倍数;**:P<0.01,与Sham组比较。
组别 ATG5CT GAPDH CT △CT(Avg.ATG5CT-Avg.GAPDH CT) △△CT(Avg.△CT-Avg.△CT mean) 2-△△CT Sham组 28.68±0.06 18.96±0.07 9.72±0.09 0.00±0.09 1.00±0.09 I/R组 24.61±0.05 19.08±0.06 5.53±0.08 -4.20±0.08 18.34±0.08**
2.4 Western blot法检测LC3蛋白含量及LC3-Ⅱ/GAPDH比值 LC3-Ⅰ蛋白含量净光密度值Sham组1 699.646±20.761,I/R组6 707.375±42.641,两组比较差异有统计学意义(t=105.590,P<0.01);LC3-Ⅱ蛋白含量净光密度值Sham组5 783.733±53.297,I/R组12 961.459±204.518,两组比较差异有统计学意义(t=33.962,P<0.01);GAPDH 蛋白含量净 光 密 度 值 Sham 组 7 631.270±45.566,I/R 组7 531.818±8.651,两组比较差异无统计学意义(t=2.144,P>0.05);LC3-Ⅱ/GAPDH比值,Sham组0.758±0.007,I/R组1.721±0.027,两组比较差异有统计学意义(t=34.130,P<0.01),见图2、3。

图2 两组大鼠的肺组织LC3蛋白Western blot结果

图3 两组大鼠的肺组织LC3蛋白水平
3 讨 论
自噬与凋亡的关系是生命科学研究的一个热点,虽然自噬在除肺组织以外的脏器系统中研究取得了较大进步,但有关LIR-ALI与自噬方面的相关研究甚少[9]。自噬为真核细胞所特有,是细胞内的物质成分利用溶酶体被降解过程的统称。细胞对内外环境压力变化如发育、衰老、损伤、缺血缺氧等可诱发自噬,在某些情况下还可导致细胞死亡。自噬被认为是区别于细胞凋亡的另一种细胞程序性死亡形式,前者属Ⅰ型,后者为Ⅱ型[10]。
有研究认为,常温下肌肉骨骼肌是肢体最易缺血的组织,仅可耐受缺血4h[11]。肢体I/R可引起氧化应激导致肺血管细胞损伤,而自噬可能是该类损伤的一种可诱导的适应性反应。自噬的发生需要众多关键ATG的参与,其中ATG12和ATG5结合形成自噬体前体,他们的高表达促进自噬的激活[12]。本研究中,大鼠双下肢缺血3h再灌注4h引起了肺组织免疫荧光染色特异性标记抗体的高表达,而用半定量RTPCR法测定Beclin1和ATG5mRNA相对表达量亦增高,促进了自噬的激活。
目前测量自噬的作用途径大致分为3类:显微镜检查、静态生化测量(如 Western blot)、动态生化测量。其中,免疫荧光染色法能更好地检测各个时期的自噬小体,而自噬最多的检测方法是利用 Western blot检测LC3[13]。
LC3-Ⅰ/Ⅱ和Beclin1是两个重要的自噬相关分子,被广泛地用来研究自噬的发生、发展。LC3是自噬体的标志性蛋白,当自噬被诱导,细胞质中的LC3前体通过蛋白水解转化成LC3-Ⅰ,再进一步转化成磷脂酰乙醇胺结合的LC3-Ⅱ,LC3-Ⅱ被认为是自噬性细胞死亡的特异性分子标志物[13]。特别是LC3-Ⅱ含量的多少与自噬泡数量的多少呈正比,因此可以根据LC3的水平来推测自噬作用的大小。在肺血管细胞中,炎性标志物高表达引发自噬,LC3-Ⅰ转化增加并聚集,自噬量进一步增加,从而引起肺支气管上皮细胞死亡及组织损伤[14]。本研究中大鼠 LIR-ALI模型 LC3-Ⅰ、LC3-Ⅱ、LC3-Ⅱ/GAPDH均增高,说明LIR-ALI导致肺组织自噬上调。
综上所述,LIR-ALI可诱导自噬发生并促其相关蛋白高表达,本研究为进一步明确LIR-ALI与自噬的发病机制奠定了基础。笔者将利用该抑制剂和激活剂进一步研究LIR-ALI的作用机制及临床药物/技术对其干预效果。
[1] 孙晓峰,王俊科,杨军,等.辛伐他汀对肢体缺血再灌注肺损伤大鼠肺组织中NF-κB及ICAM-1表达的影响[J].南方医科大学学报,2011,31(7):1150-1153.
[2] Dorweiler B,Pruefer D,Andrasi T,et al.Ischemia-reperfusion injury[J].Eur J Trauma Emerg Surg,2007,33:600-612.
[3] Murphy E,Steenbergen C.Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury [J].Physiol Rev,2008,88(2):581-609.
[4] Men X,Han S,Gao J,et al.Taurine protects against lung damage following limb ischemia repefusion in the rat by attenuating endo-plasmic reticulum stress-induced apoptosis[J].Acta Orthop,2010,81(2):265-269.
[5] Iwata A,Morgan-Stevenson V,Schwartz B,et al.Extracellular BCL2proteins are danger-associated molecular patterns that reduce tissue damage in murine models of ischemia-reperfusion injury [J].PLoS One,2010,5(2):e9103.
[6] Scherz-Shouval R,Elazar Z.Regulation of autophagy by ROS:physiology and pathology[J].Trends Biochem Sci,2011,36(1):30-38.
[7] Qin AP,Liu CF,Qin YY,et al.Autophagy was activated in injured astrocytes and mildly decreased cell survival following glucose and oxygen deprivation and focal cerebral ischemia[J].Autophagy,2010,6(6):738-753.
[8] Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[9] Nakahira K,Choi AM.Autophagy:apotential therapeutic target in lung diseases[J].Am J Physiol Lung Cell Mol Physiol,2013,305(2):L93-107.
[10] 王云,沈健,许永华,等.血红素加氧酶1诱导自噬减轻小鼠肝脏缺血再灌注损伤[J].中华消化外科杂志,2013,12(7):538-543.
[11] Pak O,Aldashev A,Welsh D,et al.The effects of hypoxia on the cells of the pulmonary vasculature[J].Eur Respir J,2007,30(2):364-372.
[12] Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2008,8(4):151-175.
[13] Chen ZH,Kim HP,Sciurba FC,et al.Egr-1regulates autophagy in cigarette smoke-induced chronic obstructive pulmonary disease[J].PLoS One,2008,3(10):e3316.
[14] Kim HP,Wang X,Chen ZH,et al.Autophagic proteins regulate cigarette smoke-induced apoptosis:Protective role of heme oxygenase-1[J].Autophagy,2008,4(7):887-895.
