人宫颈癌组织和Hela细胞株中SP细胞水平和生物学特性的比较研究*
2014-03-08金从国吴星娆高碧燕
董 超,金从国,吴星娆,杨 毅,高碧燕
(昆明医科大学第三附属医院/云南省肿瘤医院:1.肿瘤内二科;2.肿瘤研究所;3.放射治疗研究中心;4.妇瘤科,昆明650118)
宫颈癌是女性最常见的恶性肿瘤之一,其发病率和病死率均居女性恶性肿瘤第2位,容易复发与转移,单纯的手术切除或手术加放化疗并不能从根本上解决宫颈癌复发和转移。肿瘤干细胞(cancer stem cells,CSC)是一类存量较少,同时具有肿瘤细胞和干细胞特征的干细胞样癌细胞亚群,在肿瘤生长、复发和转移中均起关键作用。研究表明,多种恶性肿瘤的侧群(side population,SP)细胞富集于CSC,可以作为干细胞研究的重要资源[1]。本研究采用Altra流式细胞仪分选出人宫颈癌组织和Hela细胞株中SP细胞,比较两组SP细胞的生物学标记和细胞周期增殖凋亡的状况,探讨以侧群细胞作为宫颈癌干细胞研究切入点的可行性和科学依据,现报道如下。
1 材料与方法
1.1 材料 (1)标本来源:选取2010年6月至2012年6月在本院妇瘤科经宫颈活检确诊的宫颈癌标本60例(均经患者或委托人知情同意),病理类型均为鳞癌,其中年龄33~73岁,平均50.4岁。宫颈癌分期和病理分级采用国际妇产科联盟的标准(FIGO,2009年),其中ⅠB2期7例,ⅡA期8例,ⅡB期29例,ⅢB期16例,临床及病理资料完整。Hela细胞株来自上海细胞库。(2)实验试剂:DMEM/F 121∶1培养基购自Hyclone公司,胎牛血清(FBS)购自Gibco公司,0.25%胰蛋白酶-EDTA消化液、青链霉素混合液购自Solarbio公司,碘化丙咤(PI)、维拉帕米(verapamil hydrochloride)、Hoechst 33342、二甲基亚砜 (DMSO)、四甲基噻唑蓝(MTT)和胶原酶Ⅰ购自Sigma-Aldrich公司,磷酸盐缓冲液 (PBS)购自贝博生物公司。ABCG2-PE、CD133-PE、CD43-PE、P63-PE、Ki67-PE、MDR-PE抗体均购自Beckman Coulter公司。
1.2 方法
1.2.1 人宫颈癌细胞原代培养及细胞传代 在新鲜肿瘤组织边缘无坏死、钙化及电凝部位无菌取材,将组织置入含青霉素(100 000U/L),链霉素(100 000mg/L)的无血清 RPMI-1640培养基内,并于1h内处理,组织块置于培养皿中,加入RPMI-1640液,再用RPMI-1640液漂洗2次后剪成约1mm×1mm×1mm,加入0.25%胰蛋白酶消化液置于37℃消化20~30min,细胞悬液纱布过滤后1 000r/min,5min离心,弃上清液,稀释成105个/mL浓度,用含10%FBS的RPMI1640培养液稀释,置于37℃,5%CO2饱和湿度的恒温箱中培养,每2~3天换液并传代1次,以0.02%乙二胺四乙酸二钠(EDTA-2Na)和0.25%胰蛋白酶的1∶1混合液消化,经6次传代选用对数生长期细胞为实验对象。
1.2.2 宫颈癌Hela细胞株的培养和传代 含10%FBS,100 U/mL青霉素,100U/mL链霉素的 RPMI-1640培养液为完全培养基,在37℃,5%CO2饱和湿度条件下培养。显微镜下观察到细胞贴壁生长,用无菌0.9%生理盐水清洗2次,加入含血清的RPMI-1640培养液培养。显微镜下观察到细胞贴壁长满,倒除培养液,用无菌0.9%生理盐水清洗2次,以0.02%EDTA-2Na和0.25%胰蛋白酶的1∶1混合液2mL消化。显微镜下观察到贴壁细胞已完全消化下,加入含10%血清的RPMI-1640培养液2mL终止消化,轻轻吹打成单细胞悬液,移一半细胞悬液至新培养瓶中,在37℃、5%CO2饱和湿度条件下培养。
1.2.3 细胞染色 选用对数生长期细胞,PBS洗1次,加入EDTA-2Na和胰蛋白酶混合消化液2mL,镜下观察细胞变圆,加入含血清培养基中止消化,脱壁形成细胞悬液,移入无菌离心管,以1 000r/min离心10min,弃上清液,用含10%FBS的RPMI-1640培养液稀释成以106个/mL浓度的细胞悬液。细胞分为2组,各1mL,一组加入5μL Hoechst33342;二组加入5μL Hoechst33342及200μL维拉帕米。将2组细胞置于37℃恒温水浴振荡120min,每15分钟手动振荡1次。2h后取出,加入冰PBS终止反应,以1 000r/min离心10min,弃上清液。再加入冰PBS液,尖吸管吹打,混匀。2组分别加入PI至终浓度2μg/mL,立即用流式细胞仪分析。
1.2.4 Altra流式细胞仪分析SP亚群 待分选细胞用5~10 μg/mL的Hoechest33342标记,置于37℃中摇床振荡90~120min,用流式细胞仪进行分析和分组,Hoechst33342的激发光为407nm紫光,450/40带通收集蓝光,695/40带通收集红光。PI的激发光为488nm蓝光,用575/26带通收集红光。收集分选出的SP细胞悬液,离心半径6cm、1 500r/min离心10min,弃上清液,各加至1mL,制成单细胞悬液,各设实验管和对照管,每管细胞数1×106个,实验管中加入ABCG2-PE、CD133-PE、CD43-PE、P63-PE、、Ki67-PE、MDR-PE各20μL,对照管中不加,混匀,室温下避光静置2h,用流式细胞仪检测各个管中抗体阳性表达率。
1.2.5 流式细胞仪TUNEL法检测SP细胞的细胞周期时相分布和细胞凋亡 分别收集宫颈癌组织原代培养6代细胞和Hela细胞株中8×106个SP细胞,加入500μL预冷70%的乙醇重悬,冰上固定30min后离心细胞。同一样品分为2管,分别加入TDT反应液及阴性对照液各30μL,放置在37℃下,孵育1h;加入1mL含0.2%BSA的PBS洗涤,700r/min室温离心3min;去上清液,加入10mg/mL RANse 20μL、0.1%Triton 200μL,放置在37℃下,孵育15min;加入100μg/mL的PI染液1mL,避光放置15~30min。流式细胞仪进行细胞周期分析和凋亡检测。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s表示,成组资料采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 宫颈癌组织和Hela细胞株中SP含量的测定 采用Altra流式细胞仪分选出宫颈癌组织原代培养6代细胞和Hela细胞株中SP细胞的水平分别为(1.62±0.48)%和(2.70±0.59)%,差异有统计学意义(P<0.05),见图1、2,表1。

图1 宫颈癌组织SP细胞水平
表1 宫颈癌组织和Hela细胞株中SP细胞含量及其生物学特性比较(±s,%)

表1 宫颈癌组织和Hela细胞株中SP细胞含量及其生物学特性比较(±s,%)
项目 宫颈癌组织(n=60)Hela细胞株(n=30)t P SP细胞含量1.62±0.48 2.70±0.59 9.316 0.000 ABCG2 78.59±5.42 80.17±3.60 1.443 0.152 CD133 51.55±6.29 52.87±4.96 1.005 0.318 CD43 69.73±5.70 70.68±5.44 0.756 0.452
续表1 宫颈癌组织和Hela细胞株中SP细胞含量及其生物学特性比较(±s,%)

续表1 宫颈癌组织和Hela细胞株中SP细胞含量及其生物学特性比较(±s,%)
项目 宫颈癌组织(n=60)Hela细胞株(n=30)t P P63 47.56±6.92 48.06±5.28 0.348 0.729 Ki-67 14.69±1.69 15.33±1.38 1.810 0.074 MDR 58.36±11.12 58.24±5.32 0.057 0.955

图2 Hela细胞株SP细胞水平
2.2 宫颈癌组织和Hela细胞株中SP细胞的生物学特性比较 SP细胞的各项生物学标记(ABCG2、CD133、CD43、P63、Ki-67、MDR)在宫颈癌组织和Hela细胞株中的表达无统计学差异(P>0.05),见表1。
2.3 宫颈癌组织和Hela细胞株中SP细胞的细胞周期和细胞凋亡比较 SP细胞在宫颈癌组织和Hela细胞株中各细胞周期时相分布(G0/G1、S、G2/M 期)和细胞凋亡坏死的表达差异无统计学意义(P>0.05),见表2,图3~6。
表2 宫颈癌组织和Hela细胞株中SP的细胞周期和细胞凋亡比较(±s,%)

表2 宫颈癌组织和Hela细胞株中SP的细胞周期和细胞凋亡比较(±s,%)
生物学特性 宫颈癌组织(n=60)Hela细胞株(n=30)t P 94.70±1.76 95.10±1.59 1.046 0.299 S 3.25±0.99 2.92±0.84 1.540 0.127 G2/M 2.05±1.10 1.98±0.95 0.312 0.756凋亡 4.06±0.64 3.92±0.59 0.967 0.336坏死G0/G1 1.00±0.38 1.12±0.31 1.504 0.136

图3 宫颈癌组织SP细胞周期
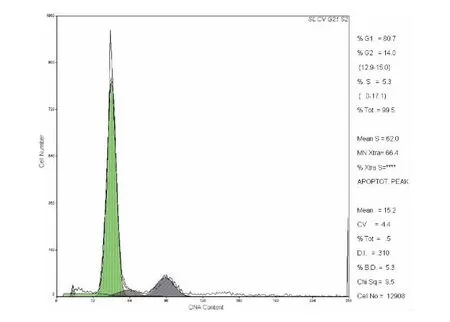
图4 Hela细胞株中SP的细胞周期

图5 宫颈癌组织SP细胞凋亡坏死
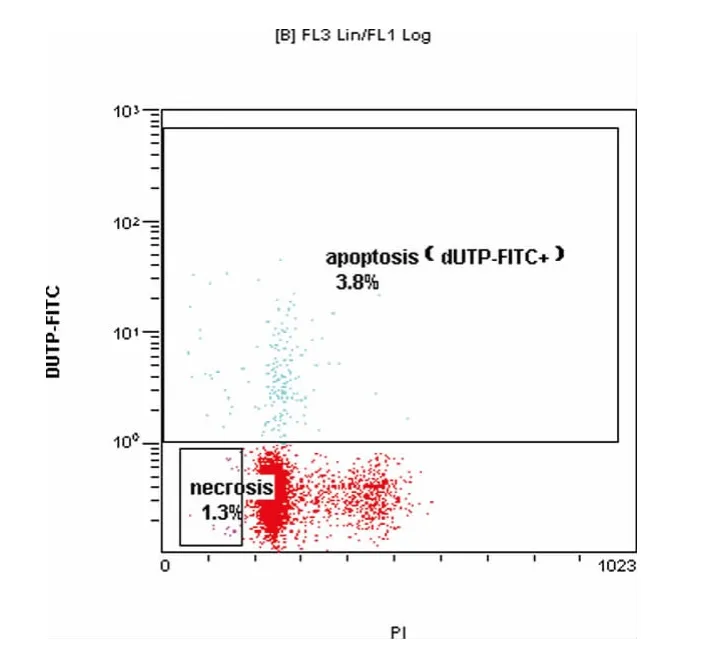
图6 Hela细胞株中SP的细胞凋亡坏死
3 讨 论
目前,对CSC的研究仍处于探索阶段,对大多数肿瘤而言,迄今仍未建立较特异的分选鉴定方法,从形态学上很难区分CSC与肿瘤细胞间的差异,只能用功能学方法即从自我更新能力和分化潜力来鉴定CSC。分离CSC主要有:SP细胞分选、无血清培养富集干细胞和通过CSC表面特异性标志筛选3种方法[2]。SP法是利用SP细胞外排染料Hoechst33342的特征,采用流式细胞技术将染色阴性和弱阳性的细胞分选出来,分离正常干细胞和CSC。目前,尚未发现CSC特异性标志与正常组织干细胞之间有何区分,公认的是根据共有的生物学特性进行鉴定,如自我更新能力、表达干细胞标志、耐药基因表达和免疫缺陷鼠体内成瘤等[3]。CSC理论认为并非所有肿瘤均具有无限增殖和自我更新的能力,肿瘤细胞中存在一些数量很少但具有类似于干细胞功能的细胞,他们具备上述CSC特性,无论经过手术还是放疗和化疗等各种治疗的癌症患者,理论上只要还存在CSC就可能出现肿瘤的复发和转移[4]。
本实验采用Altra流式细胞仪成功分选出60例不同分期的宫颈癌组织和Hela细胞株中的SP细胞。宫颈癌组织进行原代培养6代细胞分选出SP细胞的水平为(1.62±0.48)%,较国内学者的结果略低[5];Hela细胞株中的SP细胞水平为(2.70±0.59)%,较其他学者的结果略高[6];与同实验中 SP细胞比较,人宫颈癌组织SP水平明显低于Hela细胞株,差异有统计学意义(P<0.05)。多项研究表明,实体瘤中SP细胞具有CSC特性,即表达干细胞相关表面标志,具有自我更新、致瘤能力强和高表达转运蛋白ABCG2等,ABCG2是ATP结合盒药物转运子家族成员之一的基因,是通过水解ATP供能将化疗药物泵出胞外,导致细胞耐药,这也是肿瘤耐药、复发的重要原因之一[7-8]。在宫颈癌组织和Hela细胞株SP细胞ABCG2呈高水平表达(78.59±5.42)% 和(80.17±3.60)%,提示ABCG2可能是参与维持肿瘤多药耐药性的一个重要生物标志[9-10]。Ki-67抗原为人增殖期细胞特异性核蛋白,在不同病理分级的侵袭性鳞癌中均有表达,而且表达水平与肿瘤细胞增生密切相关,与宫颈癌分期成正相关[11]。宫颈癌组织和Hela细胞株中SP细胞的Ki-67的表达率分别为(14.69±1.69)%和(15.33±1.38)%,明显低于其他生物学标记物的表达,提示两种组织来源的SP细胞具有CSC的相对静止、低增殖和低凋亡的特征。研究显示,P63基因对于正常上皮的发育和维持其功能起关键作用,在调节干细胞的一致性上有重要的作用,并在皮肤、肺、宫颈和其他部位的鳞状上皮的分化过程中担当操纵子,P63优先表达于宫颈储备细胞的胞核中,随肿瘤恶性度而升高,可能是宫颈癌干细胞的标记物[12]。本实验中宫颈癌和Hela细胞株中SP细胞中P63的表达率分别为(47.56±6.92)%和(48.06±5.28)%,差异无统计学意义(P>0.05)。SP细胞在宫颈癌组织和Hela细胞株处于G0/G1期比例最多,高达(94.70±1.76)%和(95.10±1.59)%,提示SP细胞主要处于静止期,而凋亡和坏死比例较低。在宫颈癌组织和 Hela细胞株的凋亡表达率为(4.06±0.64)%和(3.92±0.59)%;坏死表达率为(1.00±0.38)%和(1.12±0.31)%。进一步证实SP细胞具有CSC的相对静止、低增殖和低凋亡的特征。SP细胞具有CSC的特性,可用于鉴定CSC[13-14]。本研究立足于CSC学说,应用流式细胞技术对宫颈癌组织和Hela细胞株进行SP细胞的分离、生物学标记、细胞周期、细胞凋亡和坏死的检测,确定了宫颈癌组织和Hela细胞株的SP细胞均具有CSC特性。
综上所述,本研究认为人宫颈癌组织和Hela细胞株中的SP亚群细胞富集于宫颈癌干细胞,通过流式细胞仪分选SP细胞亚群是分离宫颈癌干细胞的一种有效方法,无论人宫颈癌组织还是Hela细胞株中的SP细胞均可作为宫颈癌干细胞筛选和研究的切入点,这也为进一步研究宫颈癌干细胞的特异性标记奠定了实验基础[5,15]。本研究选用宫颈癌原代培养细胞作为研究对象,为研究宫颈癌化疗、放疗、分子靶向等个体化治疗策略提供一定理论基础和科学依据。
[1] Eramo A,Lotti F,Sette G,et al.Identification and Expansion of the tumorigenic lung cancer stem cell population[J].Cell Death Differ,2008,15(3):504-514.
[2] Lobo NA,Shimono Y,Qian D et al.The biology of cancer stem cells[J].Annu Rev Cell Dev Biol,2007,23:675-699.
[3] Gupta PB,Chaffer CL,Weinberg RA.Cancer stem cells:mirageor reality[J].Nat Med,2009,15(9):1010-1012.
[4] Reya T,Morrison SJ,Clarke MF,et al.Stem cells cancer and cancer stem cells[J].Nature,2001,414(6859):105-111.
[5] 宋菁华,王克芳,李斌,等.人宫颈癌侧群细胞的分选及其生物学特性的研究[J].首都医科大学学报,2012,33(1):5-10.
[6] Setoguchi T,Taga T,Kondo T.Cancer stem cells persist in many cancer cell lines.[J].Cell Cycle,2004,3(4):414-415.
[7] Karla PK,Earla R,Boddu SH,et al.Molecular expression and functional evidence of a drug efflux pump(BCRP)in human corneal epithelial cells[J].Curr Eye Res,2009,34(1):1-9.
[8] Gao JX.Cancer stem cells:the lessons from pre-cancerous stem cells[J].J Cell Mol Med,2008,12(1):67-96.
[9] Nicolazzo JA,Katneni K.Drug transport across the blood brain barrier and the impact of breast cancer resistance protein(ABCG2)[J].Curr Top Med Chem,2009,9(2):130-147.
[10] Donnenberg VS,Donnenberg AD.Multiple drug resistance in cancer revisited:the cancer stem cell hypothesis[J].J Clin Pharmacol,2005,45(8):872-877.
[11] Amaro-Filho SM,Golub JE,Nuovo GJ,et al.A comparative analysis of clinical and molecular factors with the stage of cervical cancer in a Brazilian cohort[J].PLoS One,2013,8(3):e57810.
[12] Martens JE,Arends J,Van der Linden PJ,et al.Cytokeratin 17and P63are markers of the HPV target cell,the cervical stem cell[J].Anticancer Res,2004,24(2B):771-775.
[13] Fong D,Yeh A,Naftalovich R,et al.Curcumin inhibits the side population(SP)phenotype of rat C6glioma cell line:towards targeting of cancer stem cells with phyto chemicals[J].Cancer Lett,2010,293(1):65-72.
[14] Wu C,Alman BA.Side population cells in human cancers[J].Cancer Lett,2008,268(1):1-9.
[15] 万丽娟,吴楠.宫颈癌干细胞表面标志物的研究进展[J].现代妇产科进展,2011,20(12):990-992.
