预注射小剂量氯胺酮或右美托咪定对瑞芬太尼全身麻醉后痛觉过敏的影响*
2014-03-08刘乃和冯继英刘功俭
刘乃和,冯继英,刘功俭,孙 申
(1.徐州医学院麻醉学院,江苏徐州221000;2.江苏省连云港市第一人民医院麻醉科 222002;3.复旦大学附属妇产科医院麻醉科,上海200090)
瑞芬太尼(remifentanil)是一种超短效阿片μ受体激动药,但术后易出现急性阿片耐受和痛觉过敏,临床表现为急性、不易控制的剧烈疼痛,镇痛时需增加阿片类药物剂量[1-3],并且一定程度上影响全身麻醉患者苏醒质量。研究表明,静脉预注射氯胺酮(ketamine)或右美托咪定(dexmedetomidine)均可抑制术后瑞芬太尼诱发的痛觉过敏[4-5]。但氯胺酮和右美托咪定药理作用不同,临床上哪个在抑制瑞芬太尼诱发痛觉过敏的作用方面更有优势,目前尚无研究比较。本研究拟比较小剂量氯胺酮或右美托咪定预防瑞芬太尼诱发的痛觉过敏的效果,以期为临床合理用药提供参考。
1 资料与方法
1.1 一般资料 本研究经连云港市第一人民医院医学伦理委员会批准,选择2012年3月至2013年10月连云港市第一人民医院择期全身麻醉下经腹全子宫切除术患者60例,年龄18~55岁,体质量46~78kg,美国麻醉师协会(ASA)分级Ⅰ级或Ⅱ级,无慢性疼痛病史,术前48h未使用过镇痛药,无药物或酒精成瘾,无精神疾病史,肝、肾、肺功能无异常。患者均学会使用自控镇痛电子泵(YX-3B/E,上海怡新医疗设备有限公司)及准确理解视觉模拟评分(visual analogue scale,VAS)法判断疼痛程度。将患者分为3组(Ⅰ、Ⅱ、Ⅲ组),每组20例。3组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 治疗方法 患者均无麻醉前用药。入室后常规监测心电图(ECG)、心率(HR)、血压(BP)、脉搏血氧饱和度(SPO2)、呼气末CO2分压(PETCO2)。麻醉诱导前30minⅠ组静脉输注生理盐水10mL;Ⅱ组静脉输注氯胺酮0.5mg/kg(批号:130223,福建古田药业有限公司);Ⅲ组静脉输注右美托咪定0.5μg/mL(批号:11031034,江苏恒瑞医药有限公司)。Ⅱ组和Ⅲ组均用生理盐水稀释到10mL,3组的输注速度均为1 mL/min。30min后开始靶控输注异丙酚和瑞芬太尼进行诱导(Injectomat TIVA Agilia输液泵,德国Fresenius Kabi公司),异丙酚效应室靶浓度设为5μg/mL,瑞芬太尼(批号:091115,湖北宜昌人福药业有限公司)效应室靶浓度设为3ng/mL,待患者意识消失后静脉注射顺式阿曲库铵0.2mg/kg,气管插管后机械通气,吸入O2∶空气=1∶1,潮气量8~10mL/kg,呼吸频率12次/min,维持PETCO235~45mm Hg。术中瑞芬太尼靶浓度不变,调节异丙酚靶浓度,维持血压波动范围不超过基础值的20%。若收缩压升高大于基础值的20%或发生体动反应,则以效应室靶浓度0.5μg/mL递增异丙酚,若5min内收缩压未回到目标范围,异丙酚效应室靶浓度再递增0.5μg/mL。若收缩压降低大于基础值的20%或平均动脉压低于60 mm Hg,则以效应室靶浓度0.5μg/mL递减异丙酚,必要时静脉注射麻黄碱5mg。发生严重窦性心动过缓(HR<45次/min)时静脉注射阿托品0.5mg。术中酌情追加顺式阿曲库铵,每次5~10mg。缝皮结束停止输注异丙酚和瑞芬太尼,当患者能抬头5s、呼之睁眼、自主呼吸频率大于12次/min时拔除气管导管,送往麻醉恢复室(PACU)。患者在PACU内由另一位麻醉医生观察,观察时间为2h。
1.2.2 观察指标 采用VAS法评价疼痛程度(无痛为0cm,剧痛为10cm),第1小时内每15分钟评分1次,第2小时内每30分钟评分1次。当VAS≥4分或患者要求镇痛时,静脉注射吗啡1mg,5min后可重复,直至VAS<4分。观察2h后若患者的VAS<4分,启动自控镇痛电子泵,送返病房。记录麻醉苏醒期的不良事件(烦躁、恶心呕吐、头晕、喉痉挛和呼吸抑制),从麻醉停药到第一次出现VAS≥4分的间隔时间,PACU中注射吗啡后VAS降到4分以下所需的时间,术后2h PACU中各观察时间点疼痛评分以及静脉吗啡总用量。
1.3 统计学处理 采用SPSS13.0软件进行统计学分析。计量资料以±s表示,行单因素方差分析,组间多重比较采用LSD-t检验,计数资料以率表示,采用χ2检验。等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者PACU中疼痛相关指标比较 与Ⅰ组比较,Ⅱ组、Ⅲ组麻醉停药后第一次出现VAS≥4分的间隔时间均延长,静脉注射吗啡后VAS降至4分以下所需时间均缩短,PACU中使用吗啡总量均减少(P<0.05);Ⅱ组与Ⅲ组比较差异无统计学意义(P>0.05),见表1。
表1 3组患者PACU中疼痛相关指标比较(n=20,±s)

表1 3组患者PACU中疼痛相关指标比较(n=20,±s)
a:P<0.05,与Ⅰ组比较;b:P<0.05,与Ⅱ组比较。
组别从麻醉停药到出现VAS≥4分间隔时间(min)注射吗啡后VAS降低至4分以下所需时间(min)PACU中静脉吗啡总用量(mg)Ⅰ组15.8±8.6 5.7±3.5 12.0±3.5Ⅱ组 25.4±9.4a 2.6±3.3a 4.0±2.4aⅢ组 26.5±7.6b 2.5±3.5b 4.0±3.8b
2.2 3组患者术后各观察时间点疼痛评分比较 术后15min 3组的疼痛评分差异无统计学意义(P>0.05);与Ⅰ组比较,术后30、45、60、90、120minⅡ组与Ⅲ组疼痛评分均降低(P<0.05),Ⅱ组与Ⅲ组比较差异无统计学意义(P>0.05),见表2。
表2 3组患者术后各观察时间点疼痛评分比较(n=20,±s,分)
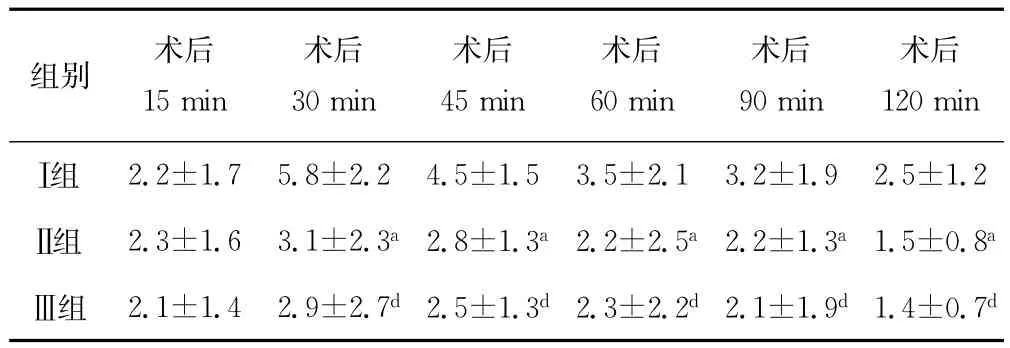
表2 3组患者术后各观察时间点疼痛评分比较(n=20,±s,分)
a:P<0.05,与Ⅰ组比较;d:P<0.05,与Ⅱ组比较。
组别 术后15min术后120minⅠ组 2.2±1.7 5.8±2.2 4.5±1.5 3.5±2.1 3.2±1.9 2.5±术后30min术后45min术后60min术后90min 1.2Ⅱ组 2.3±1.6 3.1±2.3a2.8±1.3a2.2±2.5a2.2±1.3a1.5±0.8aⅢ组 2.1±1.4 2.9±2.7d 2.5±1.3d 2.3±2.2d 2.1±1.9d 1.4±0.7d
2.3 3组患者不良反应比较 3组患者围术期的不良反应发生(烦躁、恶心呕吐、头晕、喉痉挛和呼吸抑制)差异无统计学意义(P>0.05),见表3。
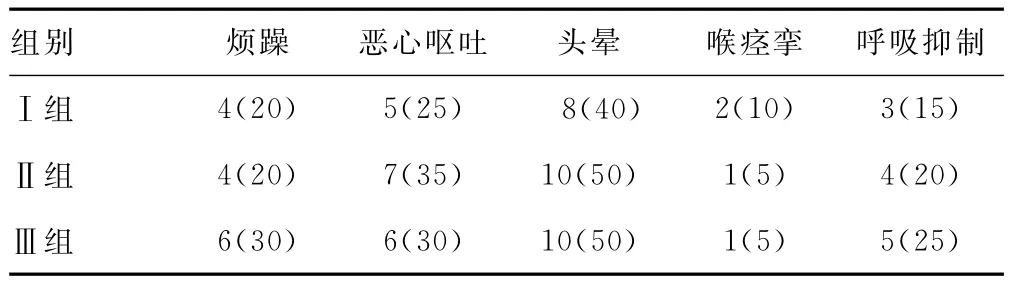
表3 3组患者不良反应比较[n=20,n(%)]
3 讨 论
临床工作中,瑞芬太尼与异丙酚联合应用于患者全身麻醉目前越来越普遍。瑞芬太尼由体内非特异性酯酶代谢,消除半衰期3~5min,时量相关半衰期3~4min,无蓄积作用,故苏醒迅速。但瑞芬太尼也有其缺点,其代谢物为无生物活性的瑞芬太尼酸,停用后镇痛作用迅速消失,诱发急性阿片耐受和痛觉过敏[3],导致患者在苏醒后很快出现剧烈疼痛,术后阿片类镇痛药物用量增加。故对全身麻醉中应用瑞芬太尼全身麻醉的患者,如何做好术后镇痛、抑制痛觉过敏是麻醉医生应该关心的问题。
本研究中Ⅱ组患者麻醉前预注射小剂量氯胺酮,术后患者镇痛效果明显优于Ⅰ组,结果与邹志清等[6]报道一致。其机制可能为,瑞芬太尼上调环磷腺苷(cAMP)通路,大量激活N-甲基-D-天冬氨酸(NMDA)受体,促进炎性介质级联反应,提高神经元的兴奋性,使得疼痛中枢敏化。而氯胺酮是非竞争性NMDA受体阻断剂,与NMDA受体的结合相对缓慢,可预防外周伤害性刺激所导致的中枢性痛觉敏化;同时可抑制突触前膜谷氨酸盐的释放,增强 Mg2+对突触后膜NMDA受体通道的堵塞,从而加强了对中枢NMDA受体的阻滞作用,抑制瑞芬太尼所诱导的痛觉过敏的发生。
右美托咪定是高效和高选择性的α2肾上腺素能受体激动药,为美托咪定的活性异构体。主要作用于中枢和外周神经系统,产生镇痛、镇静、抗焦虑和抑制交感神经兴奋作用。在本研究中,Ⅲ组患者术后镇痛效果明显优于Ⅰ组,其机制可能为,右美托咪定可以抑制NMDA受体突触后电位,使其兴奋性降低,从而抑制A和C初级纤维介导的突触传递,使得患者切口伤害性刺激信号传入减少;通过兴奋突触前和突触后α2受体,产生负反馈调节,引起神经细胞膜的超极化,抑制痛觉神经元的兴奋性;作用于蓝斑、下行延髓-脊髓去甲肾上腺素能通路,抑制伤害性炎性递质的传递。此外,中枢痛觉过敏与炎性介质及其所介导的炎性免疫应答关系密切[7-8]。已有研究表明,右美托咪定能够通过中枢交感神经系统和副交感神经系统的相互作用,抑制炎性因子如TNF-α、IL-1和IL-6的表达,发挥抗炎作用[9]。这些都可能是右美托咪定对抗瑞芬太尼诱发的痛觉过敏的机制。
氯胺酮和右美托咪定都有一定的镇痛作用,它们在临床上的应用各有其优势和适应证,如氯胺酮可以减少术中知晓,同时具有抗肿瘤、抗抑郁及神经保护作用[10]。右美托咪定则有镇静、镇痛、抗交感、抑制应激反应、减少麻醉药及阿片类药物的用量等作用,可在稳定患者血流动力学的同时保持可唤醒,并无明显呼吸抑制[11]。本研究中氯胺酮和右美托咪定的使用剂量均为临床上的较小剂量,在麻醉诱导前30min使用,并不会增加麻醉苏醒期的其他不良事件的发生。临床医生可以根据具体的临床需要,在瑞芬太尼全身麻醉的患者中,联合应用氯胺酮或右美托咪定,预防瑞芬太尼诱发的痛觉过敏,提高全身麻醉苏醒的质量。
综上所述,预注射小剂量氯胺酮或右美托咪定均可对瑞芬太尼诱发的痛觉过敏起到一定的预防作用,且不增加患者不良反应的发生。
[1] Guntz E,Talla G,Roman A,et al.Opioid-induced hyperalgesia[J].Eur J Anaesthesiol,2007,24(2):205-207.
[2] Tirault M,Derrode N,Clevenot D,et al.The effect of nefopam on morphine overconsumption induced by large-dose remifentanil during propofol anesthesia for major abdominal surgery[J].Anesth Analg,2006,102(1):110-117.
[3] Joly V,Richebe P,Guignard B,et al.Remifentanil-induced postoperative hyperalgesia and its prevention with smalldose ketamine[J].Anesthesiology,2005,103(1):147-155.
[4] Kitamura T,Kawamura G,Iwanaga S,et al.Effects of preoperative ketamine on postoperative pain in patients undergoing laparotomy[J].Masui,2008,57(8):963-967.
[5] 陶佳,顾小萍,彭良玉,等.右美托咪定预先给药对术后疼痛及瑞芬太尼痛觉过敏的影响[J].临床麻醉学杂志,2011,27(10):947-949
[6] 邹志清,李立,吴周全.静脉低剂量氯胺酮超前镇痛对腹腔镜胆囊切除术后苏醒和疼痛的影响[J].临床麻醉学杂志,2009,25(5):387-388.
[7] Wang KC,Wang SJ,Fan LW,et al.Interleukin-1receptor antagonist ameliorates neonatal lipopolysaccharide-induced long-lasting hyperalgesia in the adult rats[J].Toxicology,2011,279(1/3):123-129.
[8] Kim CF,Moalem-Taylor G.Interleukin-17contributes to neuroinflammation and neuropathic pain following peripheral nerve injury in mice[J].J Pain,2011,12(3):370-383.
[9] Hofer S,Steppan J,Wagner T,et al.Central sympatholytics prolong survival in experimental sepsis[J].Critical Care,2009,13(1):R11.
[10] Hirota K,Lambert DG.Ketamine:new uses for an old drug[J].Br J Anaesth,2011,107(2):123-126.
[11] Mantz J,Josserand J,Hamada S.Dexmedetomidine:new insights[J].Eur J Anaesthesiol,2011,28(1):3-6.
