盘羊体内绵羊肺炎支原体的分离和鉴定
2014-03-08冷青文李志远鲁海富金云云王静梅剡根强
冷青文,李志远,鲁海富,金云云,王静梅,剡根强
(石河子大学 动物科技学院,新疆 石河子 832003)
绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO)是引起绵羊支原体肺炎(又称绵羊传染性胸膜肺炎)的一种慢性呼吸道传染病的病原,主要危害1 月龄~3 月龄的羔羊,以咳嗽、气喘、渐进性消瘦和肺间质的慢性增生性炎症为特征。最早由Mackay等从患肺腺瘤的绵羊体内分离得到[1],Cottew 在澳大利亚患病绵羊的肺脏中也发现了该支原体[2]。随后的研究表明,MO 在世界许多国家和地区均有流行,是危害养羊业的主要病原之一。其主要感染绵羊和山羊等家养动物,而引起野生动物致病的病例鲜有报道[3-4]。本研究从某动物园疑似肺炎的盘羊体内采集病料样品,并对病原体进行分离鉴定,查明该盘羊群发病的原因为MO 感染,为进一步有效防治该病提供临床资料。
1 材料和方法
1.1 菌种、培养基及实验动物 MO 参考株Y-98购自中国兽医药品监察所;丝状支原体山羊亚种(M.mycoides subsp.Capri,Mmc)和MO-141 分离株由本学院预防兽医学实验室提供。改良Hayflick's 液体培养基成分为:25%酵母浸出液1 mL,1 % HLH 混合液48 mL,牛心汁30 mL,猪血清20 mL,50 %葡萄糖2 mL,0.2%DNA 1 mL,5%醋酸铊0.5 mL,青霉素200 U/mL,0.4%酚红0.3 mL;改良固体培养基成分为:25 %酵母浸出液10 mL,牛心汁70 mL,胰蛋白胨1 g,琼脂粉1.4 g,牛血清20 mL,5 %醋酸铊0.5 mL,青霉素200 U/mL。从石河子某羊场选取体质量相近的8 只60 日龄健康绵羊作为实验动物。
1.2 病料样品的采集 新疆某动物园饲养的盘羊发生呼吸道疾病,初步诊断为肺炎,使用抗生素治疗效果不佳。无菌采集病死盘羊的病变肺组织1 份;采集与疑似病羊同群的28 只盘羊的鼻腔棉拭子各1 份。
1.3 病原分离 取部分肺组织样品按1∶10 加入液体培养基研磨成乳剂,3 000 r/min 离心10 min,以0.45 μm 滤器过滤上清液。取0.2 mL 滤液接种于3 mL改良Hayflick's 液体培养基以10 倍递减稀释至10-7,于37 ℃5 %~10 % CO2培养。将鼻腔棉拭子在液体培养基中反复挤压后,取其浸出液按上述方法进行过滤、稀释和培养。培养5 d~7 d 后,当培养基由红色变为橙黄色时,取液体培养物接种于改良固体培养基,于37 ℃5 %~10 % CO2、湿度为80 %的条件下培养7 d。在低倍显微镜下挑取单个特征明显的菌落接种于液体培养基继续培养,待培养物颜色明显变化后再次接种固体培养基。重复操作3次,得到分离纯化的培养物。
1.4 病原鉴定
1.4.1 形态学观察 将纯化的液体培养物离心浓缩后涂片,经碱性复红染色,利用油镜观察菌体形态。取纯化的液体培养物0.1 mL 接种于改良固体培养基培养,培养条件同1.3,5 d~7 d 后置低倍镜下观察菌落形态。
1.4.2 菌落Dienes 染色 将Dienes 染液滴加到菌落生长较好的改良固体培养平板表面,静置数分钟,弃去染液,并用生理盐水洗净平板表面的染色液。利用低倍镜观察菌落中心颜色是否为蓝色。
1.4.3 理化特性检验 根据OIE 相关文献[5]及国内行业标准[6]要求设定检验项目,进行理化特性检验,同时以MO-141 株为阳性对照。检验项目包括水解精氨酸、葡萄糖降解、氯化四氮唑还原试验、尿素分解、美蓝还原及红细胞吸附试验。
1.4.4 PCR 鉴定 提取肺组织样品滤液和各鼻腔棉拭子浸出液中的病原菌DNA 以及各对照菌株的DNA,置-20 ℃备用。
参照文献[7]的方法,以制备的病原菌基因组DNA 为模板,利用MO 特异性引物PF:5'-AGATA CGGCCCAGACTCCTAC-3' 和PR:5'-CTTCGCCTAT TGGTGTTCTTC-3'进行PCR 扩增,同时以MO 参考株Y-98、Mmc 和MO-141 株的DNA 为对照。引物由上海生工生物工程技术服务有限公司合成。
1.5 人工感染试验 将经过培养基培养和PCR 鉴定均为MO 阴性的8 只绵羊随机平均分为2 组,分别作为实验组和对照组。实验组气管注射3 mL/只纯化的液体培养物(107CCU/mL~108CCU/mL),对照组气管注射3 mL/只生理盐水,并分群饲养。人工感染后每日上午定时测量体温,观察临床表现。至第35 d 迫杀试验羊,检查肺脏病变情况,取病变肺组织样品接种于改良Hayflick's 液体培养基,5 %CO237 ℃培养7 d,进行分子生物学鉴定;另取部分肺组织样品以10 %福尔马林固定,制作石蜡病理切片,HE 染色。
2 结果
2.1 分离与纯化 病料样品在液体培养基中培养5 d~6 d 后,培养基颜色发生变化的样品共有5 份,其中1 份为病变肺组织样品,4 份为鼻腔棉拭子样品,经纯化分别标记为M1、M2、M3、M4 和M5,其中M5 来源于病变肺组织,M1~M4 均纯化于鼻腔棉拭子样品。
2.2 形态观察及Dienes染色 显微镜下显示菌体呈多形性,红色,其中杆状和小球状较多,杆状两极着色。菌落呈透明的针尖状,表现为圆形、突起,中心无“脐”,无“煎蛋状”特征(图1A)。Dienes染色菌落中心呈深蓝色,30 min 内不褪色(图1B)。
2.3 理化特性检验 5 个分离菌株均能够发酵葡萄糖产酸、还原氯化四氮唑、还原美蓝;均不水解精氨酸、不水解尿素、不吸附红细胞(表1)。

图1 分离株菌落形态及其Dienes 染色结果Fig.1 Shape of isolated colonies and Dienes stained

表1 理化特性检验结果Table 1 Results of biochemistry identification test
2.4 PCR检测 分别对提取的32 份DNA 样品进行PCR 扩增,1 %的琼脂糖凝胶电泳检测,共有7份DNA 样品扩增后获得长度与预期相符的目的片段,并且特异性和重复性好,它们对应的样品分别为肺脏、Y-98、MO-141 株和4 例鼻腔棉拭子。Mmc 及阴性对照样品未扩增出特异性目的片段(图2)。由鼻腔棉拭子扩增出的特异性目的片段纯化后由上海生工生物工程技术服务有限公司测序,结果表明核苷酸序列长度为406 bp。以DNAStar 软件比较目的片段和GenBank 中相关支原体的序列,该序列与MO 标准株Y-98 同源性为99.9 %,而与Mmc、山羊支原体山羊肺炎亚种(Mccp)、山羊支原体山羊亚种(Mcc)等同源性为81 %。
2.5 人工感染试验
2.5.1 临床症状 在试验过程中,人工感染组2 号和3 号羊出现呼吸症状,同时体温伴随波浪型变化,体温最高时分别升至40.8 ℃和41.2 ℃;1 号羊体温变化不明显,4 号羊和对照组的体温始终在正常范围内。
2.5.2 肺组织样品的培养鉴定 分别取4 只人工感染羊病变肺组织样品采用支原体专用培养基培养7 d后,培养基颜色变黄呈阳性;克隆纯化后的液体培养物经PCR 鉴定为MO(图3)。

图2 部分样品PCR 检测结果Fig.2 PCR identification for some of the samples

图3 人工感染羊的PCR 检测Fig.3 PCR identification of inoculated sheep
2.5.3 病理学观察 剖检4 只试验羊,结果显示:3 号羊肺脏肿大与胸腔粘连,右肺尖叶、心叶实变明显、局灶性脓肿、纤维素炎,胸腔有淡黄色积水。显微镜观察肺间质增宽,支气管上皮细胞和肺泡细胞增生,肺泡壁毛细血管扩张、充血,淋巴细胞浸润;部分肺组织肺泡浆液性浸出,肺泡增大、内有大量炎性细胞,肺泡壁网状细胞增生(图4)。其它羊肺脏病理变化不明显。
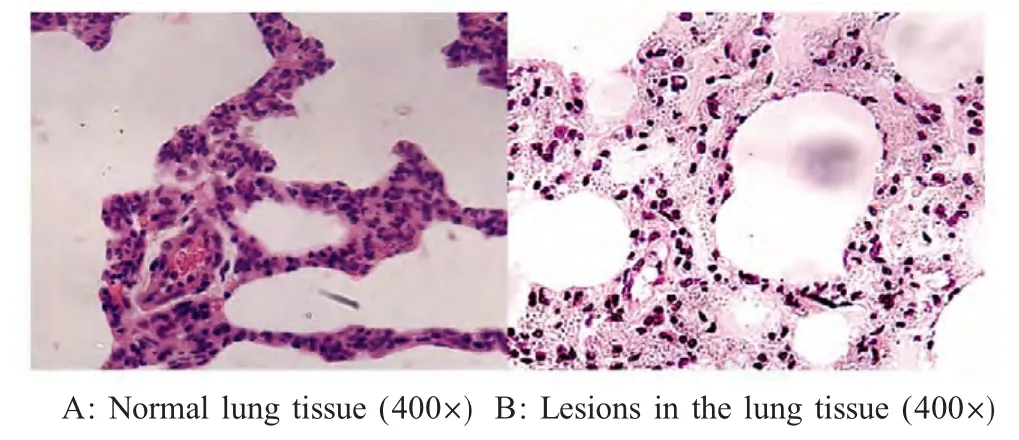
图4 人工感染羊肺脏病理变化Fig.4 The lung of infected sheep
3 讨论
多种支原体可以引起羊支原体性肺炎,山羊传染性胸膜肺炎(CCPP)的病原主要为Mccp,与其密切相关的其它3 种支原体是丝状支原体丝状亚种大菌落型(LC)、Mmc 和Mcc。我国CCPP 的病原主要为Mccp。绵羊偶而也会携带Mccp[8]或出现Mccp 血清阳性反应[9],最近也有Mccp 感染野生动物的报道[5]。MO 主要感染绵羊,有时也是山羊肺炎的病原[10]。
盘羊是中亚山地特有的高山偶蹄类动物,主要分布在青藏高原、蒙新高原以及邻近地区的山地。国际濒危物种公约将其不同亚种分别列为附录Ⅰ或Ⅱ,我国则将其所有亚种都列为濒危国家二级保护动物。由于数量稀少,分布、栖息环境荒僻,人们很难得到野生盘羊的病例。具有观赏和保护价值的圈养野生动物,因其良好的饲养和管理条件,很少发生传染性疾病。作为偶发病例,本研究证明MO是盘羊发病的病原。调查结果显示发病盘羊所在地区为绵羊支原体肺炎高发区[11]。MO 主要通过空气传播,易感动物可以长期带菌,其对宿主的致病性与宿主的生活环境、营养状况、免疫力等多种因素有关。根据流行病学、临床表现和病理剖检变化等指标结合实验室病原检测,可以对绵羊支原体肺炎做出诊断。本研究为野生动物保护和当地动物疫病的防控工作提供参考依据。
[1]Mackay J M K,Nisbet D I,Foggie A.Isolation of pleuropneumonia-like organisms(Genus Mycoplasma)from cases of sheep pulmonary adenomatosis[J].Vet Rec,1963,75(21):550-551.
[2]Cottew G S.Characterisation of Mycoplasmas isolated from sheep with pneumonia[J].Aust Vet J,1971,47(12):591-596.
[3]杨发龙,王华,岳华,等.山羊中绵羊肺炎支原体的分离及鉴定[J].中国畜牧兽医,2010,37(8):177-179.
[4]李媛,陶岳,阿依吐拉,等.从湖羊肺脏中分离绵羊支原体的鉴定[J].中国预防兽医学报,2006,28(4):375-379.
[5]OIE.Manual of diagnostic tests and vaccines for terrestrial animals 2013[EB].http://www.oie.int/en/international-standard-setting/terrestrial-manual/access-online,2013.
[6]SN/T 2710-2010.中华人民共和国出入境检验检疫行业标准山羊传染性胸膜肺炎检疫技术规范[S].
[7]冷青文,李志远,屈勇刚,等.盘羊肺炎支原体感染PCR检测方法的建立与初步应用[J].兽类学报,2011,31(3):312-316.
[8]Cetinkaya B,Kalin R,Karahan M,et al.Detection of contagious caprine pleuropneumonia in East Turkey[J].Rev Sci Tech,2009,28(3):1037-1044.
[9]Hadush B,Eshetu L,Mengistu W,et al.Seroprevalence of contagious caprine pleuropneumonia in Kefta Humera,Alamata(Tigray)and Aba-ala(Afar),Northern Ethiopia[J].Trop Anim Health Prod,2009,41(5):803-806.
[10]杜永风,文心田,曹三杰,等.山羊传染性胸膜肺炎病原分离与鉴定[J].中国预防兽医学报,2006,28(6):618-621.
[11]陶岳,李新萍,剡根强,等.新疆石河子地区湖羊传染性胸膜肺炎流行病学调查研究及预防控制效果的初步研究[J].中国畜牧兽医,2006,33(2):62-65.
