兔出血症病毒VP60抗原优势区和Th细胞表位融合蛋白的原核表达及免疫效力测定
2014-03-08孟春春程英杰李传峰王玢瑸缪秋红陈宗艳刘光清
孟春春,程英杰,李传峰,王玢瑸,缪秋红,陈宗艳,吴 润,刘光清
(1.中国农业科学院 上海兽医研究所,上海 200241;2.甘肃农业大学 动医医学院,甘肃 兰州 730070;3.西北农林科技大学 动物医学院,陕西 杨凌 712100)
兔病毒性出血症(Rabbit hemorrhagic disease,RHD),又称兔瘟,是由RHD 病毒(RHDV)引起的一种以急性、高度传染性、大面积坏死为特征的兔传染病。OIE 将该病列为必须呈报疫病,我国将其列为二类疫病[1]。2009 年国际病毒学分类委员会将RHDV 划定为杯状病毒科(Caliciviridae)兔病毒属(Lagovirus)中的成员。RHDV 的基因组为单股正链RNA,全长约7.5 kb,基因组含有两个开放阅读框(ORF),共编码9 个成熟蛋白。其中VP60 为RHDV的主要结构蛋白,也是最主要的免疫保护性抗原[2-3]。
近年研究表明,VP60 蛋白的优势抗原决定簇主要分布于两端[4-5]。因此本研究选取RHDV 衣壳蛋白VP60 两端的优势抗原区域A(aa31~aa250)和B(aa472~aa579),采用融合PCR 的方法将两个片段扩增拼接并与通用Th 细胞表位融合,利用pET-30a(+)表达系统表达了RHDV 重组多肽片段AB-Th 重组蛋白,并制备了多克隆抗体,western blot 检测显示特异性良好。将该融合蛋白免疫实验兔两次后,能够完全保护实验兔对抗强毒攻击,这为下一步研究RHDV 的新型亚单位疫苗奠定了基础。
1 材料和方法
1.1 主要实验材料 重组质粒pBL-RHDV(含有RHDV 全长基因组cDNA 序列)和RHDV-VP60 原核表达蛋白均由中国农业科学院上海兽医研究所刘光清课题组构建并保存[6];pET-30a(+)载体购自Novagen 公司;E.coli JM109 和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;r Taq DNA聚合酶、T4 DNA 连接酶和限制性内切酶购自TaKaRa 公司;DAB 显色液购自武汉博士德生物工程有限公司;Pfu DNA 聚合酶、细菌蛋白抽提剂和抗His 标签鼠单克隆抗体(MAb)购自北京康为世纪生物科技有限公司;CellTiter 96 AQ One solution Cell proliferation assay kit 购自Promega 公司;HRP标记的山羊抗鼠IgG(IgG-HRP)和山羊抗兔IgG-HRP购自北京中杉金桥生物技术有限公司;2 月龄非免疫新西兰大白兔购自上海奉贤辉煌养殖场。
1.2 引物设计 根据GenBank 中登录的RHDV JX/97 株基因组序列(DQ205345)设计扩增AB-Th 基因的两对引物,P1:5'-ATGTCCGTCGCGGATGCG CCCGGC-3';P2:5'-ACTGCCGCCGCCGCC ACCAG TGAGGACTGGGGTCGTG-3';P3:5'-GGCGGCGGC GGCAGT CCCAGCTGCGGCGTTGACGTC-3';P4:5'-AGATTCGAACAGGATACCTTCGATTTTGTGAAC GATAACACCTTTGATTTCAGAGATAGAGATAACG TACAGTCAGACATAAGAAAAGCCATTGGTT-3'。
斜体部分为P2/P3 的互补区,下划线部分为P4引物所引入的Th 表位,引物由上海捷瑞生物工程有限公司合成。
1.3 重组表达质粒的构建与鉴定 以pBL-RHDV质粒为模板,P1 和P2 扩增A 片段,P3 和P4 扩增B 片段,然后利用P1 和P4 融合PCR 扩增,反应体系50 μL,其中模板(A、B)各1.0 μL,反应条件为:94 ℃5 min;94 ℃1 min、55 ℃30 s、72 ℃1 min,30 个循环;72 ℃10 min。融合PCR 扩增产物经80 g/L 琼脂糖凝胶电泳检测,采用试剂盒回收目的片段。将纯化的AB-Th 基因和pET-30a(+)载体分别用KpnⅠ、Hin dⅢ进行双酶切,T4 DNA 连接酶连接,转化E.coli JM109 感受态细胞,挑取阳性克隆由上海杰李生物技术有限公司测序,将鉴定正确的重组质粒命名为pETAB-Th。
1.4 融合蛋白AB-Th的诱导表达和纯化 将pETAB-Th 转化E.coli BL21(DE3)感受态细胞,挑取单菌落至含有卡那的LB 培养基中,37 ℃振荡培养至OD600nm为0.4~0.6 时,加入IPTG(终浓度1 mmol/L)进行诱导,SDS-PAGE 电泳分析。扩大培养表达AB-Th 重组菌,参照分子克隆第三版方法纯化AB-Th 重组蛋白。
1.5 AB-Th免疫原性检测 将纯化的AB-Th 融合蛋白免疫新西兰兔(60 日龄),400 μg/只,免疫程序为:首次免疫4 周后,进行第2 次免疫,以后再分别间隔2 周进行第3 次和第4 次加强免疫。第4 次加强免疫后1 周,经心脏采血,分离血清,于-80 ℃保存备用。以AB-Th 融合蛋白为抗原,将待检血清作为一抗(1∶200),羊抗兔IgG-HRP 作为二抗(1∶5 000),DAB 显色试剂盒进行显色。
1.6 AB-Th免疫效力检测 将10 只新西兰兔随机分为两组,每组5 只;一组使用纯化后的AB-Th 融合蛋白按500 μg/只的剂量免疫两次(皮下注射),首次免疫两周后进行第2 次免疫;同时设立PBS 免疫组为阴性对照组。分别于免疫前、一免后两周、二免后两周采血分离血清,以RHDV-VP60 原核表达蛋白为包被抗原(5 μg/孔),实验兔血清为一抗,过氧化物酶标记的羊抗兔IgG 为二抗,ELISA 法检测VP60 蛋白的抗体水平;同时分离外周血单核细胞,使用MTS 法测定淋巴细胞增殖情况。二免后第二周每只兔子肌肉注射RHDV 强毒JX/92 株1∶10 稀释的肝脏研磨液2 mL,每天观察并记录死亡兔子情况,连续观察14 d。
2 结果
2.1 重组表达质粒的鉴定 以pBL-RHDV 为模板,通过融合PCR 扩增出AB-Th 基因,其长度约为1 kb,与预期936 bp 相符(图1)。将基因AB-Th 与pET-30a(+)连接。通过序列测定,表明构建了含有AB-Th 基因序列的重组表达质粒pETAB-Th。
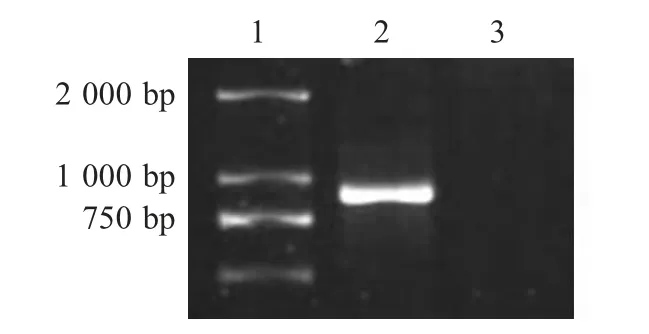
图1 AB-Th 基因的融合PCR 产物Fig.1 Overlapping PCR products of AB-Th gene
2.2 AB-Th的诱导表达、纯化及免疫原性检测将重组质粒pETAB-Th 转化E.coli BL21(DE3)感受态细胞,加入IPTG 诱导培养2 h~3 h,AB-Th 融合蛋白获得良好的表达,加上pET-30a 上的His 标签,表达产物的分子质量约为36 ku,与预期结果相符。可溶性分析结果表明,AB-Th 融合蛋白以包涵体形式表达。参照分子克隆第三版方法分离纯化包涵体,获得纯化的AB-Th 融合蛋白(图2A)。将纯化的AB-Th 融合蛋白免疫实验兔,获得抗AB-Th 蛋白的多克隆抗体。以1∶200 倍稀释的该抗体为一抗进行western blot 分析,结果在约36 ku 处出现一条反应条带,表明重组蛋白具有良好的免疫原性(图2B)。
2.3 AB-Th融合蛋白诱导体液免疫和细胞免疫结果 采集免疫AB-Th 融合蛋白的兔血清并分离血清,利用ELISA 方法检测VP60 蛋白的抗体水平,结果显示免疫组与对照组抗体上升情况差异显著,实验兔在一免后两周就产生了较高的抗体水平,在二免两周达到2.5 以上(图3A)。在每次免疫后的第2 周采集AB-Th 免疫组和对照组实验兔的外周血,分离淋巴细胞,MTS 法测定T 淋巴细胞的增殖情况,结果显示免疫组与对照组比较差异显著,表明携带Th 通用表位的重组蛋白组可以诱导高水平的细胞免疫(图3B)。
AB-Th 免疫组兔攻毒后连续14 d 均无死亡并且健康生长,其保护率为100 %。14 d 后解剖所有免疫兔,均未出现出血症状,肝、肺和肾等脏器正常。而PBS 对照组在攻毒后96 h 内5 只兔子全部死亡,眼观鼻腔中有泡沫状出血,眼结膜充血,剖检可见肝肿大,黄褐色,质脆,表面散在灰白色针尖至粟粒大坏死灶,两肾有不同程度淤血、变性,心腔内积留黑红色血液和血块。
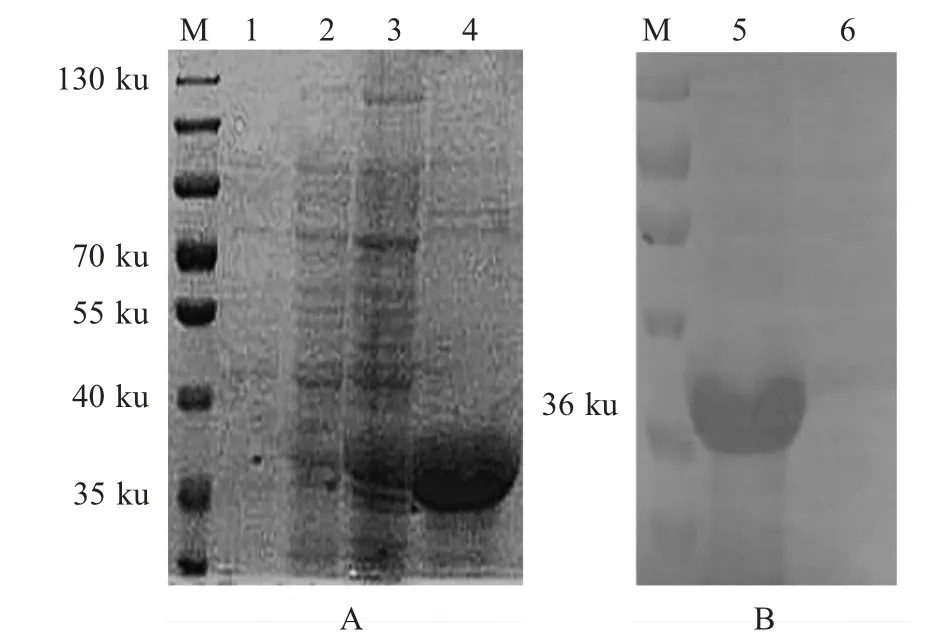
图2 AB-Th 融合蛋白的SDS-PAGE 检测(A)和多抗血清的western blot 鉴定(B)Fig.2 Analysis of AB-Th protein expression by SDS-PAGE(A)and polyclonal antiserum activity of AB-Th protein by western blot(B)
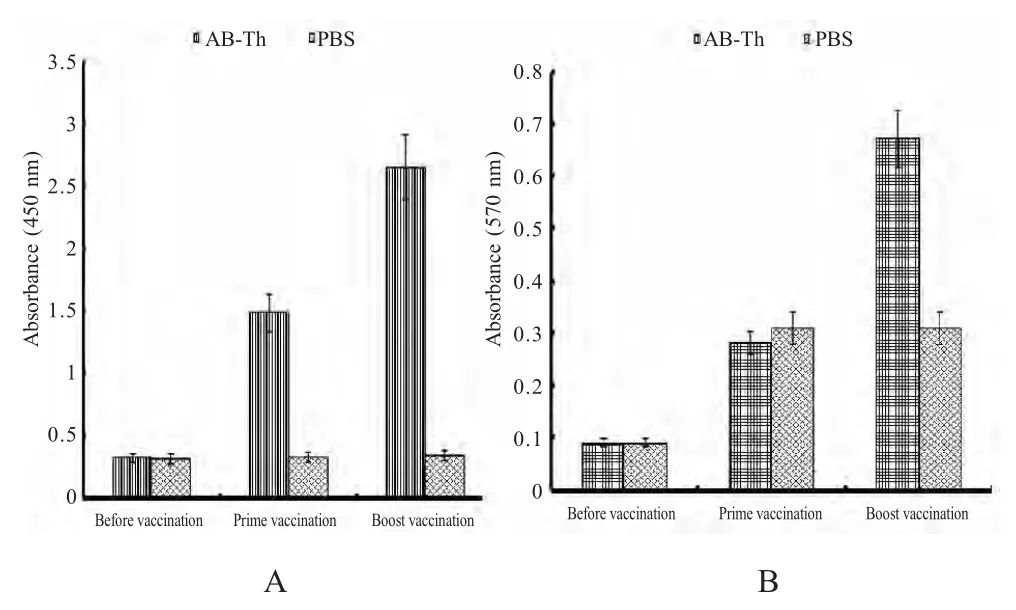
图3 检测RHDV VP60 抗体水平和淋巴细胞增殖情况Fig.3 Detection of RHDV VP60 antibody increasing and T-Lymphocyte proliferation
3 讨论
目前,RHD 已蔓延至我国绝大多数省市,给养兔业造成了严重的经济损失。由于至今尚无RHDV稳定传代培养的细胞系,所以目前广泛使用的疫苗仍为传统的组织灭活苗,其存在制作过程中向环境散毒、疫苗保存过程中易结块、注射抗原量难以统一、制备成本的不断提高等诸多弊端,作为替代组织灭活苗的基因工程亚单位疫苗,既能起到免疫作用,又能很好的解决组织灭活苗存在的生物安全性问题,成为目前研究的热点。
大量研究结果证明RHDV 衣壳蛋白VP60 与病毒的致病性和免疫原性密切相关。国内外学者使用不同的表达系统表达了VP60。严维巍和王永山等都通过大肠杆菌表达系统表达了RHDV 衣壳蛋白VP60,并且免疫实验均取得了较好的效果[7-8]。Laurent 等通过杆状病毒表达系统表达的RHDV VP60蛋白,经western blot 和ELISA 试验证明了表达产物的抗原性[9]。随后Nagesha 等都通过杆状病毒表达系统表达了RHDV VP60 蛋白,并且均观察到了病毒样颗粒(VLPs),经免疫试验同样证明可以产生免疫保护对抗RHDV 的攻击[10]。Boga 等用酿酒酵母表达了RHDV VP60,实验兔只需免疫一次重组蛋白后即可抵抗RHDV 的攻击[11]。由于RHDV 完整的衣壳蛋白分子量偏大,无论用原核表达系统还是真核表达系统均存在表达不稳定和表达量偏低的缺陷,这些均增加了RHDV 亚单位疫苗的生产成本,导致至今尚无商品化的RHDV 基因工程亚单位疫苗。
Torrecuadradan 等表明VP60 中有两个主要抗原优势区域,分别位于VP60 蛋白N 端的aa31~aa250和C 端的aa477~aa579 之间,而且N 端的抗原性显著强于C 端[5]。Viaplana E 等也从另一角度证明了该结论的正确性,他们将RHDV 的衣壳蛋白VP60分成5 个相互重叠的片段,分别在大肠杆菌中进行表达,将重组蛋白分别与自然感染和人工免疫兔的RHDV 抗血清进行反应,结果显示VP60 蛋白氨基端(包括蛋白的前175 个氨基酸)与抗血清的反应最强,而蛋白羧基端则较弱[4]。以上结果表明VP60 主要的抗原决定区分别在其两端,而中间区域的氨基酸序列对抗原性影响不大。
因此,本实验将RHDV 衣壳蛋白截短,将羧基端和氨基端的抗原优势区和通用Th 细胞表位融合,该构建方式不仅有利于提高抗原的表达量,还增强了细胞免疫应答。该融合蛋白的表达,为研究RHDV 新型基因工程亚单位疫苗提供参考。
[1]杨龙圣,薛家宾,王芳,等.兔出血症发病概况及疫苗研究进展[J].江苏农业科学,2007,256:144-147.
[2]Green K Y,Ando T,Balayan M S,et al.Taxonomy of the caliciviruses[J].J Infect Dis,2000,181:S322-330.
[3]Abrantes J,van der Loo W,Le Pendu J,et al.Rabbit haemorrhagic disease(RHD)and rabbit haemorrhagic disease virus(RHDV):a review[J].Vet Res,2012,43:12.
[4]Viaplana E,Plana J,Villaverde A.Antigenicity of VP60 structural protein of rabbit haemorrhagic disease virus[J].Arch Virol,1997,142:1843-1848.
[5]Martinez-Torrecuadrada J L,Cortes E,Vela C,et al.Antigenic structure of the capsid protein of rabbit haemorrhagic disease virus[J].J Gen Virol,1998,79(Pt 8):1901-1909.
[6]Liu Guang-qing,Ni Zheng.Rescued virus from infectious cDNA clone of rabbit hemorrhagic disease virus is adapted to RK13 cells line[J].Chinese Science Bulletin,2006,51:1698-1702.
[7]严维巍,崔治中,王永坤.中国株兔出血症病毒衣壳蛋白VP60 基因在大肠杆菌中的表达及其免疫原性鉴定[J].中国兽医学报,2003,5:447-449.
[8]王永山,陆承平,周宗安,等.原核表达的兔出血症病毒衣壳蛋白对兔的免疫保护效果[J].中国农业科学,2004,37(11):1677-1681.
[9]Laurent S,Vautherot J F,Madelaine M F,et al.Recombinant rabbit hemorrhagic disease virus capsid protein expressed in baculovirus self-assembles into viruslike particles and induces protection[J].J Virol,1994,68:6794-6798.
[10]Nagesha H S,Wang L F,Hyatt A D,et al.Self-assembly,antigenicity,and immunogenicity of the rabbit haemorrhagic disease virus(Czechoslovakian strain V-351)capsid protein expressed in baculovirus[J].Arch Virol,1995,140:1095-1108.
[11]Boga J A,Martin Alonso J M,Casais R,et al.A single dose immunization with rabbit haemorrhagic disease virus major capsid protein produced in Saccharomyces cerevisiae induces protection[J].J Gen Virol,1997,78(Pt 9):2315-2318.
