猪繁殖与呼吸综合征病毒NSP4切割天然免疫分子NEMO抑制I型干扰素的产生
2014-03-08张利杰李江南于会彬蔡雪辉翁长江
张利杰,李江南,胡 亮,张 泉,2,王 岩,3,于会彬,黄 丽,李 曦,蔡雪辉,翁长江*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物病原监测与流行病学研究创新团队,黑龙江 哈尔滨 150001;2.长江大学 生命科学学院,湖北 荆州 434023;3.昆明理工大学 生命科学与技术学院,云南 昆明 650500)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种由PRRS 病毒(PRRSV)引起的高度传染性疾病,主要临床特征为母猪严重繁殖障碍及仔猪和育肥猪的呼吸道症状。PRRSV 基因组为单股正链RNA,全长约15 kb。基因组5' 端有一个帽子结构,3' 端有一个poly(A)序列,含10 个ORFs,共编码14 种非结构蛋白NSP1α、NSP1β、NSP2-12(Nsp7 包括NSP7α 和NSP7β),其中非结构蛋白NSP1α、NSP1β、NSP2、NSP4 和NSP11 具有蛋白酶活性[1]。已知NSP1、NSP2、NSP4 和NSP11 均可抑制宿主IFNβ 的产生,NSP1α可以抑制胞浆内NF-κB 抑制因子IκB 的磷酸化[2];NSP1β 可以抑制干扰素调节因子3(IRF3)的磷酸化和入核[3];NSP2 能够抑制被磷酸化激活的IκB 的泛素化和IRF3 的磷酸化的发生[4]。NSP4 作为一种3C样蛋白酶在病毒复制酶的表达与加工过程中起到核心作用[5],并且能够诱导宿主细胞的凋亡[6],但其抑制IFNβ 启动子激活的机制尚无相关报道。
RNA 病毒复制过程中产生的双链RNA(dsRNA)可被RLRs(Retinoic acid inducible gene I-like helicases receptors)所识别,激活磷酸激酶TBK1 和IKKε,然后这些IKK(IκB kinase)相关激酶磷酸化IRF3,激活的IRF3 入核与IFNβ 启动子区域的IRF3 结合位点作用启动IFNβ 的转录[7-8]。NEMO(NF-κB essential modulator)作为IKK 复合物的一部分,严格调控核转录因NF-κB 的功能,并且对某些RNA 病毒感染后诱导的I 型干扰素(IFN-I)的产生也有重要的作用[9]。本研究采用高致病性PRRSV(HP-PRRSV)HuN4 株感染猪肺泡巨噬细胞(PAM),我们发现PRRSV 的NSP4 蛋白具有切割NEMO 的功能,从而抑制IFN-I的产生,初步阐明了PRRSV NSP4 抑制IFNβ 产生的机制。
1 材料和方法
1.1 病毒株、菌株、细胞和重组质粒 HP-PRRSV HuN4 株、E.coli DH5α、HEK293 细胞和重组质粒pHA-NSP1α、pHA-NSP1β、pHA-NSP2-N'、pHANSP4、pFlag-NEMO 均由本实验室构建或保存。PAM 由本实验室从健康猪肺脏中分离;仙台病毒(SeV)由武汉大学生命科学学院吴旻教授惠赠,报告基因质粒pIFN-β-Luc 和海肾荧光素酶pRL-TK 重组表达质粒由中国科学院武汉研究所唐宏研究员惠赠。
1.2 主要试剂 质粒提取试剂盒、DNA 胶回收试剂盒购自QIAGEN 公司;限制性内切酶、T4 DNA连接酶购自NEB 公司;兔抗Flag 和抗HA 单克隆抗体(MAb)、4',6'-二脒基-2-苯基吲哚(DAPI)、Anti-FLAG MAb 偶联的Protein A plus G Sepharose、羊抗鼠 IgG-HRP 和羊抗兔 IgG-HRP 均购自Sigma-Aldrich 公司;鼠抗Flag 和抗HA 多克隆抗体购自艾比马特公司;FITC 标记羊抗鼠 IgG(FITC-IgG)和羊抗兔TRITC-IgG 均购自中杉金桥生物技术有限公司;ECL 发光检测试剂盒购自Thermo公司;双荧光素酶报告基因检测试剂盒购自Promega 公司;鼠抗人的NEMO 抗体购自武汉三鹰生物技术有限公司。
1.3 重组质粒的构建 根据PRRSV-HuN4 株的cDNA 序列设计引物(表1),分别扩增NSP1α、NSP1β、NSP2 及NSP4 基因,扩增产物经酶切后克隆于pCAGGS-HA 载体中,命名为pHA-NSP1α、pHA-NSP1β、pHA-NSP2 及pHA-NSP4。并将猪源NEMO cDNA 克隆到pCAGGS-Flag 载体中,命名为pFlag-NEMO。
1.4 病毒感染试验 将新分离的PAM 细胞接种于6 孔板中,每孔约2×105。细胞培养12 h 后用不同感染复数(MOI)HP-PRRSV HuN4 感染,24 h 后收集细胞样品进行western blot 检测。
1.5 免疫共沉淀(Co-IP)试验 将重组质粒pHANSP4 和pFlag-NEMO 各2 μg 单独或共转染HEK293细胞,转染后36 h 裂解细胞并收集细胞裂解液,取出部分细胞裂解液用于检测目的蛋白的表达。剩余部分加入Anti-FLAG MAb(M2)的Protein A plus G琼脂糖珠,4 ℃旋转孵育过夜[10]。

表1 实验所用的引物Table 1 Primers used in this study
1.6 Western blot检测 蛋白样品经SDS-PAGE 电泳,转膜后用5 %脱脂乳室温封闭,分别以兔源抗HA 或Flag MAb(1∶1 000)为一抗,以羊抗兔IgG-HRP(1∶2 000)作为二抗,使用ECL 发光试剂盒检测[10]。
1.7 激光共聚焦检测试验 将pFlag-NEMO 和pHA-NSP4 共转染HEK293 细胞36 h 后,经4 %甲醛固定20 min、0.3%Triton X-100 透膜10 min、10%的FBS 血清封闭30 min;鼠源抗Flag MAb 抗体和兔源抗HA MAb 抗体(1∶100)室温孵育1 h;荧光二抗TRITC-IgG(1∶100)和FITC-IgG(1∶100)孵育1 h;最后用终浓度为1 mM DAPI 避光孵育20 min,激光共聚焦显微镜下观察[10]。
1.8 报告基因检测试验 将HEK293 细胞(5×104)接种于24 孔板,18 h~20 h 后转染。每组样品设三个平行实验组,加入空载体以保证每组转染质粒总量相同。每孔转染200 ng pIFNβ-luc 和800 ng pHANSP4 或其突变体和(或)500 ng pFlag-NEMO,同时加入10 ng pRL-TK 以检测转染效率。根据实验需要,细胞转染24 h 后感染SeV,12h 后进行荧光活性检测。
2 结果
2.1 PRRSV NSP4切割宿主蛋白NEMO 为了研究PRRSV 是否通过切割NEMO 抑制IFN-I 的产生,我们将HP-PRRSV HuN4 株分别以0、0.01、0.1 和1.0 MOI 梯度感染PAM 细胞,感染后24 h 收集样品通过Western blot 鉴定内源性NF-κB 信号通路关键调节蛋白NEMO 的表达情况。结果显示,HP-PRRSV 感染PAM 导致宿主蛋白NEMO 被切割,产生一条大小约40 ku 的蛋白条带,并且随着病毒感染剂量的升高切割NEMO 效果愈加明显(图1A)。已知PRRSV 编码4 个具有蛋白酶活性的蛋白NSP1α、NSP1β、NSP2 和NSP4,为了进一步确定切割NEMO 的蛋白酶,我们将重组质粒pHA-NSP1α、pHA-NSP1β、pHA-NSP2、pHA-NSP4 分别与pFlag-NEMO 共转染至HEK293 细胞,转染后36 h收集蛋白样品进行western blot 鉴定,试验结果显示,PRRSV 编码的蛋白酶NSP4 具有切割NEMO 功能,而NSP1α、NSP1β 和NSP2 并不能切割NEMO(图1B)。

图1 PRRSV NSP4 切割宿主蛋白NEMOFig.1 PRRSV NSP4 cleaved NEMO
2.2 PRRSV NSP4与蛋白NEMO相互作用的检测PRRSV NSP4 能够切割蛋白NEMO,我们推测NSP4与NEMO 在细胞内可能存在相互作用和具有共定位现象。将pHA-NSP4 和pFlag-NEMO 单独或共转染HEK293 细胞。Co-IP 和激光共聚焦试验结果显示,PRRSV NSP4 与NEMO 存在特异性的相互作用(图2A),两者在胞质中具有共定位现象(图2B)。这些结果表明PRRSV NSP4 可能通过与NEMO 相互作用并切割NEMO,最终抑制IFNβ 的产生。
2.3 PRRSV NSP4对NEMO的切割依赖于其蛋白酶活性 已有研究表明PRRSV NSP4 含有3 个酶活性位点,分别为His39、Asp64和Ser118,3 个位点中的任何一个位点突变均能导致3C 蛋白酶活性丧失[11]。为了验证NSP4 对NENO 的切割是否依赖于其3C 样蛋白酶活性,将PRRSV NSP4 64 位的D 突变为A(NSP4-D64A)后与NEMO 共转染于HEK293 细胞,通过western blot 检测NEMO 的切割情况。试验结果表明,野生型NSP4(NSP4-WT)能够切割宿主蛋白NEMO 而酶活性缺失体NSP4-D64A 则不能(图3),证明PRRSV NSP4 对NEMO 的切割作用完全依赖于其3C 样蛋白酶活性。

图2 PRRSV NSP4 与宿主蛋白NEMO 相互作用及共定位Fig.2 Identification of the interaction and colocalization between PRRSV NSP4 and NEMO
2.4 PRRSV NSP4对IFNβ 抑制作用依赖于其蛋白酶活性 利用双荧光素酶报告基因试验检测过表达NSP4 对SeV 诱导的IFNβ 基因启动子活性的影响。结果显示,过表达NSP4 显著抑制SeV 诱导的IFNβ报告基因活性,而NSP4-D64A 则没有影响(图4A)。由于病毒诱导IFNβ 的产生依赖于NEMO,因此可以通过检测NSP4 对NEMO 诱导的IFNβ-luc 活性的影响。检测结果表明,过表达NSP4 能够显著抑制NEMO 诱导的IFNβ 的产生,并且这种抑制效应依赖于NSP4 的蛋白酶活性(图4B)。
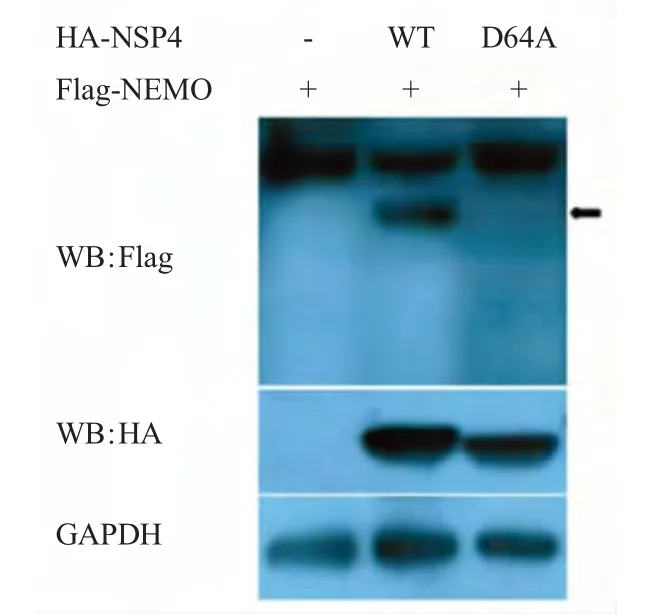
图3 PRRSV NSP4 切割NEMO 依赖于其酶活性Fig.3 Cleavage of NEMO depended on protease activity of PRRSV NSP4

图4 PRRSV NSP4 抑制IFNβ 依赖于其蛋白酶活性Fig.4 PRRSV NSP4 inhibited the activation of IFNβ promoter dependently on its protease activity
3 讨论
天然免疫反应是宿主抵制病毒感染的第一道防线。病毒在与宿主共进化过程中获得了免疫逃逸机制以应对机体的强烈天然免疫反应。病毒逃逸机制包括干扰IFN 受体信号传导或抑制各种抗病毒效应因子的激活,抑制IFN-I(IFNα 和IFNβ)的合成等。病毒基因组编码的蛋白酶通过切割天然免疫反应分子抑制IFNβ 的产生成为近来的研究热点。最新的研究表明,小RNA 病毒科的EV71(Enterovirus 71)病毒2A 蛋白酶和3C 蛋白酶分别通过切割天然免疫信号通路接头分子MAVS 和转录因子IRF7 抑制细胞内IFN 的表达[12-13]。小RNA 病毒科病毒口蹄疫病毒3C 蛋白酶通过切割宿主蛋白NEMO 破坏天然免疫信号的传导[14]。
由于PRRSV 和HP-PRRSV 的流行,对养猪业造成严重经济损失。PRRSV 感染细胞后显著抑制IFN-I 的表达,其非结构蛋白NSP4 也具有强烈的抑制作用。Zhao 等研究表明NEMO 缺陷型(Ikbkg-/-)小鼠胚胎成纤维细胞(MEF)在受到SeV 刺激时,IRF3的磷酸化和IFNβ 的产生受到抑制[9],表明NEMO是病毒介导干扰素产生的关键分子。本研究发现HP-PRRSV HuN4 感染PAM 细胞后能切割天然免疫分子NEMO,同时证实该切割作用是由蛋白酶NSP4 介导,而NSP4 酶活性缺失体D64A 没有介导NEMO 切割的能力。此外,证明NSP4 与NEMO 具有特异性相互作用,两者在胞质中共定位。与NSP4对NEMO 的切割效应相对应的是,野生型NSP4 过表达能够显著抑制NEMO 介导的IFNβ 启动子的激活,NSP4 酶活性缺失体却无此效应,表明NSP4 抑制IFNβ 产生作用与其活性相关,这也表明NSP4 的抑制机制可能与其切割NEMO 的关联性,初步阐明了PRRSV 抑制宿主天然免疫反应的一种新机制。
总之,本研究发现PRRSV 蛋白酶NSP4 切割关键天然免疫分子NEMO 破坏宿主细胞抗病毒状态的建立,揭示了一种PRRSV 病毒蛋白酶介导的逃避宿主天然免疫防御屏障的新策略。
[1]Snijder E J,Meulenberg J J.The molecular biology of arteriviruses[J].J Gen Virol,1998,79(5):961-979.
[2]Cheng Song,Peter K,Yoo D W.Nonstructural protein 1α subunit-based inhibition of NF-κB activation and suppression of interferon-β production by porcine reproductive and respiratory syndrome virus[J].Virology,2010,407:268-280.
[3]Lalit K.Beura,Sarkar S N,Kwon B.Porcine reproductive and respiratory syndrome virus nonstructural protein 1β modulates host innate immune response by antagonizing IRF3 activation[J].J Virol,2010,84:1574-1584.
[4]Li Hong-xia,Zheng Zhen-hua,Zhou Peng,et al.The cysteine protease domain of porcine reproductive and respiratory syndrome virus non-structural protein 2 antagonizes interferon regulatory factor 3 activation[J].J Gen Virol,2010,91:2947-2958.
[5]Gorbalenya A E,Koonin E V.Endonuclease(R)subunits of type-I and type-III restriction-modification enzymes contain a helicase-like domain[J].FEBS Lett,1991,291:277-281.
[6]Ma Zhi-tao,Wang Ya-lan,Zhao Hai-yan,et al.Porcine reproductive and respiratory syndrome virus nonstructural protein 4induces apoptosis dependent on its 3C-like serine protease activity[J].PLoS One,2013,8(7):e69387.
[7]Fitzgerald K A,McWhirter S M,Faia K L et al.IKKε and TBK1 are essential components of the IRF3 signaling pathway[J].Nature Immunol,2003,4:491-496.
[8]Sharma S,Tenoever B R,Grandvaux N,et al.Triggering the interferon antiviral response through an IKK-related pathway[J].Science,2003,300:1148-1151.
[9]Zhao Tie-jun,Yang Long,Sun Qiang,et al.The NEMO adaptor bridges the nuclear factor-κB and interferon regulatory factor signaling pathways[J].Nature Immunol,2007,8:592-600.
[10]尹曼曼,郭东伟,刘琴芳,等.猪繁殖与呼吸综合征病毒N蛋白与BCCIP 蛋白相互作用的鉴定[J].中国预防兽医学报,2013,5:341-345.
[11]Tian Xin-sheng,Lu Guang-wen,Gao Feng,et al.Structure and cleavage specificity of the chymotrypsin-like serine protease(3CLSP/nsp4)of porcine reproductive and respiratory syndrome virus(PRRSV)[J].J Mol Biol,2009,392:977-993.
[12]Wang Bei,Xi Xue-yan,Lei Xiao-bo,et al.Enterovirus 71 protease 2Apro targets MAVS to inhibit anti-viral type I interferon responses[J].PLoS Pathog,9:e1003231.
[13]Lei Xiao-bo,Xiao Xia,Xue Qing-hua,et al,Cleavage of Interferon Regulatory Factor 7 by Enterovirus 71 3C Suppresses Cellular Responses[J].J Virol,2013,87:1690-1698.
[14]Wang Dang,Fang Liu-rong,Li Kui,et al.Foot-and-Mouth disease virus 3C protease cleaves NEMO to impair innate immune signaling[J].J Virol,2012,86:9311-9322.
