2013年欧洲卒中组织关于颅内动脉瘤及蛛网膜下腔出血的管理指南(第一部分)
2014-03-08姜睿璇张娟边立衡
姜睿璇,张娟,边立衡
1 概论
1.1 引言 蛛网膜下腔出血(subarachnoid haemorrhage,SAH)是一种危害健康的疾病,其发病率每年接近9/100 000,6个月内死亡率约为60%。预后受多种可控制和不可控制因素影响,可控制因素包括手术干预治疗和内科管理措施。目前只检索到美国的国际指南。但美国指南仅涉及破裂动脉瘤引起的SAH,且在手术和管理理念以及流行病学方面可能存在差异。因此,有必要发表一份基于欧洲理念的关于管理SAH和未破裂动脉瘤的指南。
编写小组成员包括来自神经内科、神经外科、神经影像学及神经重症的专家。我们通过Medline和Embase检索了现有的相关文献。检索结果根据欧洲神经科学协会联盟(European Federation of Neurological Societies,EFNS)的标准进行评估和分级。证据水平分为Ⅰ~Ⅳ类。推荐级别分为A~C分级和优良临床试验规范(good clinical practice,GCP)分级。
1.2 定义——术语
关于定义的说明
本指南将“破裂颅内动脉瘤”(ruptured intracranial aneurysm,RIA)和“未破裂动脉瘤”(unruptured intracranial aneurysm,UIA)做了区分;后者可以是“无症状性的”或“症状性的”。
症状性UIA通常可引起颅神经麻痹,或者在极少情况下引起动脉栓塞。
无症状性UIA一般因伴有与动脉瘤无关的症状(如长期头痛/头晕等),检查时偶然发现(偶然发现动脉瘤)或出现SAH后发现的“额外动脉瘤”,但不是导致SAH的责任动脉瘤。
1.3 临床表现和分级 与动脉瘤性SAH预后密切相关的3项因素:患者入院时的神经功能状态、年龄和颅脑计算机断层扫描(computed tomography,CT)上显示的出血量。决定SAH预后的最重要因素是神经功能状态,尤其是患者的意识水平。由于神经功能在SAH患者病程中会有所改变,因此,为了清晰和明确地记录,可靠且有效的分级系统非常重要(可靠是指观察者之间和观察者前后评定的高度一致性;有效是指与预后有较好的相关性)。用于SAH患者初始评价的几个分级系统,多数情况下将其严重程度分为5级。一项目前仍广泛使用的评分量表为Hunt和Hess量表:除了意识水平(分为嗜睡、昏睡和昏迷),还包括头痛(轻度、中度、重度)、颈强直(轻度和明显颈强直)以及局灶性神经功能缺损(轻度、中度、重度偏瘫)。由于其对神经系统功能状态定义不明确,该量表的可靠性及有效性均较差。格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)在观察者间有较好的一致性,世界神经外科医师联盟(World Federation of Neurological Surgeons,WFNS)提出了一项基于GCS的5级分级量表,GCS评分为14分或13分同时合并局灶性神经系统功能缺损的患者为新增的1级。WFNS量表中的分界值是由专家共识制定,而不是基于正式的研究。另一项基于GCS的量表仅进行了回顾性评价,显示其效果优于Hunt和Hess量表和WFNS量表。动脉瘤性蛛网膜下腔出血入院时的预后评分(Prognosis on Admission of Aneurysmal Subarachnoid Haemorrhage,PAASH)完全基于GCS,该评分将6个月时预后出现显著性差异的GCS评分做为其2个连续分级间的分界值。PAASH量表在评估临床预后方面有较好的观察者之间和观察者自身前后的一致性。在一项比较对预后评估准确性的研究中,WFNS量表和PAASH量表对评价患者的预后均有较好的预测价值。而PAASH量表中不良预后患者的比例随评价级别升高逐渐增加,因此稍优于WFNS量表(表1)。
推荐
推荐应用基于GCS的评分系统,对SAH患者进行初始评价,即临床状态的分级评价。
PAASH量表稍优于常用的WFNS量表(Ⅲ类证据,C级推荐)。
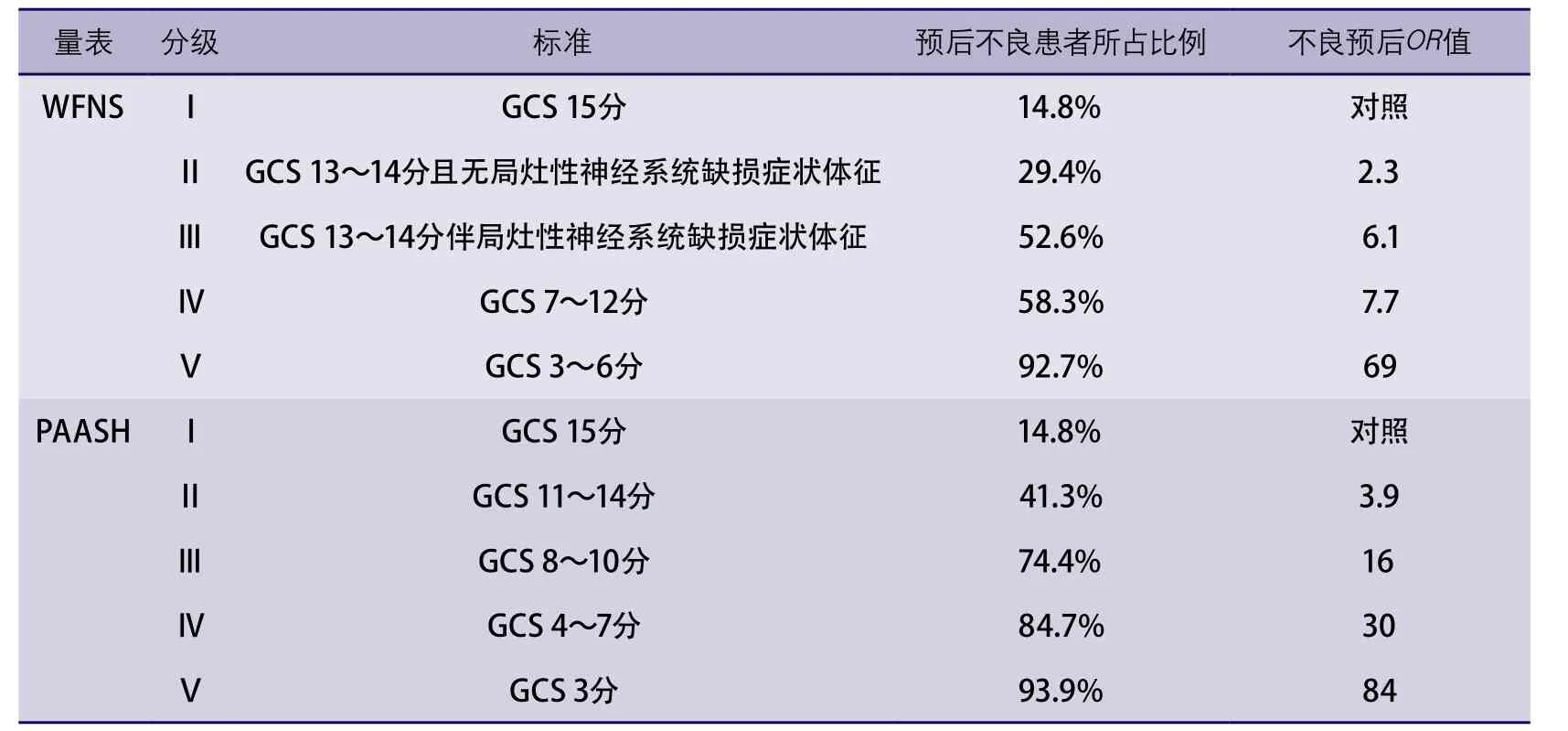
表1 两种SAH量表分级标准和预后的关系
2 动脉瘤性蛛网膜下腔出血——已破裂动脉瘤(RIA)
2.1 流行病学
2.1.1 发病率 S A H的发病率在世界范围内差别较大。除外芬兰和日本两个高发地区,公认的全球发病率约为每年9.1/100 000[95%可信区间(confidence interval,CI)8.8~9.5]。在CT普及应用的时代,报道的芬兰和日本SAH的发病率分别为每年15~17/100 000和22.7/100 000(95%CI 21.9/100 000~23.5/100 000)。SAH的发病率随年龄呈线性增加。SAH首次发病的平均年龄为50~60岁。另外,女性的发病率为男性的1.6倍,但这种趋势在50岁后才明显。之后,发病率又有下降的趋势。
针对普通人群和特殊人群的颅内动脉瘤的研究很多,包括回顾性及前瞻性的尸检及血管造影研究。成人患病率为2%~5%。据报道,经过血管造影及前瞻性的尸检研究显示未破裂动脉瘤的发生率为3%~4%。有家族史的动脉瘤患病率更高,达到9.5%。90%以上的动脉瘤直径<10 mm,90%的动脉瘤位于前循环。
发病率说明
多数地区SAH的发病率约为每年9.1/100 000,芬兰和日本的发病率相对更高;这个数据意味着欧洲共同体每年约有36 000例SAH患者。
2.2 结局/预后 关于动脉瘤性SAH自然史的数据很少。最可靠的关于已破裂囊状颅内动脉瘤自然史的资料来自一项针对非选择性人群和少数未手术患者的研究——Pakarinen研究。SAH后随着时间推移的累积死亡率为:SAH后第1天:25%~30%;第1周:40%~45%;第1个月:50%~60%;6个月:55%~60%;第1年:65%;第5年:65%~70%。约12%的患者在治疗前已死亡。
如果将治疗前已死亡的患者计算在内,43%的患者死于首次出血。74%死于首次SAH后的24 h,7%在2~3 d内死亡,12%在4~7 d内死亡,5%在2周内死亡,1%在第3周内死亡,1%第3周后死亡。
如果不治疗已破裂的动脉瘤,约1/3首次出血后康复的SAH患者,在6个月内死于再出血。SAH后6个月内再出血的累积风险为50%。之后10年再出血风险降低至每年3%。约2/3的患者因迟发再出血死亡。
尽管内外科治疗取得了很大进展,动脉瘤破裂仍有较高的死亡率(约1/3)和致残率(1/6)。1973-2002年死亡率降低了约17%,恢复自理的可能性每年增加了1.5%。但康复相关的数据仅基于少数的小样本研究。
SAH后的死亡率和功能预后由首次出血的严重程度决定。年龄是另外一项重要的影响因素。80岁以上老年患者的死亡率为年轻患者的3倍。其他决定因素有动脉瘤的位置和大小,高血压病史,高收缩压和酗酒。这些都是影响SAH预后的独立危险因素。另外,一项大规模Meta分析显示吸烟会增加迟发性脑缺血(delayed cerebral ischaemia,DCI)风险。尚无大样本队列研究评估生物标志物的作用。小规模研究提示早期死亡或致残的患者,其脑脊液(cerebrospinal fluid,CSF)中儿茶酚胺类含量增多。血清S100与SAH不良预后相关。
动脉瘤破裂后,不良预后与以下多种因素有关:①疾病相关事件(如再出血、DCI、脑积水);②治疗相关因素[外科手术(夹闭术)或血管内治疗(栓塞术)并发症];③长期卧床引起的并发症。动脉瘤破裂本身可以引起应激性高血糖、心肺并发症以及血液凝固性增加,这些独立于出血严重程度或代谢综合征的因素,可能增加预后不良的风险。因此SAH的预后是由多种因素决定的。
关于SAH后健康相关生存质量(healthrelated quality of life,HRQoL)的数据较少。SAH患者的HRQoL较正常人群显著降低。女性、严重SAH、功能残疾、抑郁、教育程度低和缺乏稳定的伴侣是HRQoL降低的独立预测因子。
2.3 危险因素 危险因素可以分为SAH、动脉瘤形成和动脉瘤生长三类。
SAH可控制的独立危险因素似乎只有吸烟、酗酒和高血压(Ⅲ类证据)。
2.3.1 吸烟 吸烟是SAH最重要的独立危险因素,已在世界范围内的多项队列研究[相对危险度(relative risk,RR),正在吸烟的RR 2.2]和病例对照研究[比值比(odds ratio,OR)3.1]中证实。在北美和欧洲,吸烟者SAH的患病率为45%~75%,而普通成年人为20%~35%。40%的SAH病例归因于吸烟。
对于未破裂的动脉瘤,其破裂的独立预测因素包括动脉瘤的大小、位置、年龄偏小和吸烟。如果动脉瘤患者继续吸烟,用时间相关的协变量校正吸烟对动脉瘤破裂的影响,其RR值为3%(95%CI 1.2%~7.7%)。
一项前瞻性随访研究显示,只有吸烟和女性是同时影响动脉瘤形成和生长的重要独立因素。相对于男性,女性动脉瘤形成的风险更高,而吸烟会加速动脉瘤生长。这些发现很重要,因为动脉瘤破裂前会先变大。生长速度越快,破裂风险越高。
2.3.2 饮酒 饮酒作为SAH的危险因素,其作用并不像吸烟那样明确。几项队列研究(>150克/周,RR 2.1)和病例对照研究(>150克/周,OR 1.5)显示排除吸烟、年龄、高血压病史的影响,过量的酒精摄入会同时增加男性和女性SAH的发生风险。Ruigrok等的研究显示,20%的SAH与饮酒超过300克/周有关,11%的SAH与饮酒100~299克/周有关。
2.3.3 高血压 高血压史作为SAH的危险因素(RR 2.5,OR 2.6),与其他卒中类型相比,没有那么关键。SAH患者中高血压的患病率(20%~45%)较普通人群稍高;校正年龄、性别、吸烟和酗酒等因素后,两项病例对照研究显示,高血压病史不会显著增加SAH风险。但是,结合所有队列研究和病例对照研究结果,高血压仍是一项重要的危险因素。
在一项长期队列研究中,高血压患者较非高血压患者再发动脉瘤和动脉瘤生长的风险并没有显著增加,随访中也没有发现血压值与动脉瘤形成或增长相关。但高血压患者使用降压药物可能降低动脉瘤形成的风险。而另一项长期随访研究发现,首发SAH时,高血压会增加动脉瘤再发的风险。
说明
高血压是SAH的重要危险因素,同时可能是动脉瘤形成和致命性动脉瘤破裂的危险因素。
吸烟是影响动脉瘤形成、生长和破裂的最重要的可干预危险因素,应鼓励戒烟。
酗酒,特别是突然大量饮酒,是动脉瘤破裂的危险因素,应制止酗酒(Ⅲ类证据,C级推荐)。
2.3.4 家族史 近来的研究认为颅内动脉瘤家族史是颅内动脉瘤的遗传病因。但是,明确这种相关性前应先排除吸烟和其他与健康有关的习惯作为混杂因素被分析,因为这些习惯在家庭成员间的相关性会高于一般人群。吸烟和饮酒习惯甚至可能在某种程度上是受遗传因素影响的。部分家族的高发病率也可能归因于家族性高血压。
不到10%的SAH患者仅有一级亲属罹患该病,5%~8%的一级或二级亲属罹患。同时,许多研究表明,大约10%的SAH患者有家族史。如果有2个或2个以上一级亲属发生SAH,通过筛查发现动脉瘤的概率大约为10%。多囊肾家族史似乎增加患SAH的风险。
推荐
如果仅有1位一级亲属发生SAH,一般不推荐进行筛查。
如果有2位及2位以上一级亲属发生SAH,其他亲属发生SAH的风险明显增加,可以考虑进行筛查(Ⅲ类证据,C级推荐)。
2.3.5 其他危险因素 除了上述危险因素,很多其他因素与囊状动脉瘤和SAH的发病机制相关。其中,非白种人的SAH风险更高,而女性的激素替代治疗、高胆固醇血症、糖尿病可能减少SAH风险。根据最近的一项系统回顾,口服避孕药似乎不会影响SAH风险,而低体重指数或大量运动与SAH发生风险的结论似乎并不一致。其中,低水平的血清总胆固醇和甘油三酯水平可能是独立于吸烟和高血压的SAH危险因素。
经过治疗的动脉瘤破裂患者再形成动脉瘤的概率每年为0.6%~0.9%。血管造影随访研究通过所有幸存者的随访,不应仅针对那些SAH复发的患者,否则这种选择性偏倚会增加再发动脉瘤的发生率。女性和吸烟是动脉瘤再发的独立危险因素(OR 4~5)。动脉瘤再发的平均随访时间为19年,与没有再发动脉瘤患者的随访时间无差异。再发动脉瘤引起SAH,其随访时间相对短一些[(14.7±8.1)年;范围3.4~28.4年]。
磁共振血管成像(magnetic resonance angiography,MRA)随访610例SAH患者,平均随访9年,发现新动脉瘤的累积发生概率为16%。在这项研究中,动脉瘤形成和增长的危险因素为发生SAH时同时存在多个动脉瘤[(危险比(hazard ratio,HR)3.2;95%CI 1.2~8.6)]、正在吸烟(HR 3.8;95%CI 1.5~9.4)和高血压(HR 2.3;95%CI 1.1~4.9)。
752例SAH患者6016个随访年(平均随访8.0年),发现18例患者SAH复发。在首次SAH后的第1个10年,累积SAH复发率是3.2%(95%CI 1.5%~4.9%),其发病率为每年286/100 000(95%CI 160/100 000~472/100 000)。危险因素包括吸烟(HR 6.5;95%CI 1.7~24.0)、年龄(每10年,HR 0.5;95%CI 0.3~0.8)和首次S A H时存在多个动脉瘤(H R 5.5;95%CI 2.2~14.1)。因此,SAH后第1个10年的复发风险为相同年龄和性别正常人群预期发病率的22(12~38)倍。这种风险增加是否表明有SAH病史的患者需要筛查复发动脉瘤,还需进一步的研究。
危险因素说明
SAH的危险因素可以分为动脉瘤形成、生长和破裂。
SAH最重要的可控制的危险因素:吸烟、高血压和酗酒;不可控制因素:性别、年龄、动脉瘤大小和家族史。
动脉瘤形成的危险因素:女性、正在吸烟、高血压、年龄(诊断时)和家族史。
动脉瘤增长的危险因素:正在吸烟。
2.4 诊断 SAH发病当天通过颅脑CT检查发现典型的分布于蛛网膜下腔/基底池的血液即可诊断。因此,如果临床怀疑SAH可以通过颅脑CT确诊。现代CT技术在SAH早期即可敏感检测到位于蛛网膜下腔的血液。但是首发SAH后,随着时间的推移,由于蛛网膜下腔内血液的吸收和重新分布,CT的敏感度随之下降:SAH发病5 d后为85%,而2周后则<30%。MRI-液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)技术早期发现SAH的能力与颅脑CT基本相当。且在SAH随后的几周,颅脑MRI明显优于CT,而且是动脉瘤血管内治疗后随访的可靠方法。行动脉瘤夹闭术后,由于金属的影响,MRI的诊断价值下降。对于既往或临床疑似SAH的病例,CT和(或)MRI检查结果为阴性或不典型,应行腰椎穿刺以进一步明确。清亮且正常的CSF可以排除在过去2~3周内发生SAH的可能。如果为血性CSF,需除外创伤性SAH可能。如果发现由于红细胞降解引起脑脊液黄变较血性CSF更能明确诊断SAH,但特异性较差。由于红细胞降解需要几小时,所以一般推荐SAH发病后6~12 h行腰椎穿刺检查。
全脑血管造影仍然是发现、证实和定位破裂动脉瘤的金标准。在经验丰富的医疗中心,这种侵入性诊断检查的并发症低于0.5%。进一步的非侵入性的检查方法为MRA和计算机断层扫描血管成像(computed tomography angiography,CTA)。MRA是一项安全的检查,据报道敏感性较数字减影血管造影[(digital substraction angiography,DSA),一种传统血管造影]差,且不适合躁动或SAH后急性期需要密切监护的患者。CTA检查较MRA检查耗时短。CTA发现颅内动脉瘤的敏感性和特异性分别是0.77~0.97和0.87~1.00。然而,敏感性随动脉瘤变小而降低:对于小动脉瘤(<3 mm),CTA的敏感性为0.4~0.9。MRA也有类似敏感性降低的报道和观察。未来进一步提高CTA和MRA技术,可以降低DSA的使用率。Agid等的近期研究表明,CTA通过特殊的CT模式显示蛛网膜下腔内血液分布的特点,效果与DSA相仿。
关于诊断的推荐
CT/CTA和多序列MRI都适用于诊断发病24 h内的SAH(Ⅱ类证据,B级推荐)。
CT/CTA和多序列MRI/MRA可以明确SAH潜在的病因。
对于临床疑似SAH的病例,如果CT和(或)MRI不能确诊,应行腰椎穿刺以进一步明确诊断;但SAH发病后6~12 h内腰椎穿刺检查难以鉴别真性SAH和创伤引起的出血。
如果患者CT检查表现为典型的SAH,但CTA未发现责任病灶,则需进行全脑动脉DSA检查(Ⅱ类证据,B级推荐)。
如果没有发现动脉瘤,需要复查CTA或DSA,这类患者描述为未发现动脉瘤的SAH(Ⅲ类证据,C级推荐)。
2.5 治疗
2.5.1 一般内科治疗
监护和内科治疗
监护和一般治疗的推荐总结见表2。患者应在重症监护室,或中级卒中或血管神经病中心进行持续监护。肺炎是影响SAH预后的常见独立危险因素,监护单元的成员应具有评估吞咽功能及预防肺炎的丰富经验。应至少在SAH后的前7 d监测患者心电图、意识水平(GCS评分)、局灶性神经功能缺损的症状体征、体温和瞳孔,或根据患者的临床情况监测更长时间。建议对所有患者保留导尿,同时在最初的1周内应每6 h计算一次液体平衡情况。在重症监护室,应通过动脉内置管连续监测患者血压。动脉瘤经过治疗且临床状态良好的患者,可以考虑转入卒中单元的普通病房继续治疗。

表2 动脉瘤性SAH患者的监护和一般内科治疗推荐
有时可以使用作用效果缓和的止痛药如对乙酰氨基酚(扑热息痛)治疗头痛;由于患者可能需要行脑室外引流或神经外科治疗,水杨酸类的抗栓作用不利于这类操作,故最好避免使用此类药物。在临床实践中,患者疼痛常常很严重,可能需要使用可待因,甚至合成的阿片制剂。
内科治疗说明
为避免引起颅内压增高,患者应该卧床休息,动脉瘤处理前可考虑使用止吐药、通便药和止痛药(GCP)。
血糖
约1/3的SAH患者出现高血糖。入院时的临床情况差与高血糖相关,也是不良预后的独立危险因素。纠正高血糖是否会改善预后仍不明确。一项小规模临床试验比较了强化和常规
胰岛素治疗的作用,结果显示强化治疗降低了入院后14 d内的感染率。但这项临床试验病例数太少,没能显示强化治疗在改善患者预后方面存在显著性差异(Ⅲ类证据,C级推荐)。
血糖管理推荐
血糖高于10 mmol/L时需要进行处理(GCP)。
体温
尽管使用对乙酰氨基酚可以减轻疼痛,仍有超过半数的SAH患者出现发热,主要为入院时临床情况差和出血破入脑室的患者。此外,发热是不良预后的独立危险因素。约20%的患者没有发现感染源,发热由血液进入蛛网膜下腔引起的炎症反应引起。目前缺乏对照研究证明降温对SAH患者的作用,也没有相关研究证实控制发热可以改善SAH患者的预后。一项临床随机试验提示SAH后术中保持轻度低温(33℃)不能改善预后。
体温管理推荐
体温升高时需进行药物和物理降温治疗(GCP)。
血压
由于缺少随机临床试验证据,SAH后的血压管理仍有争议。观察性研究的数据表明,强化降压可能降低再出血的风险,但是增加继发性缺血的风险。除非血压极度升高,停止使用所有降压药物似乎是合理的,但缺乏相关证据。因为不同患者的年龄、既往血压情况、心脏病史和其他因素各不相同,故定义“血压极度升高”非常困难,需进行个体化考虑。对于未治疗的动脉瘤患者,如果收缩压高于180 mmHg应该考虑降压治疗,可使用艾司洛尔或拉贝洛尔;适当降低平均动脉压(如降低25%)似乎是合理的。
血压管理推荐
进行夹闭术或栓塞术前,收缩压应维持在180 mmHg以下;使用止痛药和尼莫地平可能就已达标(GCP)。
如果使用上述方法后收缩压仍高,则需要进行进一步降压治疗(Ⅳ类证据,C级推荐)。
如果血压降低,平均动脉压应维持在至少90 mmHg以上(GCP)。
预防血栓形成
在一项安慰剂对照试验中,动脉瘤术后进行皮下注射依诺肝素(一种低分子肝素)40 mg/d,结果显示依诺肝素组颅内出血风险相对稍高,但对预后和SAH后继发梗死没有显著影响。对脑肿瘤患者,术前使用依诺肝素预防下肢静脉血栓也会增加术后颅内出血的风险。
由于使用低分子肝素预防血栓形成会增加颅内出血风险,所以SAH患者使用弹力袜或气囊间歇加压装置(血栓泵)等来预防血栓形成似乎更合理。一项非随机对照试验提示使用气囊间歇加压装置可以有效预防深静脉血栓形成。一篇对卒中患者使用弹力袜或气囊间歇加压装置的Cochrane综述没有发现支持使用任一种方法的证据。一项颅内出血(intracerebral haemorrhage,ICH)的随机试验显示,弹力袜和气囊间歇加压装置组合较单独使用弹力袜可以更有效地预防深静脉血栓形成。这种组合治疗可能是首选策略,但由于没有证据证明其使SAH患者获益,故仍需要进一步研究。
血栓预防管理推荐
SAH患者在动脉瘤治疗前可以考虑给予弹力袜和(或)气囊间歇加压装置(血栓泵)来预防血栓形成(Ⅱ类证据,B级推荐)。
当有预防下肢深静脉血栓形成的指征时,低分子肝素的使用不应早于动脉瘤外科夹闭术后12 h,栓塞术后可以考虑立即使用(Ⅱ类证据,B级推荐)。
预防癫痫治疗
7%的患者在发病时出现癫痫发作,但其对预后的影响目前还不明确。另外10%的患者在发病后最初几周内出现癫痫,0.2%的患者出现惊厥性癫痫持续状态。发现8%的昏迷患者出现非惊厥性癫痫持续状态,但这个比例可能由于选择符合脑电图(eletroencephalography,EEG)适应证的患者检查而被高估。是否应对所有SAH或昏迷患者进行连续EEG监测尚不明确。一项回顾性研究提示,持续EEG监测可以预测不良预后,但是没有数据显示连续EEG监测可以改善患者预后。101例昏迷患者接受连续EEG监测,发现8例存在非惊厥性癫痫持续状态,其中仅1例患者抗癫痫治疗后短暂好转,最终8例患者全部死亡。因为长时间的EEG监测价格昂贵,耗费人力,容易误导判断,且缺乏有效性的证据,因此没有依据将EEG监测作为SAH患者常规监测的一部分。目前尚无预测癫痫发作的方法。颅内手术增加癫痫风险,一项幕上开颅手术治疗良性病变(不仅包括动脉瘤)后预防性使用抗癫痫药物的随机试验,收集了276例患者,尽管可信区间较宽,但癫痫的发病率或病死率未降低。同时,一项纳入了4项前瞻性、随机、双盲、安慰剂-对照试验进行的观察性研究收录了3552例患者,结果发现其中接受预防性抗癫痫药物的患者中65%的患者较其他未接受预防性抗癫痫药物的患者(35%)预后更差。由于缺乏证据支持预防性抗癫痫治疗,同时预防性使用抗癫痫药物可能带来的严重药物不良反应,目前不建议预防性使用抗癫痫药物。
癫痫管理的推荐
临床出现相关症状的患者可以使用抗癫痫药物(GCP)。没有证据支持预防性使用抗癫痫药物(Ⅳ类证据,C级推荐)。
激素
一篇2005年更新的Cochrane综述包括一项关于SAH患者使用氢化可的松的安慰剂-对照试验。对于继发性脑梗死患者,氢化可的松治疗组和安慰剂组的预后差异无显著性,但高血糖的风险几乎增加1倍。该Cochrane综述发表后发表的一项随机试验表明,接受氢化可的松治疗的患者,其血钠水平和血浆渗透压较对照组更容易控制,但临床预后没有改善。基于这些研究,不推荐SAH患者常规使用氢化可的松治疗。
激素使用的说明
没有证据证明激素对治疗SAH有效(Ⅳ类证据,C级推荐)。
