四种黄酮类化合物与牛血清白蛋白相互作用的光谱分析
2014-03-07薛春霞董社英
薛春霞,董社英
(1.华中农业大学楚天学院,湖北武汉 430205; 2.西安建筑科技大学,陕西西安 710055)
四种黄酮类化合物与牛血清白蛋白相互作用的光谱分析
薛春霞1*,董社英2
(1.华中农业大学楚天学院,湖北武汉 430205; 2.西安建筑科技大学,陕西西安 710055)
在人体生理pH条件下,利用紫外吸收光谱和荧光光谱研究了槲皮素(QUE)、大豆甙元(DAI)、4′,7-二甲氧基-3′-异黄酮磺酸钠(DISS)和3′-大豆甙元磺酸钠(DSS)四种黄酮类化合物与牛血清白蛋白(BSA)的相互作用,结合反应机理对其进行了初步探讨;并计算了结合位点数和结合常数.紫外吸收光谱分析结果表明,在pH=7.4条件下,黄酮类化合物中疏水性的苯环与BSA疏水腔中的氨基酸残基发生作用,从而导致药物分子的吸收峰红移,用Scatchard拟合法可求得DAI及DSS与BSA的结合常数.荧光光谱分析结果表明,BSA对DAI、DISS和DSS均有明显的敏化增强效应,计算得到的增强速率常数分别为1.39×1011,7.72×1011和1.93×1012L·s-1·mol-1,并可求得结合位点数和结合常数.
BSA;QUE;DAI;DISS;DSS;相互作用;紫外吸收光谱;荧光光谱
黄酮类化合物是广泛分布在植物中的一类化合物,具有多种生理功能和药用价值[1-3].槲皮素(QUE)是一种天然黄酮类化合物,具有祛痰、平喘、降血压、减小毛细管脆性、降血脂、扩张冠状动脉等重要生理作用,是目前已知的较强抗癌剂之一[4-6].大豆甙元(DAI)及其衍生物属于异黄酮类化合物,具有防治肿瘤发生,提高机体免疫能力,抗炎、降低胆固醇等功能 .对大豆甙元进行结构修饰及改性可以合成出新的强水溶性的4′,7-二甲氧基-3′-异黄酮磺酸钠(DISS)和3′-大豆甙元磺酸钠(DSS)[8].本文研究的四种黄酮类化合物结构式如图1所示,黄酮类化合物能够与蛋白质或其他生物大分子发生特异性结合,进而调节它们的结构和功能并发挥其药理作用.采用紫外光谱(UV)和荧光光谱(FS)考察了QUE、DAI在不同pH下的存在状态;在此基础上,从药物小分子结构的角度探讨了在pH=7.4条件下,QUE、DAI、DISS、DSS四种黄酮类化合物与BSA的相互作用,这对于阐明药物的运输过程及其在体内的作用机制具有一定的意义,为药物合成、临床用药提供了基础数据.

图1 QUE(a)、DAI(b)、DISS(c)和DSS(d)的结构式Fig.1 Chemical structures of QUE(a),DAI(b),DISS(c)and DSS(d)
1 实验部分
1.1 仪器和试剂
960MC型荧光分光光度计(上海精密仪器有限公司);Nicolet Evolution 300型紫外-可见分光光度计(英国Thermo公司);IX-501A型pH计(北京大学化学系);Z-SJ60-4电子分析天平(沈阳龙腾电子秤量仪器有限公司).
BSA(上海国药集团化学试剂有限公司),相对分子质量以67 000计.1.0×10-4mol/L标准储备溶液:准确称取0.167 5g BSA,用0.1mol·L-1的NaCl水溶液溶解并定容至25mL,4℃下放入冰箱保存,用时适当稀释;QUE(陕西武功制药厂)、DAI(陕西武功制药厂)、DISS和DSS(均由陕西师范大学化学与材料科学学院合成)的2.0×10-3mol/L标准储备溶液,用时适当稀释;0.02mol/L,pH=7.4的NaH2PO4-Na2HPO4缓冲溶液;所用其他试剂均为分析纯,实验用水为二次蒸馏水.
1.2 实验方法
1.2.1 紫外光谱测定
将一定量的黄酮类化合物与BSA溶液依次加入到10mL比色管中,以0.02mol·L-1,pH=7.4的NaH2PO4-Na2HPO4缓冲溶液稀释至刻度,振荡均匀,放置15min.用相应的缓冲溶液体系作参比,在190~450nm波长范围内,分别测定黄酮类化合物及其与BSA混合溶液的紫外吸收光谱图.
1.2.2 荧光光谱测定
设定激发波长为365nm,扫描范围为400~600nm,激发狭缝宽为10nm,分别测定黄酮类化合物与一系列不同浓度的BSA混合溶液在0.02mol·L-1,pH=7.4的NaH2PO4-Na2HPO4缓冲体系中的荧光发射光谱图.
2 结果与讨论
2.1 四种黄酮类化合物与BSA结合的紫外吸收光谱
2.1.1 pH对QUE、DAI结构的影响
图2为pH对QUE、DAI紫外吸收光谱的影响.黄酮类化合物的紫外光谱通常有两个吸收带,吸收带Ⅰ位于290~380nm,是分子中C环和B环上的羰基共轭体系的紫外吸收,位于240~280nm的吸收带Ⅱ是A环与C环上羰基共轭体系的紫外吸收 .

图2 pH对QUE(a)、DAI(b)紫外吸收光谱的影响Fig.2 The effect of pH value on the ultraviolet spectra of QUE(a)and DAI(b)
QUE分子A环上7-位的酚羟基与C环上的羰基处于同一个共轭体系的对位,具有较强的酸性,在弱碱性缓冲溶液中易发生解离成为阴离子[10].7-位羟基的解离使其所在共轭体系的紫外吸收光谱谱带发生明显红移.310nm处的吸收峰的强度随pH的增加逐渐增加,而379nm处吸收带的强度则逐渐减弱,说明310nm处吸收带的强度代表着分子的解离程度.在pH=7.4时,310nm处的中等吸收带显示QUE是中性分子和离子型分子共存的混合物.对于DAI,同样由于7-位羟基的解离使吸收带Ⅰ、吸收带Ⅱ的强度都随pH的增加逐渐增强.335nm处的吸收带在pH=7.4时才逐渐增大,代表着7-位的酚羟基分子的解离程度.结果表明,pH=7.4时,335nm处的中等吸收带显示DAI是中性分子和离子型分子共存的混合物.
2.1.2 QUE、DAI、DISS、DSS与BSA相互作用的紫外光谱
图3为在pH=7.4生理条件下,四种黄酮类化合物与BSA相互作用的紫外吸收光谱图.固定药物的浓度,加入一系列不同浓度的BSA,随着BSA加入量的增大,药物分子的吸收带Ⅰ几乎不随BSA浓度的改变而发生明显变化;而吸收带Ⅱ的吸收峰强度有规律地增强并且峰位略微红移,说明这四种黄酮类化合物与BSA之间发生了相互作用,同时也说明它们的相互作用使该共轭体系的能级发生了明显的变化.这是由于黄酮类化合物中苯环的疏水性使其与BSA疏水腔中的氨基酸残基发生作用[11],从而导致药物分子的吸收峰红移.
图4为不同浓度BSA对药物分子QUE、DAI、DISS、DSS中吸收带Ⅰ、吸收带Ⅱ的影响.从图中可以看出BSA对药物分子吸收带Ⅱ呈现明显的增色效应,而对吸收带Ⅰ的影响比较微弱.据此说明四种黄酮类化合物与BSA相互作用时,主要是C环和A环上的羰基共轭体系与BSA的氨基酸残基发生了相互作用.
2.1.3 DAI、DSS与BSA相互作用的结合常数
根据Scatchard模型方程[12]:

式中ΔA表示加入BSA前后黄酮类化合物溶液吸光度的差值,cBSA、cL分别表示BSA和黄酮类化合物的浓度.根据式(1)的ΔA对ΔA/cBSA作图,由拟合直线的斜率可得结合常数K.除DISS明显不能满足Scatchard拟合外,其他拟合的线性程度很高,DAI的ΔA和ΔA/cBSA关系如图5所示.DAI与BSA作用可以用(1)式在较低浓度和较高浓度回归出两条曲线,其线性回归方程分别为y=0.051 89+0.678 4x,r=0.999和y=0.176 5+0.017 39x,r均为0.999.据此求得较低浓度和较高浓度的结合常数分别为1.47×105和5.75×106L·mol-1.同样方法求得DSS与BSA的结合常数为3.59×105L·mol-1.
2.2 DAI、DISS、DSS与BSA结合的荧光特性
图6为在激发波长为365nm下,不同浓度的蛋白质对DAI,DISS和DSS分子的荧光光谱的影响.BSA在400~600nm范围内没有荧光发射信号,对该荧光加强图没有干扰.随着BSA浓度的逐渐增加,DAI、DISS和DSS的荧光发射峰强度有规律的增强,但是荧光发射峰的峰位几乎没有发生明显变化,表明BSA均能够与DAI、DISS、DSS发生相互作用进而敏化增强药物分子的内源荧光[13].
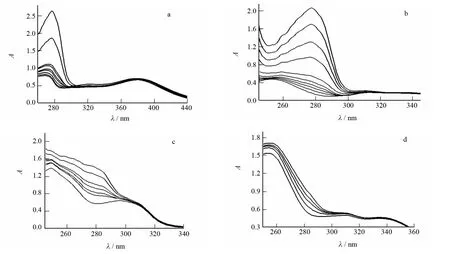
图3 QUE(a)、DAI(b)、DISS(c)和DSS(d)对BSA紫外吸收光谱的影响Fig.3 Effects of QUE(a),DAI(b),DISS(c)and DSS(d)on the absorption spectra of BSA

图4 BSA的浓度对QUE(a)、DAI(b)、DISS(c)和DSS(d)吸光度值的影响Fig.4 Influences of the concentration of BSA on the spectra of QUE(a),DAI(b),DISS(c)and DSS(d)
2.2.1 荧光敏化加强过程速率常数
根据荧光动态猝灭理论的Stern-Volmer方程[14],修改后作为荧光敏化加强理论公式:
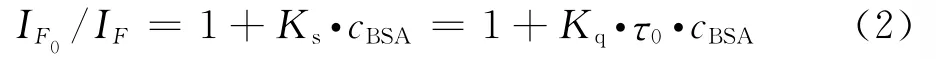
其中IF0和IF分别表示加和未加增强剂时体系的荧光强度,Kq为双分子增强过程速率常数,Ks为动态速率常数,τ0为增强剂不存在时荧光分子平均寿命,cBSA为BSA的浓度.根据实验数据,对于DAI-BSA,DISS-BSA,DSS-BSA体系,IF0/IF与cBSA均呈现良好的线性关系(见图7),由直线斜率可得DAI、DISS、DSS的增强速率常数Kq分别为1.39×1011,7.72×1011和1.93×1012L·s-1·mol-1.

图5 DAI的ΔA和ΔA/cBSA关系图Fig.5 Relationships betweenΔAandΔA/cBSAof DAI
2.2.2 结合位点数及结合常数的求解
根据静态猝灭过程理论公式[15-16],修改后得:

式中IF0和IF分别表示加和未加增强剂时体系的荧光强度.固定药物的总浓度,改变蛋白质的浓度cBSA,以lg[(IF-IF0)/IF]对lgcBSA作图可得一条直线.实验发现DAI-BSA,DISS-BSA,DSS-BSA体系中,lg[(IFIF0)/IF]对lgcBSA作图均呈现良好的线性关系(见图8),由各直线的斜率和截距可以分别计算得到DAI、DISS、DSS与BSA相互作用的结合位点数n和结合常数K(见表1).从表1中可以看出K值呈现增加趋势,结合位点数也呈现递增趋势,表明三种药物分子与BSA之间存在相互作用,能被BSA所贮运.
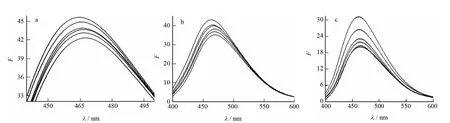
图6 BSA对DAI(a)、DISS(b)、DSS(c)荧光光谱的影响Fig.6 Effects of DAI(a),DISS(b)and DSS(c)on the fluorescence spectra of BSA

图7 DAI-BSA(1),DISS-BSA(2),DSS-BSA(3)体系的Stern-Volmer方程拟合图Fig.7 The Stern-Volmer plots of DAI-BSA(1),DISS-BSA(2)and DSS-BSA(3)systems
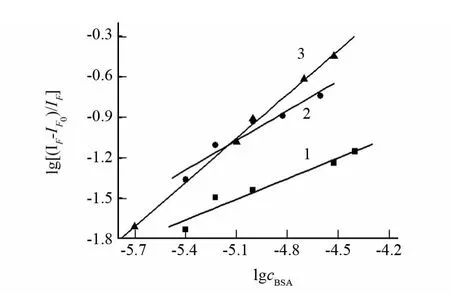
图8 lg[(IF-IF0)/IF]与lgcBSA的关系图Fig.8 Plots of lg[(IF-IF0)/IF]vs.lgcBSAfor DAI(1)、DISS(2)、DSS(3)

表1 药物分子与牛血清白蛋白的结合常数及结合位点数Table 1 The binding constants and binding sites of the drugs and BSA
3 结论
以黄酮类化合物为基体,利用紫外吸收光谱和荧光光谱比较详尽地研究了BSA对QUE、DAI、DISS和DSS四种体系的影响,从药物小分子结构的角度探讨了药物-蛋白质作用.紫外吸收光谱测试结果表明,BSA对QUE、DAI、DISS和DSS均有明显的增色效应,且药物分子进入蛋白质分子中的疏水性氨基酸残基之间通过疏水作用聚集在一起构成疏水腔,药物小分子中苯环的疏水性使其与疏水腔中的氨基酸残基发生作用;荧光光谱测试结果表明,BSA对DAI、DISS和DSS均有明显的敏化增强效应,计算得到增强速率常数Kq分别为1.39×1011,7.72×1011和1.93×1012L·s-1·mol-1.
[1]孙庆雷,王晓,刘建华,等.黄酮类化合物抗氧化反应性的构效关系[J].食品科学,2005,26(4):69-73.
[2]范攀越,王江,黄远,等.一种黄酮类衍生物的合成及其体外抗癌活性[J].化学研究,2013,24(1):68-70.
[3]王秋亚,王烨娟,高锦红.白杨素衍生物的合成及生理活性研究进展[J].化学研究,2011,22(1):96-110.
[4]康敬万,卓琳,卢小泉,等.槲皮素与DNA的电化学作用研究[J].西北师范大学学报:自然科学版,2003,39(4):57-61.
[5]程玲玲,孙希孟,郭九吉,等.多元分辨-交替最小二乘法研究Cu2+与槲皮素的相互作用[J].河南大学学报:自然科学版,2011,41(6):588-591.
[6]渠文涛,朱玮,翟广玉,等.槲皮素衍生物的合成及生物活性研究进展[J].化学研究,2012,23(4):101-110.
[7]董社英,郑建斌,高鸿.3′-大豆甙元磺酸钠的电化学行为及应用研究[J].化学学报,2003,61(4):487-494.
[8]郑建斌,董社英,延绥宏,等.4′,7-二甲氧基-3′-异黄酮磺酸钠的电化学行为研究[J].化学学报,2004,62(11):1071-1074.
[9]黄量,于德泉.紫外光谱在有机化学中的应用(下册)[M].北京:科学出版社,2000:281.
[10]张红雨.黄酮类抗氧化剂结构-活性关系的理论解释[J].中国科学(B辑),1999,29(1):91-96.
[11]谢孟峡,徐晓云,王英典,等.4′,5,7-三羟基二氢黄酮与人血清白蛋白相互作用光谱学研究[J].化学学报,2005,63(22):2055-2062.
[12]何梅,夏之宁,阴永光,等.紫外光谱研究中药大黄有效成分与牛血清白蛋白的相互作用[J].中国现代应用药学杂志,2004,21(6):429-432.
[13]杨曼曼,席小莉,杨 频.用荧光猝灭和荧光加强两种理论研究喹诺酮新药与白蛋白的作用[J].高等学校化学学报,2006,27(4):687-691.
[14]SILVA D,CORTEZ C M,LOURO S R.Chlorpromazine interactions to sera albumins.A study by the quenching of fluorescence[J].Spectrochim Acta A:Mol Biomol Spectrosc,2004,60(5):1215-1223.
[15]BI Shuyun,SONG Daqian,TIAN Yuan,et al.Molecular spectroscopic study on the interaction of tetracyclines with serum albumins[J].Spectrochim Acta A:Mol Biomol Spectrosc,2005,61(4):629-636.
[16]李桂芝,刘永明,虢新运,等.荧光法研究盐酸拓扑替康、盐酸依利替康喜树碱类药物和牛血清白蛋白的相互作用[J].化学学报,2006,64(7):679-685.
Spectroscopic analysis of interaction between four kinds of flavonoids and bovine serum albumin
XUE Chunxia1*,DONG Sheying2
(1.ChutianCollege,HuazhongAgriculturalUniversity,Wuhan430205,Hubei,China;2.Xi′anUniversityofArchitectureandTechnology,Xi′an710055,Shaanxi,China)
The interactions of quercetin(QUE),daidzein(DAI),4′,7-dimethoxy-3′-isoflavone sulfonic sodium(DISS),and 3′-daidzein sulfonic sodium(DSS)with BSA under human body physiological pH value were investigated using ultraviolet(UV)absorption spectrometry and fluorescence spectrometry.The binding mechanism was primarily discussed;and the number of binding sites and binding constants were calculated.UV absorption spectroscopic analysis results indicate that,under physiological pH value of 7.4,the hydrophobic benzene rings of flavonoids interact with the amino acid residues of BSA hydrophobic cavity thereby resulting in red shift of the absorption peak of drug molecules;and the binding constants of DAI and DSS with BSA can be calculated by Scatchard fitting method.Besides,the fluorescence spectroscopic analysis results indicate that BSA can significantly enhance the sensitization of DAI,DISS and DSS.The enhance rate constants are calculated to be 1.39×1011,7.72×1011and 1.93×1012L·s-1·mol-1,while the number of binding sites and binding constants can also be calculated.
BSA;QUE;DAI;DISS;DSS;interaction;UV absorption spectrometry;fluorescence spectrometry
O 657.3
A
1008-1011(2014)02-0152-06
2013-09-23.
陕西省自然科学基础研究基金(2005B28)、陕西省教育厅专项科研基金(05JK228).
薛春霞(1981-),女,讲师,主要从事电分析、光谱分析研究.*
,E-mail:xuecx163@163.com.
