发酵酸菜中鼠李糖乳杆菌的分离及其生物活性
2014-03-07周鲜娇饶颖竹黄婷娟
周鲜娇,饶颖竹,*,黄婷娟,陈 蓉
(1.岭南师范学院生命科学与技术学院,广东湛江 524048;2.岭南师范学院应用生物技术研究所,广东湛江 524048)
发酵酸菜中鼠李糖乳杆菌的分离及其生物活性
周鲜娇1,2,饶颖竹1,2,*,黄婷娟1,陈 蓉1,2
(1.岭南师范学院生命科学与技术学院,广东湛江 524048;2.岭南师范学院应用生物技术研究所,广东湛江 524048)
从自然发酵酸菜中分离出20株菌,经革兰氏染色后得到12株革兰氏阳性菌,对这12株菌进行形态学特征的观察、室温下产酸速率的测定以及乳酸定性后筛选出7株高产乳酸的乳杆菌,运用经典分类法对这7株高产乳酸菌株进行生理生化实验鉴定,初步鉴定该7株菌均为鼠李糖乳杆菌(Lactobacillus rhamnosus)。通过牛津杯法研究该7菌株抑菌效果;通过对羟自由基、DPPH自由基和超氧阴离子自由基的清除效果来检测该7株菌的抗氧化性。结果表明,除了LR6菌发酵液对枯草杆菌无抑菌效果外,该7株菌对大肠杆菌,金黄色葡萄球菌,苏云菌杆菌均有抑菌作用,其他6株菌对枯草杆菌也有明显的抑菌效果;在抗氧化性方面,该7株菌的发酵液对羟自由基、DPPH自由基和超氧阴离子自由基具有明显清除作用,抗氧化效果显著。
酸菜,乳酸菌,抑菌,氧化性
乳酸菌(Lactic acid bacteria,LAB)是一类能利用可发酵糖产生大量乳酸的细菌统称[1],乳酸可分为L-乳酸、D-乳酸和DL-乳酸,而人体内只有L-乳酸脱氢酶,因此只能利用L-乳酸,WTO规定3月以下的婴儿食品中不能含有D型和DL型乳酸,而且成人每日摄入D型乳酸量不超过100mg/kg[2]。而鼠李糖乳杆菌LGG发酵过程中只产生L-乳酸,不会产生其他酸类[3],因此鼠李糖乳杆菌应用到食品中发酵具有非常重要的安全意义。鼠李糖乳杆菌(Lactobacillus rhamnosus)最初是在20世纪80年代,由两位美国科学家Sherwood Gorbach 和Barry Goldin在健康人体肠道中分离得到并 命 名 为 鼠 李 糖 乳 杆 菌(Lactobacillusrhamnosus)[4],它已流行于全球30多个国家,是目前全球研究最多的益生菌之一。近年来,大量的体外实验、动物实验、人体临床实验和流行病学调查研究充分证明了鼠李糖乳杆菌的安全性和功能性[5]。它具有调节肠道的微生态平衡[6],缓解腹泻[7];定植肠道,增强胃肠道粘膜的屏障功能[8-9];激活免疫系统,增强免疫能力[10];消减体内毒素[11];抑制肠道中有害菌群的滋生[12];预防龋齿[13]和其他有益的生理功能如能够治疗花粉过敏并加速过敏后的恢复、预防便秘、治疗急性肠炎等益生作用。因此开发鼠李糖乳杆菌在益生菌的利用方面具有广阔的应用前景。
本实验从家用自然发酵的泡菜汁中采样,分离出7株产酸速率高的乳酸菌,并对这7株乳酸菌进行了初步鉴定,对该7株菌的抑菌效果和抗氧化性进行了深入研究,为人工控制发酵酸菜提供了更多的优良菌种,开发出更多具有重要意义的益生菌。
1 材料与方法
1.1 材料与仪器
酸菜汁 从自制自然发酵好的酸菜汁取样;乳酸菌微量生化鉴定试剂盒和鼠李糖发酵管 浙江省杭州天和微生物试剂有限公司;硫化氢和硝酸盐还原实验单盒生化鉴定管 广州环凯微生物科技有限公司;甲酸、对二甲基氨基苯甲醛、正丁醇、标准乳酸、D-木糖、乳糖、D-半乳糖、无水乙醚、邻苯三酚、邻二氮菲、30%H2O2、氯化钠、浓硫酸、硫酸亚铁等试剂 均为分析纯;1.1-二苯基-2-苦基自由基 梯希爱上海化成工业发展有限公司;大肠杆菌、苏云菌杆菌、金黄色葡萄球菌和枯草杆菌 本实验室保存;LB培养基[14],MRS培养基[1,15]。
BW-228WBSV冷冻冷藏箱 青海海尔股份有限公司;LXJ-IIB飞鸽牌系列离心机 上海安亭科学仪器厂;FC104电子天平 上海精密科学仪器有限公司;智能HZQ-FX全温振荡培养箱 中国哈尔滨市东联电子技术开发有限公司;Rowsen PSH-200生化培养箱 中科生命科技股份有限公司;PHSJ-5 pH计上海雷磁仪器厂;微量移液器 北京青云卓立精密设备有限公司;SW-CJ-1FD单人单面净化工作台 苏州净化设备有限公司;立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;LGJ18真空冷冻干燥机 北京四环仪器厂。
1.2 菌株的分离
1.2.1 乳酸菌的富集 按接种量10%将酸菜汁接入MRS液体培养基中,37℃培养48h,连续增殖2~3次。
1.2.2 乳酸菌的初筛 无菌操作下,用移液枪吸取1mL富集液,使用10倍梯度稀释混菌法(选择10-3~10-6四个适宜稀释度的菌液各0.1mL)加入到培养皿中,采用倾注平板法加入已灭菌并冷却至40℃的含2% CaCO3的MRS固体培养基,摇匀后于37℃倒置培养48h;挑取各培养基中溶钙圈较大、长势较好的单个疑似菌落进一步在MRS固体平板上反复划线、纯化,直到长出的单菌落大小一致,斜面保存于4℃,备用。
1.2.3 复筛 将所得到的菌株进行接触酶反应和革兰氏染色,挑取接触酶阴性菌株和革兰氏染色阳性的菌,记录好菌株编号。
1.2.4 发酵液中乳酸的定性分析 纸层析法[16]。
1.2.5 不同菌株产酸速率的测定 将不同菌株同时发酵培养,用pH计分别每隔2h测得发酵液的pH。
1.3 菌株的鉴定
1.3.1 形态观察 将初步分离纯化后得到的各菌株转接到MRS固体平板中进行活化,37℃培养48h,观察菌落形态,从固体平板上取菌体,进行革兰氏染色及观察。
1.3.2 生理生化特征观察 参照《常见细菌系统鉴定手册》[17]和凌代文[1]《乳酸细菌分类鉴定及实验方法》方法进行。
1.4 生物活性的测定
1.4.1 抑制细菌 采用牛津杯法,检测七株乳酸菌对供试细菌枯草芽胞杆菌、金黄色葡萄球菌大肠杆菌和苏云金杆菌的抑菌效果,将分离菌株发酵培养48h后,分离出菌液上清并5倍浓缩并过滤除菌,各取100μL用于抑菌实验,用游标卡尺检测抑菌圈直径。
1.4.2 对羟自由基清除的测定 参照文献[18]的方法,于试管中依次加入1mL pH7.4 0.15mol/L PBS,1mL 0.75mmol/L邻二氮菲溶液,0.75mmol/L FeSO4溶液1mL,1mL超纯水,1mL不同发酵样品,最后加入1mL H2O2,每 加 一 管 立 即 摇 匀 ,反 应 液 于 37℃ 保 温1h,以PBS调零,在536nm波长处测此加样管的吸光值。损伤管以超纯水代替样品,以超纯水代替样品及H2O2作为未损伤管,同法测定在536nm波长处的吸光值。清除率计算公式如下:

1.4.3 对DPPH自由基清除的测定 参照文献[19]的方法,吸取不同发酵液样品2mL于试管中,然后加入2mL 0.002%DPPH乙醇溶液,充分混匀,避光静置30min后,在517nm波长测吸光值为Ai,对照组为2mL样品与2mL 50%乙醇混合反应,517nm处的吸光值记为Aj;空白组为2mL 50%乙醇代替样品,吸光值记为Ao;50%乙醇作为空白调零。按以下公式计算清除率。
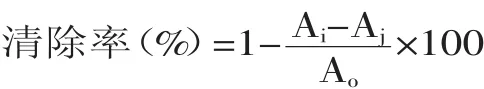
1.4.4 对超氧阴离子自由基清除的测定 参照文献[20]中的方法,在试管中加入4.5mL 50mmol/L pH8.2 Tris-HCl缓 冲 液 和5.2mL 超 纯 水 混 匀 ,25℃ 水 浴 下保温20min,取出后立即加入25℃预热过的0.3mL 25mmol/L邻苯三酚,迅速摇匀,倒入比色皿,于325nm每隔30s测定一次吸光值,连续4min测定邻苯三酚的自氧化速率。在试管中加入4.5mL 50mmol/L pH8.2 Tris-HCl缓冲液,4.2mL超纯水,1mL不同发酵样品,混匀,其他步骤同上。按下式计算清除率。
清除率(%)=(A-Ai)/A×100
式中:A:邻苯三酚的自氧化速率,Ai:加入样品后邻苯三酚的自氧化速率,单位均为吸光度每分钟的增值。
2 结果与分析
2.1 菌株鉴定
2.1.1 菌株的形态特征 从发酵酸菜中分离到20株菌,其中有13株菌株经革兰氏染色呈阳性,规则性无芽孢长杆菌,两端钝圆,菌落直径1~2mm,圆形或类圆形、湿润、边缘整齐、表面光滑、中央有隆起或扁平的白色或乳白色菌落,不透明、有光泽、质地软,菌落背面为黄色,能溶解CaCO3产生透明圈。如图1所示。
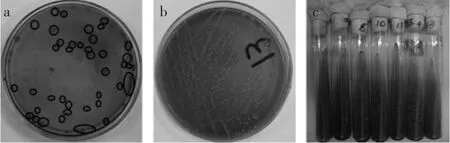
图1 菌株的形态特征Fig.1 The morphological characteristics of the strains
2.1.2 乳酸的定性实验 经纸层析法分析发酵产物,结果表明样品显色斑点较清晰,无拖尾,分离效果较好,除9号菌斑点较模糊外。标样和各菌株发酵液的层析点显色一致,均为黄色斑点,明显并基本处于同一位置,因而12株菌的发酵液中均含有乳酸,说明此12株菌均为产乳酸菌株(见图2)。通过纸层析法测定以上12株菌的发酵液的Rf值,并与标准乳酸的Rf值进行比较,12株可疑乳酸杆菌发酵液经过纸层析并显色后,黄色斑点的Rf值与标准乳酸的Rf值相近,且均在允许的误差范围内(见表1),因而,可以初步确定所分离得到的12株菌株所产酸均为乳酸,即此12株菌均为乳酸菌。
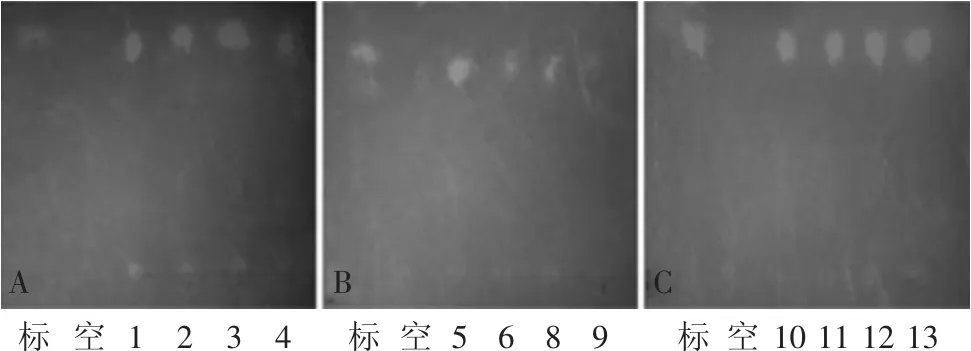
图2 菌株的乳酸定性纸层析图Fig.2 The results of the qualitative examination for lactic acid of the bacteria by paper chromatography

表1 标准乳酸与菌株发酵液纸层析的Rf值比较Table 1 Comparison of the Rfvalues of standard lactic acid and fermentation broth by paper chromatography
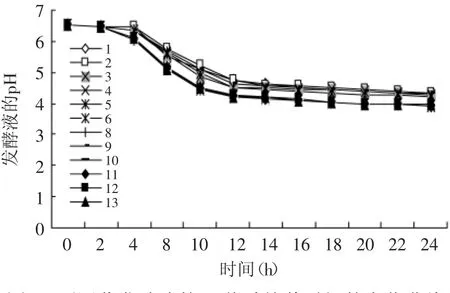
图3 不同菌发酵液的pH值随培养时间的变化曲线Fig.3 Change in pH of culture with time
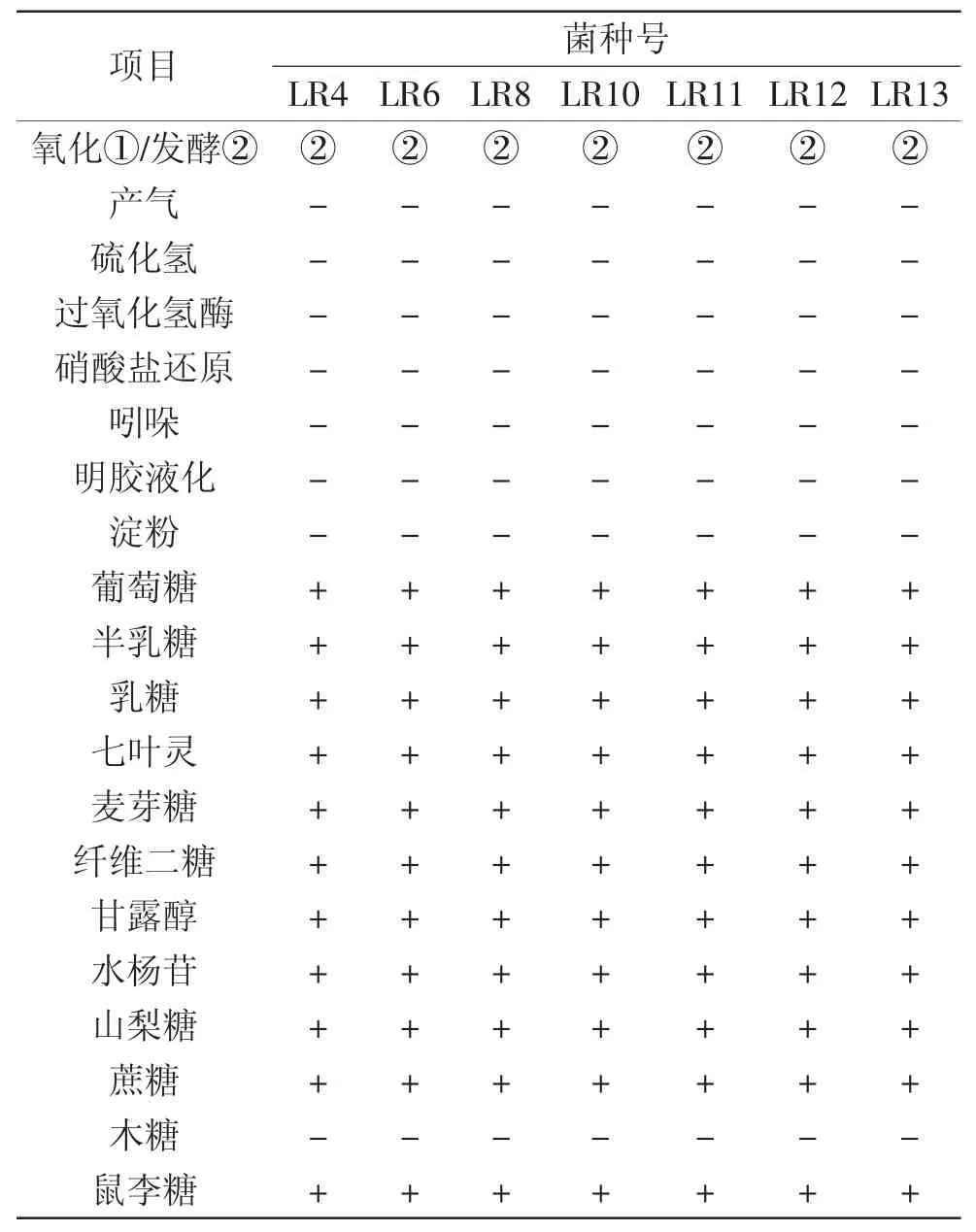
表2 菌种的生化特征及碳水化合物发酵实验结果Table 2 The biochemistry features and the results of carbohydrate fermentation tests of the bacterias
2.1.3 不同菌株的产酸速率 12株产酸菌株24h pH的变化曲线如图3所示,各菌发酵液在0~24h内pH不断下降,下降的幅度最大时间段为4~12h,12~24h,各菌的发酵液下降趋势变缓,从图3可以看出,其中4、6、8、10、11、12、13号菌株在24h内产酸速率的曲线大致在同一曲线上,产酸速率接近,并且高于其他5株菌,因此在以下实验中采用这七株菌继续做实验,且分别命名为LR4、LR6、LR8、LR10、LR11、LR12、LR13。
2.1.4 生理生化特征 由表2可知,分离纯化后得到的7株菌的生化特性基本一致,均为同型发酵,其过氧化氢酶实验、吲哚实验、水解淀粉实验、硝酸盐还原实验、明胶液化实验、硫化氢产生实验、发酵产气实验均为阴性,符合乳杆菌属的特征,所以初步判定其均为乳杆菌属。同时,7株菌均能发酵七叶灵、乳糖、半乳糖、葡萄糖、麦芽糖、纤维二糖、蔗糖、鼠李糖、山梨醇、水杨酸、甘露醇,不发酵木糖。根据以上生理生化及糖发酵鉴定结果,参照《常见细菌系统鉴定手册》[14]、《伯杰氏细菌鉴定手册》第八版和凌代文[1]《乳酸细菌分类鉴定及实验方法》对各菌株进行鉴定,可初步鉴定7株菌均为鼠李糖乳杆菌(Lactobacillus rhamnosus)。一般从自然发酵酸菜中分离的乳酸菌有各种类型乳杆菌,如弯曲乳杆菌、清酒乳杆菌、干酪乳杆菌、短乳杆菌、棒状乳杆菌、植物乳杆菌、米酒乳杆菌、罗伊氏乳杆菌和植物乳酸杆菌等[21-22],而对于从自然发酵酸菜中分离出鼠李糖乳杆菌尚未有之,这一发现可为工业发酵酸菜提供新的菌种资源。
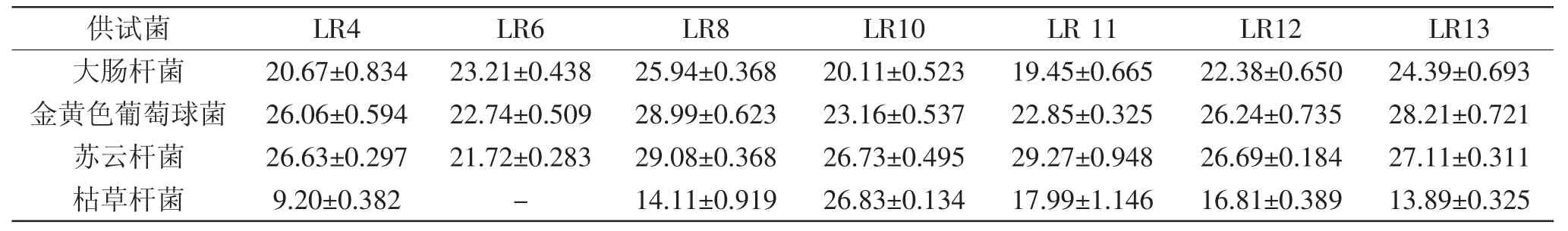
表3 发酵液对供试菌的抑菌结果Table 3 Inhibitory effect of culture filtrate on pathogenic microorganisms
2.2 乳酸菌发酵液生物活性的测定
2.2.1 抑制细菌活性 抑菌结果表明(表3)7株鼠李糖乳杆菌发酵48h,既能产生具有抑制革兰氏阴性菌大肠杆菌,又能产生抑制革兰氏阳性菌金黄色葡萄球菌和苏云杆菌的次生代谢物,除LR6菌发酵液不能抑制枯草杆菌的生长外,其他6株鼠李糖乳杆菌均能发酵产生抑制枯草杆菌的次级代谢产物,抑菌效果明显,直径大部分超过20mm,乳酸菌能够产生抑菌次生代谢产物主要是细菌菌素[23-24],有机酸、酒精和二氧化碳等,在有氧的条件下乳酸菌还可产生过氧化氢,由于乳酸菌缺乏过氧化氢酶,过氧化氢的蓄积可对一些微生物如金黄色葡萄球菌产生抑制作用[25]。
2.2.2 抗氧化性效果 将鼠李糖乳杆菌发酵液上清离心,真空冷冻干燥浓缩5倍,0.22μm滤膜过滤除菌得发酵浓缩液,图4表明7株鼠李糖乳杆菌发酵液对·OH、DPPH·和O2·-自由基均有显著的清除作用,但是同种鼠李糖乳杆菌不同型号的菌株,清除自由基的能力还是有差异,其中LR6鼠李糖乳杆菌的清除自由基的能力明显低于其他6株菌,本研究结果与王玉华等[26]的研究相似,其研究表明,2.5mL鼠李糖乳杆菌的培养物对羟自由基和超氧阴离能达到50%以上,在本实验中,除LR6外,1mL的5倍浓缩发酵液清除·OH和O2·-的能力均超过50%的清除率。
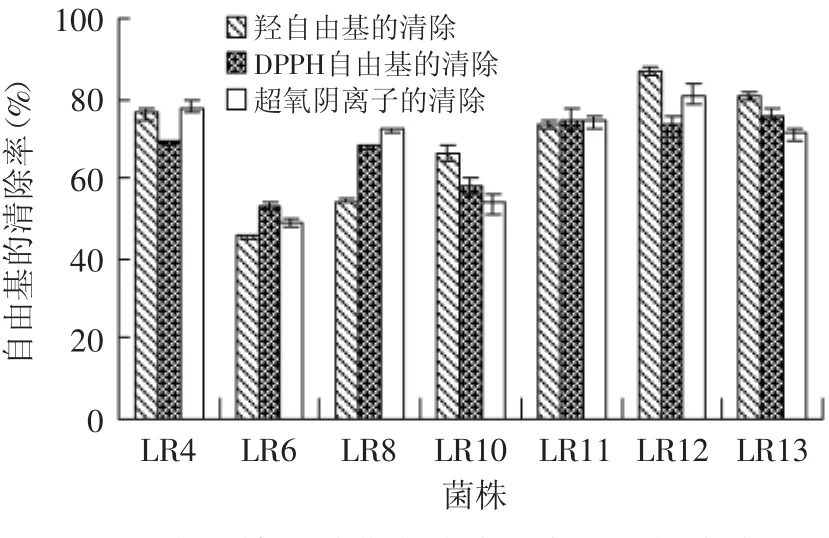
图4 鼠李糖乳酸菌发酵液对自由基的清除Fig.4 The scavenging of Rhamnose lactobacillus fermented liquid for free radicals
3 结论
从自制发酵酸菜汁中分离出20株菌株,经形态学观察、菌株液体培养特征和生理生化特征初步鉴定后,发现有7株菌初步确定为鼠李糖乳杆 菌(Lactobacillus rhamnosus)。但是如果要确定到种,还需做进一步的分子鉴定。
7株菌经48h发酵,均能产生抑制大肠杆菌,金黄色葡萄球菌和苏云杆菌生长的次生代谢物,LR6菌的发酵液不能抑制枯草杆菌的生长,其他6株鼠李糖乳杆菌发酵48h还可产生抑制枯草杆菌的次级代谢产物。从7株菌的抑菌实验结果可以看出,这7株菌对于病原菌的清除作用显著,有利控制发酵酸菜中的病原菌,对于酸菜的品质能起到一定的安全保证作用。
7株鼠李糖乳杆菌发酵液中能显著清除·OH、DPPH·和O2-·,由此可以推出7株菌发酵产生的胞外产物含有清除自由基的有效成分,但其具体成分尚有待进一步的研究。
7株鼠李糖乳杆菌的生物活性研究结果表明该7株菌是性能非常优良的乳酸菌,值得开发和利用。
[1] 凌代文,东秀珠. 乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-129.
[2] 金其荣. 有机酸发酵工艺学[M]. 北京:中国轻工业出版社,1989:339-406.
[3]Jonathan E,Teitelbaum W,Allan Walker.Nutuitional impactofpre-and probioticsas protective gastrointestinal organisms[J].Annual Review of Nutuition,2002,22:107-138.
[4]马鹏飞,陈有亮,金鸟君.鼠李糖乳杆菌功能特性的研究进展[J].科技通报,2009,25(2):82-96.
[5] 安颖,王世宾. 益生菌LGG的功效及在乳品中的应用[J]. 食品科技,2006(7):23-25.
[6]Silva M,JACOBUS NV DENEKE C.Antimicrobial substance from a human Lactobacillusstuain Anitmicrob[J].Agents Chemother,1987,31(8):1231-1233.
[7]Jon A Vanderhoof MD,David B Whitney MD,Dean L Antonson MD,et al.Lactobacillus GG in the prevention of antibioticassociated diarrhea in children[J].The Journal of Pediatrics,1999,135(5):564-568.
[8]Alander M,Satokari R,Korpela R,et al.Persistence of colonizatlon of human colonic mucosa by a probiotic strain,Lactobacillus rhamnosus GG,after oral consumption[J].Applied and Environment Microbiology,1999,65:351-354.
[9]Lam EK,Yu L,Wong HP,et al.Probiotic Lactobacillus rhamnosus GG enhances gastric ulcer healing in rats[J].European Journal of Pharmacology,2007,565(l-3):171-179.
[10]Jeremy A,James V.Lactobacillus rhamnosus GG decreases TNF- αproduction in 1ipopolysaccharide-activated murinemacrophages by a contact-independent mechanism[J].Cellular Microbiology,2003,5(4):277-285.
[11]Hahtunen T,Kankaanpaa P,Tahvonen R,et al.Cadmium removal by lactic acid bacteria[J].Bioscience and Microflora,2003,22(3):93-97.
[12]Mattar AF,Teitelbaum DH,Drongowski RA,et al.Probiotics up-regulate MUC-2mucin gene expression in a Caco-2 cellculture model[J].Pediatric Surgery International,2002,18:586-590.
[13]Ahola AJ,Yli-Knuuttila H,Suomalainen T,et al.Short-term consumption of probiotic-containing cheese and its effect on dental caries risk factors[J].Archives of Oral Biology,2002,47(11):799-804.
[14] 蔡信之,黄君红.微生物学实验[M].第三版.北京:科学出版社,2010:207.
[15]王友湘,陈庆森,阎亚丽.用于乳酸菌分离鉴定的几种培养基的筛选及应用[J]. 食品科学,2007,28(9):374-378
[16] 管世敏.降解亚硝酸盐乳酸菌的分离筛选及其在泡菜发酵中的应用研究[D].上海:上海师范大学,2010.
[17] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,1999:143-145.
[18] 赵保 路. 自由基和天 然抗氧化剂[M]. 北 京:科学出版 社 ,1999.
[19]许宗运,马少宾,张秀萍,等.DPPH.法测量37种植物抗氧化活性[J]. 塔里木农垦大学学报,2004,16(2):1-4.
[20]袁悼斌,高若梅. 邻苯三酚自氧化反应的动力学研究[J].高等学校化学学报,1997,18(9):1438
[21]李欣,武俊瑞,田甜,等.大庆自然发酵酸菜中乳酸菌的分离鉴定及耐酸菌株初步筛选[J]. 食品科学,2014,35(1):150-154.
[22]葛菁萍,邹鹏,宋刚,等.酸菜发酵液中乳酸菌的分离与鉴定[J]. 食品工业科技,2007,28(10):83-84.
[23]姚丽娅,徐为民,诸永志,等.产细菌素乳酸菌的筛选及鉴定[J]. 食品工业科技,2008,29(1):160-164.
[24]李秀凉,雷虹,张龙丰,等.从L-乳酸菌酸菜发酵液中初步分离肽类抑菌物质[J]. 食品工业科技,2008,29(7):91-93.
[25] 李铁军,李爱云,张晓峰.乳酸菌抗菌机理研究进展[J]. 微生物学通报,2002,29(5):81-85.
[26]王玉华,王立梅,冯印,等.鼠李糖乳杆菌菌株LR12和LR76的抗氧化性研究[J]. 食品科学,2009,30(19):177-179.
Isolation,identification and characterization of Lactobacillus rhamnosus strains from pickle during natural fermentation
ZHOU Xian-jiao1,2,RAO Ying-zhu1,2,*,HUANG Ting-juan1,CHEN Rong1,2
(1.Life Science and Technology School,Lingnan Normal University,Zhanjiang 524048,China;2.Institute of Applied Biotenology Lingnan Normal University,Zhanjiang 524048,China)
20 bacterias were isolated from pckle during natural fermentation.12 of them were gram-positive bacterias,7 of these gram-positive bacterias were catalogued as Lactobacillus rhamnosus strains by testing producing lactic acid,the rate of producing the acid,the physiological and biochemical characteristics.It was also studied that the antimicrobial was assayed by the oxford cup and the anti-oxidation abilities were tesed by the scavenging the ·OH,DPPH· and O2·-of Rhamnose lactobacillus fermented liquid.The results showed as follows:these 7 Lactobacillus rhamnosus strains have antibacterial activity against Escherichia coli,Su Yunjun Bacillus and Staphylococcus aureus.Except LR6 Lactobacillus rhamnosus strain,they also could inhibit Bacillus subtillis,the Rhamnose lactobacillus fermented liquid could scaveng the ·OH,DPPH· and O2·-free radicals obviously.
sauerkraut;Lactic acid bacteria;antimicrobial;anti-oxidation
TS201.2
A
1002-0306(2014)22-0199-05
10.13386/j.issn1002-0306.2014.22.035
2014-03-11
周鲜娇(1976-)女,硕士研究生,实验师,研究方向:海洋微生物。
* 通讯作者:饶颖竹(1968-),男,博士,副教授,研究方向:海洋生物学。
国家星火计划项目(2012GA780023);国家星火计划引导项目(2013GA780091)。
