植物乳杆菌发酵紫薯饮料的研制
2014-03-07张秋晨李金玉王婷婷
赵 磊,张秋晨,李金玉,王婷婷
(北京工商大学北京市食品添加剂工程技术研究中心,食品风味化学北京市重点实验室,北京 100048)
植物乳杆菌发酵紫薯饮料的研制
赵 磊,张秋晨,李金玉,王婷婷
(北京工商大学北京市食品添加剂工程技术研究中心,食品风味化学北京市重点实验室,北京 100048)
以紫薯为原料,利用植物乳杆菌为发酵剂,对紫薯乳酸发酵饮料的加工工艺进行研究。结果表明:紫薯用5倍水打浆,加入6U/100mL薯浆α-淀粉酶于60℃条件下酶解20min,再添加55U/100mL薯浆的糖化酶在pH4.5条件下糖化90min,可得理想的淀粉水解效果。通过正交实验,确定产品的最佳发酵工艺条件为接种量4%,发酵温度37℃,发酵时间14h;实验最佳配方为蔗糖8%,柠檬酸0.1%,黄原胶0.02%,CMC-Na 0.02%,PGA 0.02%。
紫薯,乳酸发酵,植物乳杆菌
紫薯属于甘薯的一种,20世纪90年代从日本引进,紫薯皮呈紫黑色、肉质为紫色至深紫色,紫薯比普通甘薯更富含硒、植物蛋白、多糖、维生素和矿物质[1]。紫薯极高的营养价值主要体现在其富含花青素和元素硒,其中花青素是天然强效的自由基清除剂[2],还具有预防癌症、增进视力、改善睡眠和血液循环等功效[3]。紫薯中富含的微量元素硒是谷胱甘肽过氧化物酶的组成成分,不仅对清除体内自由基有特殊贡献,还可以抑制癌细胞中DNA的合成和癌细胞的分裂与生长[4-5]。由于紫薯营养丰富,且主要为碳水化合物,其中的可发酵糖能被乳酸菌利用而转化为乳酸,可将其开发为乳酸发酵饮料。
植物乳杆菌(Lactobacillus plantarum)是人体胃肠道的益生菌群,常见于发酵蔬菜和果汁中,可维持肠道内菌群平衡、提高机体免疫力和促进营养物质的吸收[6-7],在食品工业中应用广泛。研究表明,甘薯经植物乳杆菌发酵后,经过适当的风味调配,得到的产品具有清爽的酸味,并伴有淡淡薯香[8]。目前,紫薯主要用于提取天然色素,在制作饮料方面的应用大多以配料形式出现,鲜有直接以紫薯为主要原材料生产的饮料。本研究以紫薯为原料,利用植物乳杆菌进行发酵,对紫薯植物乳杆菌发酵饮料的发酵及调配工艺进行了研究,为紫薯饮料的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜紫薯 市售,大小均匀,肉质细腻;植物乳杆菌 北京工商大学食品发酵工程教研室惠赠,标号为“植物乳杆菌RL-1”;α-淀粉酶、糖化酶 北京双旋生物有限公司;羧甲基纤维素钠(CMC-Na)、黄原胶、海藻酸丙二醇酯(PGA)、蔗糖、柠檬酸 均为食品级;主要培养基 MRS固体或液体培养基;氢氧化钠、氯化钾、盐酸、醋酸钠、醋酸 均为分析纯。
HQ45恒温摇床 中国科学院武汉科学仪器厂;SW-CJ-2FD双人单面净化工作台 苏州净化设备有限公司;MLS-3750高压蒸汽灭菌器 三洋电机株式会社;TGL-10C高速台式离心机 上海安亭科学仪器厂;UV2450紫外分光光度计 日本岛津株式会社;DHG-9145A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;FE20 pH计 梅特勒-托利多国际股份有限公司。
1.2 实验方法
1.2.1 理化指标测定
1.2.1.1 pH测定 用pH计直接测定。
1.2.1.2 酸度的测定 吸取5mL样液,加入50mL煮沸并冷却至室温的蒸馏水,加2~3滴酚酞指示剂,用0.1mol/L NaOH标准溶液滴定至微红色,以30s不褪色为终点,记下消耗NaOH标准溶液的毫升数A,计算出酸度,结果用乳酸含量表示,乳酸含量(%)=[(0.1×A× 0.09)/5]×100。
1.2.1.3 还原糖含量测定 采用3,5-二硝基水杨酸(DNS)法[9],DE值(以葡萄糖计,%)=(还原糖含量/总干物质的含量)×100。
1.2.1.4 花色苷含量测定 采用pH示差法[10],在总花色苷含量线性范围内,分别用pH1.0的氯化钾-盐酸缓冲溶液和pH4.5的醋酸钠-醋酸缓冲溶液稀释样品,平衡20min后,测定两种稀释样品在最大吸收波长处的吸光度Amax和700nm波长处的吸光度A700,由经验 公 式 计 算 总 花 色 苷 含 量 ,A=(Amax-A700)pH1.0-(Amax-A700)pH4.5。
1.2.1.5 沉淀率的测定 准确称取样品于离心管中,然后5000r/min下离心20min,去除上清液,准确称取沉淀质量,计算沉淀率,作为稳定性评价指标,沉淀率(%)=(沉淀质量/样液质量)×100。
1.2.2 感官分析方法 对发酵紫薯汁进行感观分析,采用评分检验法,指标有色泽、香味、滋味、澄清度和整体口感,各指标评分标准见表1。感官综合评分=色泽×0.1+香味×0.1+滋味×0.4+澄清度×0.1+整体口感×0.3。感官评价共有9位有品尝经验的老师和研究生作为评价员,统计评价结果,进行分析。

表1 紫薯发酵感官评分指标Table 1 Index of sensory scores
1.2.3 工艺流程 紫薯→预处理→热烫→打浆→蒸煮→酶解→灭酶→接种→发酵→过滤→调配→杀菌→灌装→冷却→成品。
1.2.4 操作要点
1.2.4.1 预处理 选取个体肥大、无霉烂、无发芽、无机械损伤的紫薯,用清水洗干净修正后刮去表皮,随后将紫薯切成薄片(约2mm),备用。
1.2.4.2 热烫和打浆 将预处理的紫薯片立即用沸水热烫7min,使多酚氧化酶、过氧化酶和抗坏血酸氧化酶失活,从而防止多酚物质和VC引起的褐变。按照料液比(紫薯∶水为1∶5)的比例打浆。
1.2.4.3 蒸煮 紫薯热烫、打浆后,在90~95℃水浴中蒸煮30min,使淀粉充分糊化,利于淀粉酶解。
1.2.4.4 液化和糖化条件的确定 为充分利用紫薯的淀粉,将糊化好的紫薯浆,先后加入液化酶和糖化酶,通过DE值确定α-淀粉酶和糖化酶的最佳使用量和作用时间,以提高紫薯浆中还原糖含量,为植物乳杆菌的发酵提供充足的碳源。
a. 液化酶量的确定 在100mL薯浆中添加不同量(0、2、4、6、8、10U)的α-淀粉酶,在60℃,pH6.0条件下液化30min,以酶解液DE值为指标确定液化酶添加量。
b.液化时间的确定 在100mL薯浆中加入6U的α-淀粉酶,保持温度60℃,pH6.0,于不同液化时间(0、5、10、15、20、25、30、35min)测定酶解液的DE值,并确定液化时间。
c.糖化酶量的确定 在100mL紫薯浆中添加不同量(45、55、65、75、85U)的糖化酶,在60℃,pH4.5的条件下糖化90min,测定酶解液的DE值,以酶解液DE值为指标确定糖化酶添加量。
d.糖化时间的确定 在100mL紫薯浆中加入55U糖化酶,调节pH为4.5,保持温度60℃,于不同糖化时间(30、60、90、120、150min)测定酶解液的DE值,并确定糖化时间。
1.2.4.5 灭菌冷却 将灭酶后的紫薯糖化液分装,于121℃下灭菌15min,冷却后等待接种。
1.2.4.6 调配和产品杀菌 紫薯汁发酵好后,添加CMC-Na、黄原胶、PGA等稳定剂,充分混合均匀,用蔗糖、柠檬酸对紫薯汁进行调配,在80℃下巴氏灭菌15min[11]。
1.2.5 紫薯浆乳酸发酵条件的确定
1.2.5.1 单因素实验 实验前先将保藏菌种进行活化,然后制备种子培养物。以发酵液的乳酸含量为指标,通过单因素实验,考察接种量、发酵温度及发酵时间对紫薯浆乳酸发酵的影响,从而确定适宜的取值范围。
a.接种量的确定 在发酵温度为41℃,发酵时间为16h的条件下,采用不同接种量(1%、2%、3%、4%、5%)对紫薯浆进行发酵,根据产酸量确定最适接种量。
b.发酵温度的确定 在接种量为3%,发酵时间为16h的条件下,采用不同发酵温度(35、37、39、41、43℃)对紫薯浆进行发酵,根据产酸量确定最适发酵温度。
c.发酵时间的确定 在发酵温度为39℃,接种量为3%的条件下,采用不同发酵时间(2、4、6、8、10、12、14、16h)对紫薯浆进行发酵,根据产酸量确定最适发酵时间。
1.2.5.2 发酵工艺条件的优化实验 根据单因素实验结果,以接种量、发酵温度和发酵时间为考察因素,采用L9(34)正交实验,以感官评价标准作为检测指标,优化相关工艺参数,确定最优发酵条件,正交因素水平见表2。

表2 发酵液L9(34)正交实验因素水平表Table 2 Factors and levels of orthogonal experiment
1.2.5.3 发酵时间对紫薯乳酸发酵营养成分的影响花色苷是紫薯中重要的功能性成分,以发酵液的还原糖(DE值)和花色苷含量为指标,评价发酵时间(2、4、6、8、10、12、14、16h) 对发酵液中营养成分的影响。
1.2.6 紫薯乳酸饮料配方的优化 以蔗糖和柠檬酸添加量为考察因素,产品感官评分为评定指标,在前期预实验及相关报道[8,12]的基础上,选取蔗糖添加量(4% 、8% 、12%)和 柠 檬 酸 添 加 量(0.10% 、0.15% 、0.20%),进行全因子实验对参数进行优化,以确定植物乳杆菌发酵紫薯饮料的最佳配方,各因素水平见表3。

表3 全因子实验因素水平表Table 3 Factors and levels of ALL test experiment
1.2.7 复合稳定剂对紫薯乳酸发酵饮料稳定性的影响 在文献相关报道[8,12]和前期预实验的基础上,以黄原胶、CMC-Na、PGA为考察因素,采用L9(34)正交实验,以沉淀率为评价指标,优化复合稳定剂的配比,各因素水平见表4。
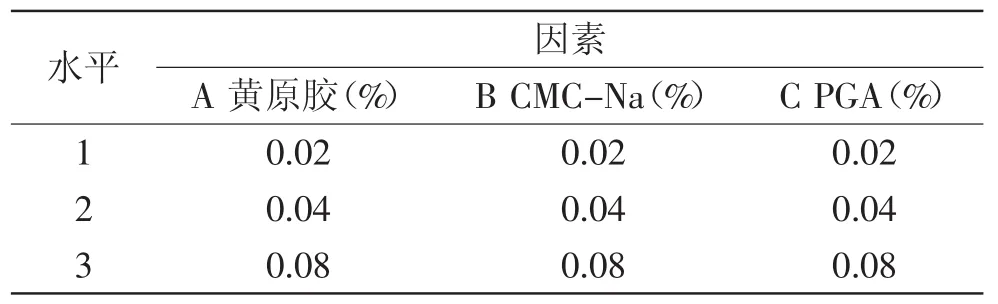
表4 正交实验因素水平表Table 4 Factors and levels of orthogonal experiment
1.2.8 数 据 处 理 采 用Origin 8.5和Excel对 结 果 进行分析,实验重复3次,以“平均值±标准偏差”表示。
2 结果与分析
2.1 液化条件的确定
2.1.1 液化酶量的确定 由图1可知,随着α-淀粉酶用量的增加,DE值不断增大。当α-淀粉酶用量为6U/100mL薯浆时,DE值达到最大值,此后继续增加酶量,DE值几乎保持不变。这是因为底物浓度恒定时,参与酶解反应的位点总是一定的,其底物分子中的α-1,4糖苷键已被饱和,即使继续增加酶量,水解产物的量也不会发生变化[13]。因此为节省成本,选择α-淀粉酶添加量为6U/100mL薯浆。
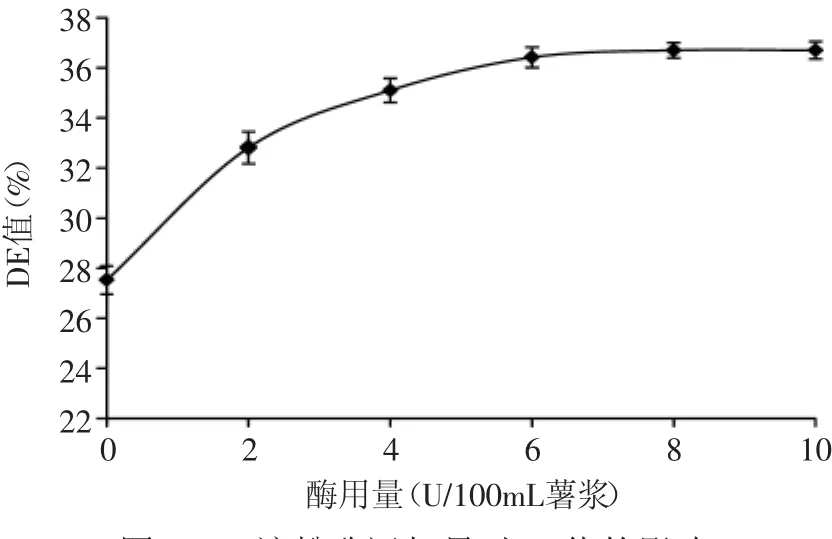
图1 α-淀粉酶添加量对DE值的影响Fig.1 Effect of α-amylase additive amount on DE value
2.1.2 液化时间的确定 由图2可以看出,当α-淀粉酶酶解时间小于20min时,紫薯浆的DE值随着酶解时间的延长呈线性增大。当α-淀粉酶酶解时间为20min时,DE值达到最高,此后继续延长酶解时间,紫薯浆的DE值增长不明显。产生这种现象的主要原因是α-淀粉酶对长链淀粉或糊精酶解的速度要比短链淀粉速度快,随着酶解的进行,淀粉液中短链淀粉产物的数量逐渐增加,水解的速率逐渐减慢[14]。此外,也与α-1,6糖苷键逐渐暴露,从而影响酶解速度有关。因此,选择液化时间为20min。
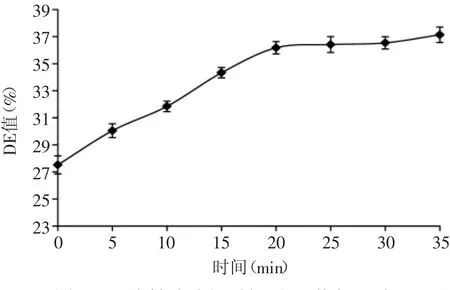
图2 α-淀粉酶酶解时间对DE值得影响Fig.2 Effect of α-amylase digestion time on DE value
2.2 糖化条件的确定
2.2.1 糖化酶用量的确定 由图3可以看出,随着糖化酶量的增加,紫薯浆的DE值不断增大,当糖化酶量为55U/100mL薯浆时,DE值达到最大,此后随糖化酶量的增加DE值略下降。糖化酶用量小于55U/100mL薯浆时,糖化不完全,紫薯浆糖化液中还原糖含量低;当糖化酶用量增加至使底物饱和的浓度时,反应速度不再增加,DE值增幅不大;而当糖化酶用量继续增大时,酶解速度过快使糖化产物葡萄糖浓度过高,进而产生底物抑制作用,也可能因为葡萄糖在较高浓度下经α-1,6糖苷键发生聚合,从而造成DE值略有下降[15]。因此,选择糖化酶添加量为55U/100mL薯浆。
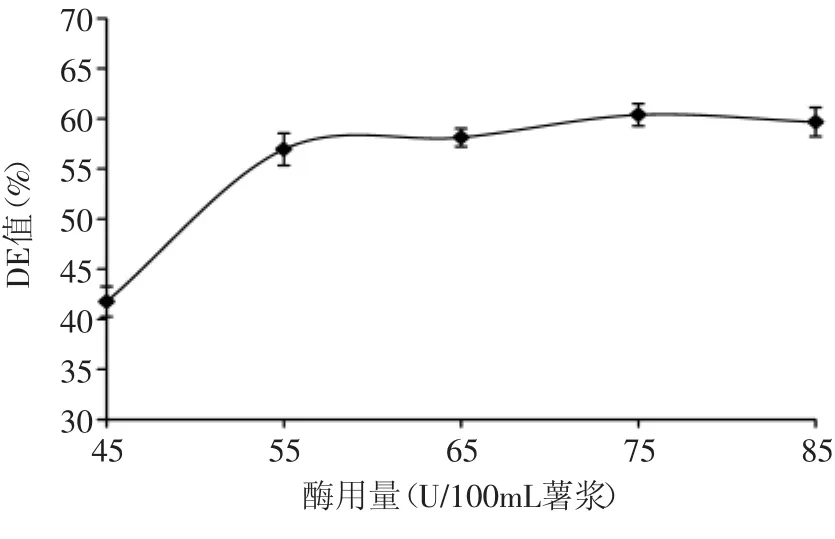
图3 糖化酶添加量对DE值的影响Fig.3 Effect of saccharifying enzyme additive amount on DE value
2.2.2 糖化时间的确定 由图4可以看出,糖化时间在30~90min时,DE值快速增长,当糖化时间为90min时,DE值达到最大,此后随时间的增加DE值变化不大。这是因为糖化时间短淀粉水解不完全,糖度较低;随着时间的延长,淀粉水解增加导致糖度增加;而时间过长淀粉已经完全水解,所以糖度变化不大。从节省时间考虑,选择糖化时间为90min。
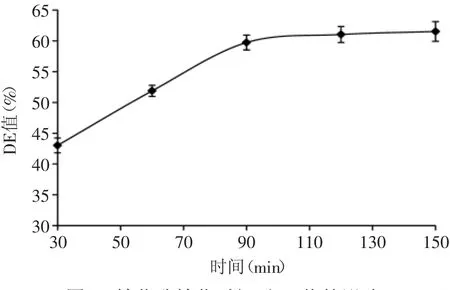
图4 糖化酶糖化时间对DE值的影响Fig.4 Effect of saccharifying enzyme saccharification time on DE value
2.3 紫薯浆乳酸发酵单因素实验
2.3.1 接种量对发酵液乳酸含量的影响 适当增加接种量,可以缩短甚至消除延滞期,加快产酸速度。由图5可知,随着接种量的增加,发酵液乳酸含量呈上升趋势。接种量为1%的紫薯浆经12h发酵后产酸量为0.22%左右,产酸较慢,达不到饮料生产的要求。接种量为3%的紫薯浆经12h发酵后产酸量可达0.25%,其后乳酸含量增加趋于平稳,因此选择接种量为3%。
2.3.2 发酵温度对发酵液乳酸含量的影响 发酵温度对紫薯浆发酵液乳酸含量的影响,结果如图6所示。在35~41℃范围内,发酵液乳酸含量随温度升高呈先升高后降低的趋势,植物乳杆菌发酵紫薯浆的最适温度为37~39℃左右,此时产酸量可达0.21%。发酵温度低,植物乳杆菌生长缓慢,产酸量少且达到规定酸度的时间较长;发酵温度高,抑止植物乳杆菌生长,出现刺激性较强的酸味。有研究显示,发酵温度对生成乳酸的构型有一定影响,发酵温度低,L(+)乳酸比例大,发酵温度高,D(-)乳酸的比例大[16-17]。综合考虑发酵温度对产酸量和产品风味的影响,选择发酵温度为39℃。
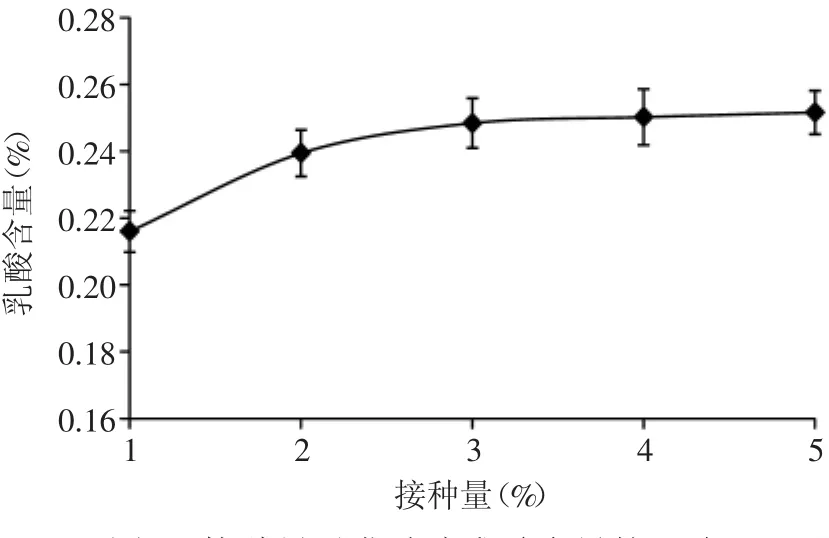
图5 接种量对发酵液乳酸含量的影响Fig.5 Effect of inoculation amount on lactic acid content of fermentation liquid
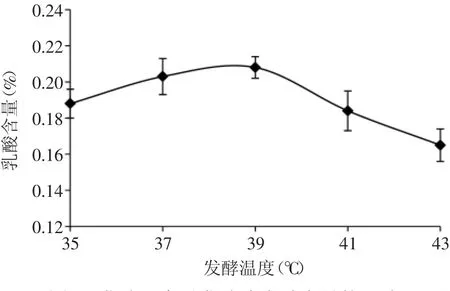
图6 发酵温度对发酵液乳酸含量的影响Fig.6 Effect of fermentation temperature on lactic acid content of fermentation liquid
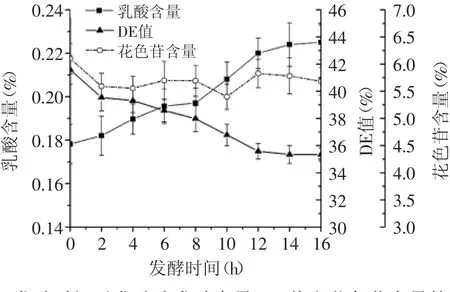
图7 发酵时间对发酵液乳酸含量,DE值和花色苷含量的影响Fig.7 Effect of fermentation time on lactic acid content,DE value and anthocyanin content of fermentation liquid
2.3.3 发酵时间对发酵液乳酸含量的影响 发酵时间对紫薯浆发酵液乳酸含量的影响,结果见图7。在发酵初期,产酸较慢,很可能是与植物乳杆菌适应新的生长环境,从而在0~8h内繁殖相对较慢有关。随着发酵时间延长,乳酸含量不断增加,当发酵时间达到12h后,产酸量趋于稳定,达到最大值0.22%,推测的可能性是因为紫薯浆本身营养有限,细胞进入生长后期,基本停止产酸,因此选择发酵时间为12h。
2.3.4 发酵时间对营养成分含量的影响 从图7可以看出,紫薯浆中的还原糖含量随着发酵的进行而减少,发酵时间达到12h后,还原糖的含量趋于稳定,整个过程还原糖的含量减少了14.5%。将还原糖含量的变化与发酵紫薯浆中乳酸含量的变化进行比较可知,还原糖含量的减少与紫薯浆乳酸含量的增加相对应,这是由于紫薯浆中糖类经乳酸菌作用被消耗和转化成乳酸等产物。紫薯中富含花色苷,是影响其功能活性的重要天然产物。在整个发酵过程中,发酵时间对花色苷含量的影响不显著。至发酵结束时,花色苷含量只减少了6.88%,这主要是由于紫薯发酵液的pH为酸性,有利于维持花色苷性质的稳定。
2.4 紫薯浆乳酸发酵的工艺条件优化
结合单因素实验结果,选取发酵时间、接种量、发酵温度三个因素进行正交实验,静止发酵紫薯浆,以感官评分为指标,结果见表5。对表5正交实验结果进行直观分析,由极差大小可知,影响紫薯乳酸发酵的各因素大小顺序依次为:发酵时间、接种量、发酵温度。发酵工艺的最优组合为A3B3C3。由表6方差分析可知,各因素对紫薯浆乳酸发酵液感官品质的影响均不显著,因此无主因素。由于SB<SE,故将其归并到误差之中作为误差,综合考虑可任取一个水平,从节能角度取水平B1即可,发酵工艺的最优组合为A3B1C3,即接种量为4%,发酵温度为37℃,发酵时间为14h。按上述优化发酵条件进行验证实验,得到紫薯浆乳酸发酵液的感官评分为3.65,可获得较好的发酵效果。
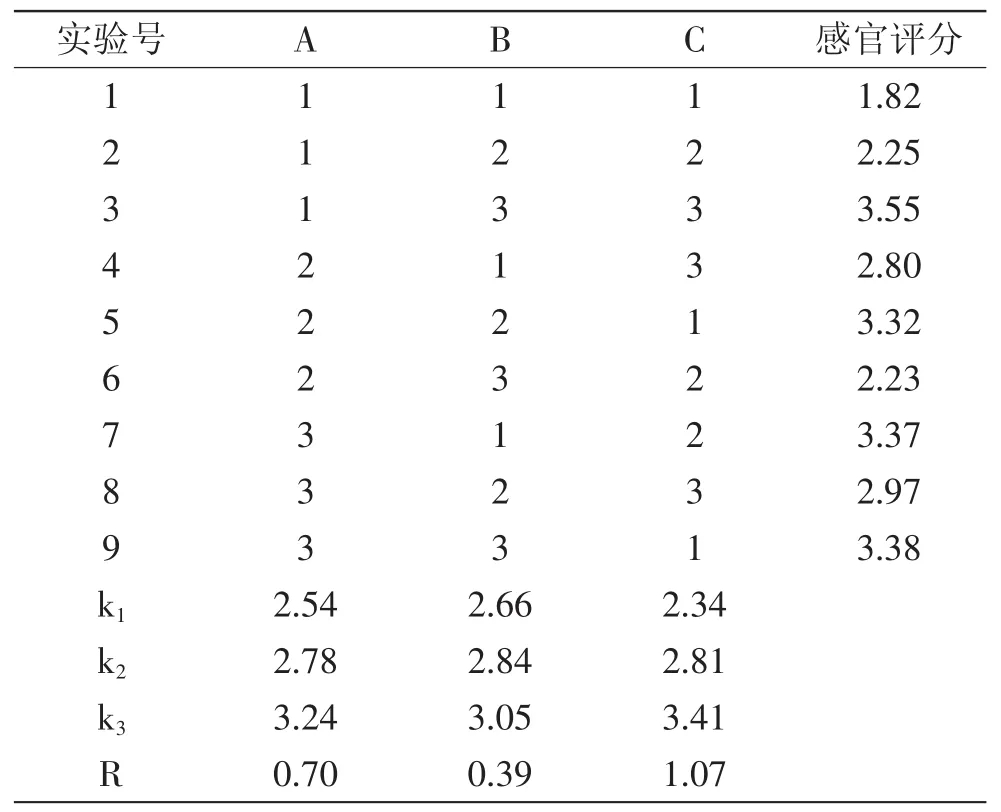
表5 发酵正交实验结果Table 5 Results of orthogonal experiment
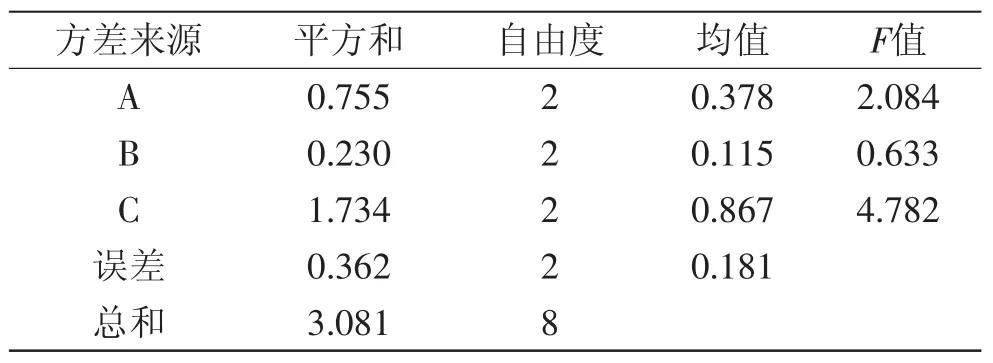
表6 感官评分方差分析Table 6 Results of variance analysis of sensory score
2.5 饮料调配
2.5.1 糖酸比例确定 按照上述发酵工艺参数得到的紫薯发酵液,经过滤澄清后用蔗糖、柠檬酸对其进行口感调配,配方由全因子实验决定,以调配后感官评价得分为指标,确定最佳配方,结果如表7所示。结果显示,蔗糖添加量为8%、柠檬酸添加量为0.1%时,紫薯发酵饮料的感官评分最高。
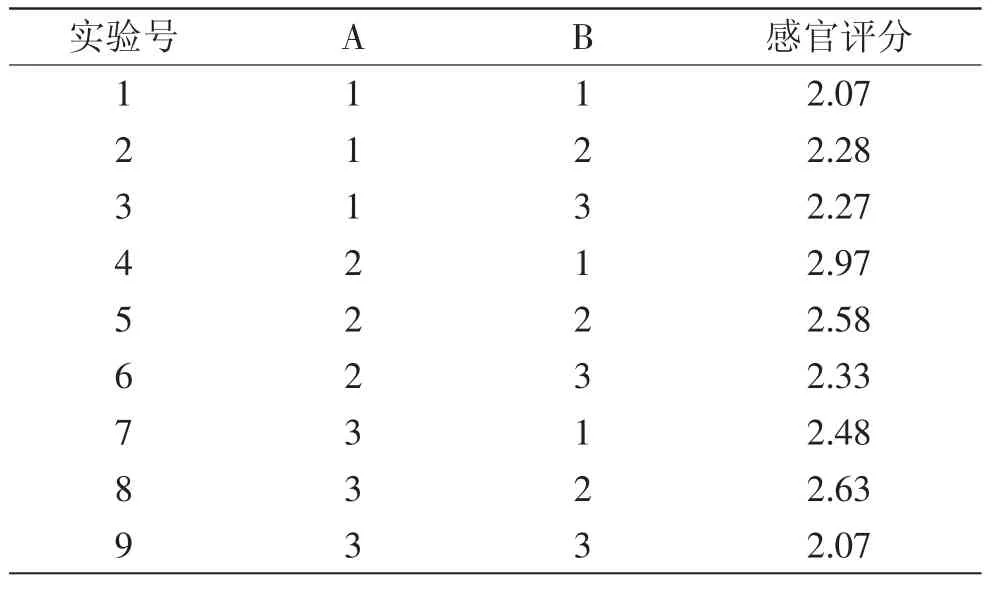
表7 饮料配方的全因子实验结果Table 7 Results of ALL test on beverage formula
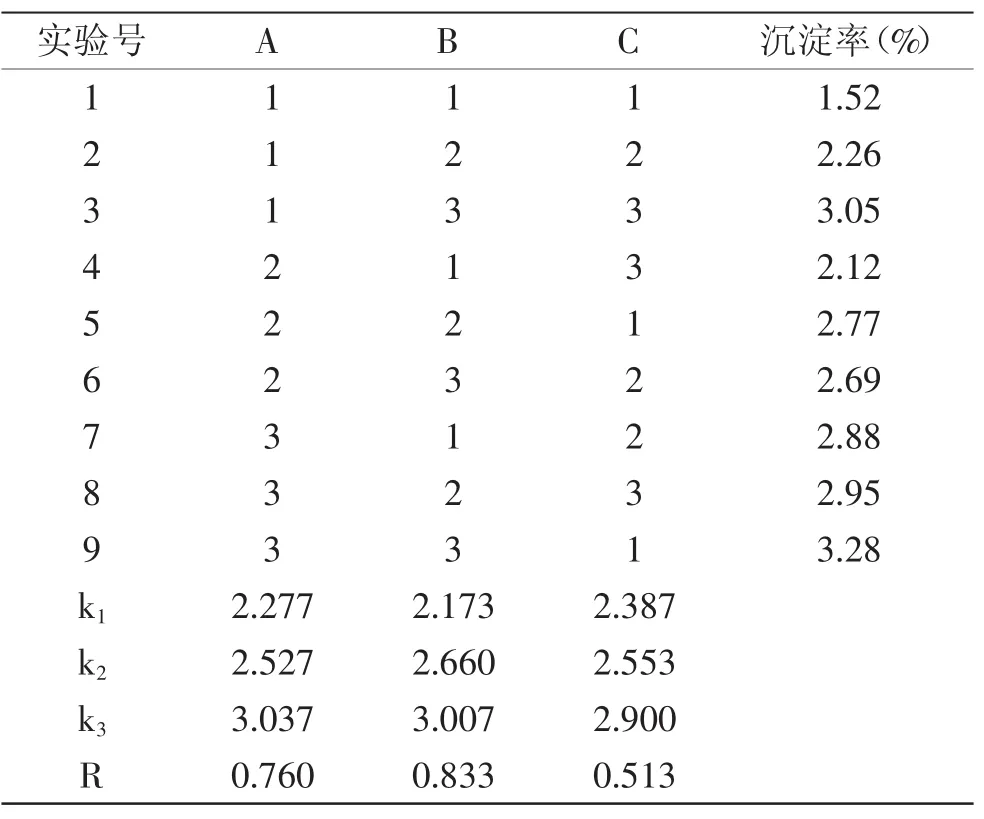
表8 复合稳定剂配方的正交实验结果Table 8 Results of orthogonal experiment oncompound stabilizer formula
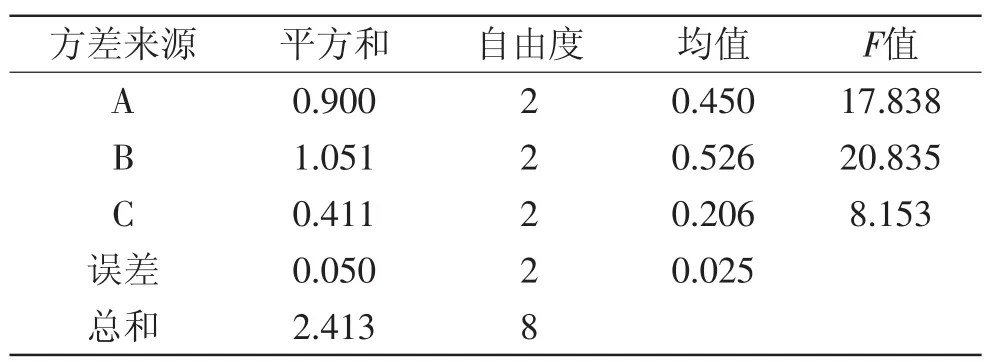
表9 沉淀率方差分析Table 9 Results of variance analysis of precipitation rate
2.5.2 复合稳定剂配方确定 紫薯乳酸饮料经调配后加入稳定剂,稳定剂的最佳配比由正交实验决定,结果见表8。由极差大小可知,各因素对紫薯发酵饮料稳定性的影响顺序依次为:CMC-Na>黄原胶>PGA。稳定剂配方最优组合为A1B1C1,即黄原胶的添加量为0.02%,CMC-Na的添加量为0.02%,PGA的添加量为0.02%时,紫薯乳酸饮料的沉降率最低(1.52%,表8),优于其他配方。由表9方差分析可知,FB=20.835>F0.05(2,2)=19.0,这表明CMC-Na对紫薯乳酸发酵饮料稳定性影响最大,为关键因素。而黄原胶和PGA对紫薯乳酸发酵饮料稳定性影响不显著。
2.6 产品指标
紫薯发酵饮料色泽均匀,呈明亮的紫色;具有紫薯淡淡的清香味;酸甜适口,口感清爽,无异味;澄清,不透明,无悬浮物,可溶性固形物≤10%。细菌总数(个/mL)≤100;乳 酸 菌 数(个/mL)=0;大 肠 杆 菌(个/L)≤3;致病菌未检出。
3 结论
将紫薯打浆、糊化、糖化后,接种植物乳杆菌发酵成紫薯乳酸发酵液,再添加糖、酸及稳定剂,可调配成具有淡淡紫薯香味和乳酸发酵特有香味,酸甜适口,柔和甘爽,营养丰富的新型紫薯乳酸发酵饮料,可丰富饮料市场需求,为紫薯的开发利用提供了新途径。
产品的最佳工艺条件为:紫薯用5倍水打浆后,加入6U/100mL薯浆的α-淀粉酶于60℃酶解20min,再添加55U/100mL薯浆的糖化酶糖化90min,121℃灭菌15min,接种植物乳杆菌4%,37℃发酵14h后,添加蔗糖8%,柠檬酸0.1%,黄原胶0.02%,CMC-Na 0.02%,PGA 0.02%,混合均匀后,成品于115℃灭菌15min,所得产品符合相应的国家食品卫生质量要求。
[1] 杨巍,黄洁琼,陈英,等. 紫薯的营养价值与产品开发[J]. 农产品加工,2011,201(1):81.
[2] 王杉,邓泽元,曹树稳. 紫薯 色素的研究 进展[J]. 粮油食 品科技,2004,12(2):45-46.
[3] 焦龙,李玉伟. 蓝莓果实中花青素提取方法的研究进展[J].北京农业,2011(3):4-5.
[4] 王利群. 紫薯的营养[J]. 农产品市场周刊,2010(20):22-23.
[5] 冯晓群.紫薯的保健功能及应用前景[J].甘肃科技,2011,27(9):160-161.
[6]肖仔君,钟瑞敏,陈惠音,等.植物乳杆菌的生理功能与应用[J]. 中国食品添加剂,2005(2):87-89.
[7] 曲冬梅,刘小杰. 植物乳杆菌及其在食品工业中的应用[J].中国食品添加剂,2008(S0):219-222.
[8]陈金日,冉旭,黄晓斌,等.植物乳杆菌发酵甘薯原汁饮料的研制[J]. 食品研究与开发,2010,31(11):110-112.
[9]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008,29(8):534-536.
[10]霍琳琳,苏平,吕英华.分光光度法测定桑套总花色营含量的研究[J]. 酿酒,2005,32(4):88-89.
[11] 高晗. 红枣乳酸发酵饮料加工工艺研究[D]. 杨凌:西北农林科技大学,2003.
[12] 彭业锦.凉薯乳酸发酵饮料的研制[D].长沙:湖南农业大学,2009.
[13]何娇,黄广民.毛薯粉浆酶法水解的响应面法优化及其动力学研究[J]. 食品科学,2012,33(16):77-83.
[14]张国权,史一一,魏益民,等.荞麦淀粉耐高温α-淀粉酶液化工艺条件研究[J]. 中国粮油学报,2009,23(3):73-77.
[15]张倩,迟玉杰,张华江,等.玉米格瓦斯饮料糖化工艺的研究[J]. 食品工业科技,2012,33(18):241-244.
[16] 刘俊花. 南瓜乳酸发酵饮料加工工艺研究[D]. 西安:陕西师范大学,2006.
[17]张波,何品晶,邵立明.温度和发酵时间对厨余垃圾发酵产乳酸及其光学异构体的影响[J]. 应用与环境生物学报,2007,13(4):575-578.
Preparation of purple sweet potato beverage fermented by Lactobacillus plantarum
ZHAO Lei,ZHANG Qiu-chen,LI Jin-yu,WANG Ting-ting
(Beijing Engineering and Technology Research Center of Food Additives,Beijing Key Laboratory of Flavor Chemistry,Beijing Technology and Business University,Beijing 100048,China)
Taking purple sweet potato as main material,the technology of purple sweet potato beverage fermented by lactic acid bacteria was studied.The results showed that the ratio of purple sweet potato and water for pulping was 1∶5.In order to obtain sufficient starch hydrolysis,the purple sweet potato pulps were treated with 6U/100mL α -amylase at 60℃ for 20min,and then treated with 55U/100mL glucoamylase at pH4.5 for 90min. By using orthogonal experimental design,the optimum fermentation conditions were determined as follows:inoculums amount 4%,temperature 37℃ and time 14h.The optimum formula was 8%sucrose,0.1%citric acid,0.02%xanthan gum,0.02%CMC-Na and 0.02%PGA.
purple sweet potato;lactic acid fermentation;Lactobacillus plantarum
TS275.4
A
1002-0306(2014)22-0193-06
10.13386/j.issn1002-0306.2014.22.034
2014-02-27
赵磊(1982-),女,博士,副教授,主要从事功能性食品方面的研究。
国家自然科学基金青年科学基金项目(31201324);北京市教育委员会科技计划面上项目(KM201210011008)。
