2011年夏季胶州湾表层溶解有机物荧光特征的时空变化
2014-03-07鲁景亮张光涛赵增霞
鲁景亮, 孙 松, 张光涛, 赵增霞
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 中国科学院大学 北京 100049; 3. 山东胶州湾海洋生态系统 国家野外科学观测研究站, 山东 青岛 266071)
2011年夏季胶州湾表层溶解有机物荧光特征的时空变化
鲁景亮1,2, 孙 松1,3, 张光涛3, 赵增霞3
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 中国科学院大学 北京 100049; 3. 山东胶州湾海洋生态系统 国家野外科学观测研究站, 山东 青岛 266071)
利用三维荧光光谱技术(EEMs)结合平行因子分析(PARAFAC)的方法, 对2011年8月至9月胶州湾表层海水溶解有机物荧光特征的时间与空间变化进行了研究。PARAFAC模型共鉴别出四个荧光组分: 类蛋白质荧光组分(C1), 陆源类腐殖质荧光组分(C2, C4)和海源类腐殖质荧光组分(C3)。类蛋白组分在调查期间的荧光强度最强(0.14±0.06), 其余三个组分荧光强度相近(0.07±0.02, 0.09±0.02, 0.05± 0.02)。这四种组分在8月下旬多雨期和9月上旬受径流影响的时期荧光强度较高, 在9月下旬雨季影响消退后荧光强度显著降低。研究表明各组分荧光强度总体上与叶绿素a浓度显著正相关, 与盐度负相关, 说明胶州湾夏季FDOM浓度主要受降雨引发的生物活动影响。
溶解有机物(DOM); 荧光特征; 三维荧光光谱技术(EEMs); 胶州湾
溶解有机物(dissolved organic matter, DOM)在海洋中大量存在并且组成复杂。DOM的总量可以通过溶解有机碳含量来表示, 但具体组成仅有少量能够被量化, 因此其动态变化难以直观表示。荧光溶解有机物(fluorescent dissolved organic matter, FDOM)是DOM中能够吸收光能并且发射荧光的物质[1-2]。不同的荧光组分可以通过三维荧光光谱技术(excitationemission matrix spectroscopy, EEMs)结合平行因子分析法(parallel factor analysis, PARAFAC)区分。由于不同的荧光组分对应不同来源的类腐殖质和类蛋白物质, 对这些荧光组分的解析则可以用来跟踪不同DOM组成和存量的动态变化[3]。
浮游植物是海洋DOM最重要的来源, 在生长、被微生物利用和被动物摄食等过程中都能向水体中释放 DOM。尽管陆源输入只占海洋 DOM总量的0.7%~2.4% , 但是在沿岸区域河流的输入作用显著[4]。同时, 陆源营养盐输入也会激发浮游植物生长, 而类蛋白荧光特征与浮游植物量有一定的关系。在地中海等海域关于 FDOM周年变化的研究中, 降雨、水团混合、营养盐限制等都会影响FDOM组成和含量的季节变化[5-6]。降雨引起的生态系统响应时间较短, 波动幅度较大, 但是目前还没有通过 FDOM 的季节内变化研究降雨影响的案例。
胶州湾是半封闭的海湾, 周边入海河流有十几条, 径流量较大的有大沽河和洋河, 湾内生物生产力和生物群落多样性高, 造成胶州湾DOM组成比较复杂。本文利用胶州湾夏季高频率现场调查航次, 通过三维荧光光谱结合平行因子分析法对胶州湾海水溶解有机物的荧光特征进行了分析和鉴别, 旨在描述其在雨季的时空变化规律, 讨论不同来源的FDOM与环境因子之间的关系。
1 材料与方法
1.1 样品采集和处理
海水样品于2011年8月19日—9月30日(每周周二、周五)期间采集自胶州湾, 采样站位见图1。各站点采用 Niskon采水器获取表层水样, 水样在船上实验室使用灼烧过的GF/F滤膜(450℃, 4 h)低压抽滤,收集滤液于盐酸预洗并灼烧过的棕色125 mL玻璃小瓶(450℃, 4 h), 保存于冰桶带回实验室, –20℃冷冻保存, 用于荧光光谱的测定。
逐日降雨量、叶绿素a和盐度由胶州湾海洋生态系统国家野外科学观测研究站同步测定。
逐日降雨量: 使用胶州湾生态站 MILOS-52自动气象站资料。
叶绿素测定方法: 取海水样品 500 mL, 使用直径25 mm的Whatman GF/F滤膜低压过滤, 冷冻保存滤膜。采用萃取荧光法, 使用Turner Design Model-10荧光光度计测定, 计算叶绿素a浓度。
盐度测定: 现场调查时, 使用便携式CTD(型号: AAQ1183-1F)同步测定, 选取表层1 m内水柱平均值作为盐度数值。
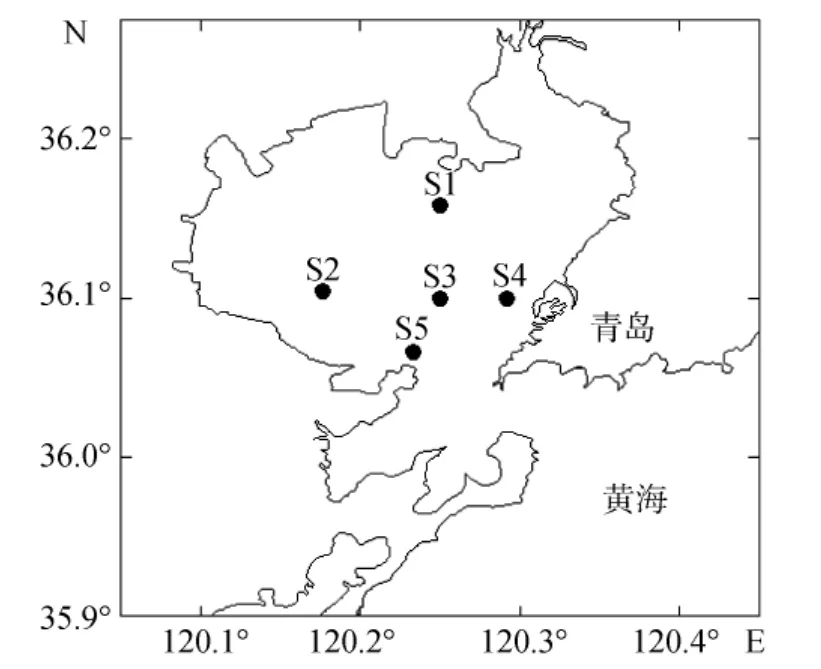
图1 胶州湾取样站位图Fig.1 Map of the sampling stations in the Jiaozhou Bay
1.2 样品测定与分析
使用HITACHI F-4500型荧光分光光度计测定样品三维荧光光谱。采用 3-D Scan模式, 激发波长(Ex)220~450 nm, 发射波长(Em)250~600 nm, 激发与发射狭缝均为5 nm, 扫描速度12 000 nm/min。
水的拉曼散射和瑞利散射对三维荧光光谱影响较大, 本研究采用将瑞利散射区域数据置 0, 以Mill-Q 超纯水做空白消除拉曼散射的做法。使用Mili-Q超纯水在Ex=350 nm处的拉曼峰面积做标准,对得到的荧光数据进行标准化, 得到的荧光强度单位以拉曼单位(RU, nm–1)表示[7]。
使用matlab2010b和DOMfluor 结合平行因子分析法分析三维荧光光谱, 计算各个荧光组分的数据[8]。统计分析采用SPSS 20 软件进行。
2 结果与讨论
2.1 环境特征
在调查的两个月内, 8月份降雨较多(图 2a),从逐日降雨量上可以看到 3次明显的降雨过程。进入 9月后降雨明显减少, 只有1次明显的降雨过程,并且雨量较小。最高降雨量分别出现于 8月 28日(35.2 mm/d)和8月20日(35 mm/d)。从盐度上看, 只有S2和S5站变化较大, 变化范围为23.74~29.74、26.15~30.20, S1, S3和S4站位在调查期间海水盐度变化不大, 波动范围 28.96~30.59。两站位盐度分别在8月30日与9月2日出现低值, 与同期降雨量的高值期略有不同, 说明两站位的盐度可能受到降雨后地表径流的影响较大(图2b)。

图2 胶州湾逐日降雨量及5个调查站位叶绿素a浓度和盐度变化Fig.2 The changes of daily precipitation, concentrations of chlorophyll a and salinity at 5 stations
与此对应, 叶绿素a浓度在8月下旬(8月19日—8月 29日)和9月上旬(8月30日—9月9日)分别出现两个高峰(图2c), 9月中、下旬(9月20日—9月30日)总体较低(P<0.05)。8月21日—8月30日之间, 虽然浓度峰值期略有不同, 但所有站位均有明显的浮游植物水华过程; 9月上旬只有S2和S5站叶绿素a浓度有显著升高。在两个水华过程之间的8月30日, 出现一个统一的低峰, 平均值为(0.92±0.24)mg/m3。叶绿素a在雨季期间平均浓度为(2.42±2.02)mg/m3, 在S2站, S3站和S5站分别出现了6.62 mg/m3, 6.66 mg/m3和7.64 mg/m3的高值, 在夏季末则降低到(0.63±0.46)mg/m3。
2.2 FDOM荧光峰位置与强度
利用 PARAFAC模型对胶州湾海水样品的三维荧光谱图进行解析, 共鉴别出4种荧光组分, 分别为C1(285, 235/330)、C2(270, 360/465)、C3(315, 245/410)、C4(315/525)。根据早期相关文献中最大激发/发射波长与荧光组分性质的关系, 分析了上述 4个组分的来源(表1)。
C1组分包含高、低激发波长的类色氨酸与类酪氨酸荧光峰, 具有典型的类蛋白质荧光特征。早期在关于黑海和阿拉伯海溶解有机物的研究中已经有该组分的报道[1-3]。该组分一般被认为与生物活动密切相关, 浮游植物培养的实验中都发现类蛋白质荧光的增加[13-14]。C1组分在调查期间荧光强度最强, 变化也最明显, 荧光强度平均值0.14± 0.06(图3)。

表1 应用平行因子分析法鉴别出的四种组分的光谱学特征Tab.1 Spectral characteristic of 4 components identified by the PARAFAC
C2组分和C4组分包含一些UV类腐殖质峰与Vis类腐殖质峰。墨西哥湾的研究中发现类似的荧光组分可能是由密西西比河径流输入[9], 而在一些靠近海岸的水环境中也发现类似组分[12], 证明该组分可能受到陆源径流的影响。在本研究中荧光强度较低, 荧光强度相对稳定, 分别为0.07±0.02和0.05± 0.02(图3)。
C3组分的荧光强度为0.09±0.02(图3), 荧光强度相对稳定, 与一些开放海域和封闭海湾发现的荧光组分(290~320/380~420)相似[2,11], 来源可能是现场生物活动。室内实验则证实该组分荧光强度与细菌生物量相关, 该类腐殖质荧光物质的产生与细菌活动有密切关系[15]。
2.3 各组分荧光强度的时间变化
将采样时间划分为3个阶段, 8月下旬、9月上旬和 9月下旬, 可以看出各组分的荧光强度具有明显的季节内变化(图4)。全部4个组分在夏末(9月下旬)强度均显著低于8月下旬和9月上旬(P<0.01), 这种趋势与叶绿素a浓度的变化趋势一致。在8月下旬降雨过程最为密集, 叶绿素浓度在所有站位均显著增加(图2c)。尽管 9月上旬没有明显的降雨过程,但是从盐度上看仍有淡水输入, 并且在局部引起了叶绿素a浓度升高。
C1组分随时间变化比较明显(图3), 在5个站位均出现上升然后下降的趋势, C1组分在S3站的高峰值出现于8月26日, 其他站位在8月30日—9月9日期间内出现高峰值。C2、C3和C4组分随时间波动幅度较小, 仅在S2站, 8月30日时, 这三种组分出现较为明显的高值, 分别为0.148, 0.182, 0.118。
从所有观测数据来看, 4种组分荧光强度与叶绿素a浓度和盐度分别表现出显著的正、负相关关系(表2), 说明降雨和径流输入是引发FDOM浓度变化的重要原因。叶绿素a高浓度期间, 类蛋白组分也出现了相应的高值, 这与De Souza Sierra报道[15]的赤潮水体中溶解有机物有较强的类蛋白荧光相一致。但是, 类蛋白荧光强度的最高值和叶绿素a浓度的峰值之间并没有严格的对应关系。原因在于, 生物对类蛋白类DOM的释放不仅与生物量有关, 而且受到不同发育阶段的影响。历史调查及文献中, 无论是现场测定或者室内培养, 均发现荧光强度并不随浮游植物生物量的增加而显著增加, 在浮游植物的稳定期和衰亡期则发现荧光强度的显著增加[16-18]。闫丽红在长江口区域的研究表明荧光强度与盐度呈负相关[19]。在本研究中, 盐度变化较大的S2站, 8月30日盐度出现低值时, 各组分荧光强度出现高峰值,但是其他站位则没有明显的同步变化。

图3 荧光强度随时间变化Fig. 3 The changes of each component of fluorescence during the investigation periods

图4 四种组分在不同时间段内荧光强度值Fig. 4 The average fluorescence intensity of four components in different period

图5 各组分荧光强度平均值站位分布图Fig. 5 The average fluorescence intensity of each component of at different stations
2.4 各组分荧光强度的空间变化
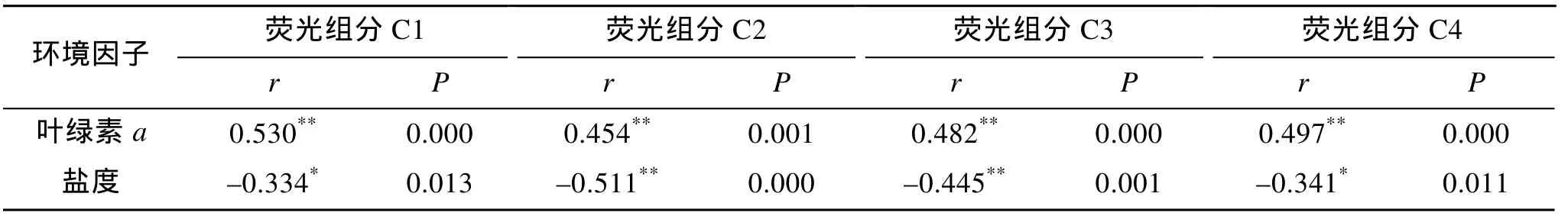
表2 各荧光组分与叶绿素a和盐度的相关性(N=55)Tab.2 The relationship between the fluorescence intensity and chlorophyll a and salinity (N=55)
从整个调查期间的平均值来看, C1组分在S1站最高, 而其他组分都是在S2站最高。方差分析的结果表明, 只有类蛋白组分在S1站明显高于其他站位(P<0.05), 三种类腐殖质组分荧光强度在各个站位无明显差异。S2站距离大沽河口最近, 盐度的变化范围也最大, 说明无论陆源还是海源的类腐殖质相关的DOM都受径流输入控制。胶州湾北部的S1站靠近贝类养殖区域, 而贝类的滤食作用会增加生源物质的周转速率。类蛋白组分的荧光强度与赤潮、浮游动物摄食和分解等生物过程有关[17-18]。分时间段来看, 8月下旬各组分荧光强度在S1站高于其他站位; 9月上旬, 各组分荧光强度最大值出现在S2站; 9月下旬, 各组分荧光强度均降低, 荧光强度最大的站位也转移到S3和S4站。在调查期间, 各组分的荧光强度随时间变化都在降低, 但是最高值呈现出由湾北部逐渐向湾中心与湾口转移的趋势。
3 结论
(1) 三维荧光光谱技术结合PARAFAC模型法很好地分析了胶州湾海水溶解有机物的荧光特征, 鉴别出了类蛋白荧光组分C1(285, 235/330), 陆源类腐殖质组分C2(270, 360/465)、C4(315/525)和海源类腐殖质组分C3(315, 245/410)。根据其荧光强度, 与生物生产相关的类蛋白组分是胶州湾夏季FDOM的主要成分。
(2) 胶州湾夏季水体中的 FDOM主要受降雨和径流影响。在受降雨和径流影响的时间段内, 各组分的荧光强度均显著高于上述影响消退后的时期。
(3) 在雨季, 类蛋白荧光组分在邻近养殖区的S1站最高, 而类腐殖质荧光组分虽然在调查的 5站位之间无显著差异, 但是从荧光强度上看在受径流影响最显著的S2站最高。雨季结束后, 各组分的浓度高值转移到邻近湾口的深水区。
(4) 从总体上讲, 海水中 FDOM 的荧光强度与叶绿素a浓度正相关, 而与盐度负相关, 但是峰值出现的时期略有差异。
致谢: 山东胶州湾海洋生态系统国家野外科学观测研究站提供了叶绿素a和盐度数据支持,“创新号”科学考察船全体船员对本调查给予了大力支持, 谨致谢忱。
[1] Paula G. Coble, Sarah A. Green, Neil V. Blough, et al. Characterization of dissolved organic matter in the Black Sea by fluorescence spectroscopy [J]. Nature, 1990, 348: 432-435.
[2] Coble P G, Del Castillo C E, Bernard A. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep-Sea Res II, 1998, 45: 2195-2223.
[3] Coble P G. Characterization of marine and terrestrial DOM in the seawater using exciting- emission matrix spectroscopy [J]. Marine Chemistry, 1996, 51: 325-346.
[4] Stephen Opsahl, Ronald Benner. Distribution and cycling of terrigenous dissolved organic matter in the ocean [J]. Nature, 1997, 386: 480-482.
[5] Para J, Coble P G, Charriere B, et al. Fluorescence and absorption properties of chromophoric dissolved organic matter (CDOM) in coastal surface waters of the northwestern Mediterranean Sea, influence of the Rhone River [J]. Biogeosciences, 2010, 7: 4083-4103.
[6] Cristina Romera-Castillo, Xosé Antón Álvarez-Salgado, Martí Galí, et al. Combined effect of light exposure and microbial activity on distinct dissolved organic matter pools. A seasonal field study in an oligotrophic coastal system (Blanes Bay, NW Mediterranean) [J]. Marine Chemistry, 2013, 148: 44-51.
[7] Colin A Stedmon, Stiig Markager, Rasmus Bro. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy [J]. Marine Chemistry, 2003, 82: 239-254.
[8] Colin A. Stedmon, Rasmus Bro. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial [J]. Limnology and Oceanography-Methods, 2008, 6: 572-579.
[9] Boehme J, Coble P, Conmy R, et al. Examining CDOM fluorescence variability using principal component analysis: seasonal and regional modeling of three-dimensional fluorescence in the Gulf of Mexico [J]. Marine Chemistry, 2004, 89: 3-14.
[10] Cory R M, Mcknight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinines in dissolved organic matter [J]. Environ. Sci. Technol., 2005, 39: 8142-8149.
[11] Colin A Stedmon, Stiig Markager. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis [J]. Limnology and Oceanography, 2005, 50(2): 686-697.
[12] Youhei Yamashita, Rudolf Jaffe, Nagamitsu Maie, et al. Assessing the dynamics of dissolved organic matter (DOM) in coastal environments by excitation emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC)[J]. Limnology and Oceanography, 2008, 53(5): 1900-1908.
[13] 季乃云, 赵卫红, 王江涛, 等. 胶州湾赤潮暴发水体中溶解有机物质荧光特征[J]. 环境科学, 2006, 27(2): 257-262.
[14] Marta M de Souza Sierra, Olivier F X Donard, Michel Lamotte. Spectral identification and behavior of dissolved organic fluorescent material during estuarine mixing processes [J]. Marine Chemistry, 1997, 58: 51-58.
[15] Nelson N B, Siegel D A, Michaels A F. Seasonal dynamics of colored dissolved material in the Sargasso Sea [J]. Deep-Sea ResⅠ, 1998, 45: 931-957.
[16] Determann S, Reuter R, Wanger P, et al. Fluorescence matter in the eastern Atlantic Ocean: Part I. Method of measurement and neat-surface distribution [J]. Deep-Sea ResⅠ, 1994, 41(4): 659-675.
[17] Rochelle-Newall E J, Fisher T R. Production of chromophoric dissolved organic matter fluorescence in marine and estuarine environments: an investigation into the role of phytoplankton [J]. Marine Chemistry, 2002, 77: 7-21.
[18] 赵卫红, 王江涛, 崔鑫, 等. 海洋浮游植物生长过程中溶解有机物质的三维荧光光谱研究[J].高技术通讯, 2005, 16(4): 425-430.
[19] 闫丽红, 陈学君, 苏荣国, 等. 2010 年秋季长江口口外海域 CDOM 的三维荧光光谱-平行因子分析[J].环境科学, 2013, 34(1): 51-60.
(本文编辑: 康亦兼)
Temporal and spatial variation of fluorescence characteristics of dissolved organic matters during summer of 2011 in Jiaozhou Bay
LU Jing-liang1,2, SUN Song1,3, ZHANG Guang-tao3, ZHAO Zeng-xia3
(1. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Jiaozhou Bay Marine Ecosystem Research Station, Qingdao 266071, China)
Mar., 25, 2013
Dissolved organic matter; fluorescent characteristics; excitation-emission matrix spectroscopy; Jiaozhou Bay
Herein, the temporal and spatial variation of fluorescent characteristics of Dissolved Organic Matter in surface seawater in the Jiaozhou Bay, during August and September of 2011 was studied by using Excitation-Emission Matrix Spectrum (EEMs) combined with Parallel Factor Analysis (PARAFAC). Four fluorescent components including protein-like component (C1), terrestrial humic-like component (C2, C4) and marine humic-like component (C3) were identified by PARAFAC. The intensity of protein-like component was the highest (0.14±0.06), and the intensities of the other three components were close (0.07±0.02, 0.09±0.02 and 0.05±0.02) during the investigation. In late August and early September, the intensities of four components were high, as influenced by rainfall and surface runoff, and then significantly decreased in late September after rainfall. This study shows generally positive correlation between intensity of fluorescent components and chlorophyllawhile negative correlation between intensity of fluorescent components and salinity. It shows that the concentration of FDOM in the Jiaozhou Bay was mainly influenced by biological activities caused by rainfall.
P734.3, O657.3
A
1000-3096(2014)04-0001-06
10.11759/hykx20130325001
2013-03-25;
2013-06-25
国家重点基础研究发展计划(973)项目(2011CB403601);
海洋公益性行业科研专项经费项目(201205018)
鲁景亮(1989-), 男, 硕士研究生, 研究方向: 环境工程;孙松, 通信作者, 博士, 研究员, E-mail: sunsong@qdio.ac.cn
