辅酶Q10对视网膜神经节细胞及高眼压动物模型氧化应激损伤保护作用的研究
2014-03-07王洪周国义林舟桥林丹丹
王洪 周国义 林舟桥 林丹丹
·基础研究·
辅酶Q10对视网膜神经节细胞及高眼压动物模型氧化应激损伤保护作用的研究
王洪 周国义 林舟桥 林丹丹
目的 探讨辅酶Q10对体外培养的人视网膜神经节细胞(RGC)及高眼压动物模型氧化应激损伤的保护所用,并对其作用机制进行分析。方法 体外培养人RGC,辅酶Q10干预,干预后暴露于过氧化氢(H2O2)24 h,通过光镜观察RGC形态改变;CCK-8检测细胞活性改变;用DCFH-DA荧光法检测细胞内活性氧(ROS)水平;流式细胞仪技术检测细胞凋亡情况。高眼压动物模型利用Wistar大鼠巩膜上静脉烧灼模型。辅酶Q10每日胃肠灌注喂养。Tonopen方法检测动物模型眼压水平;利用荧光金上丘逆行标记方法检测存活的RGC。用Western-印迹法检测与氧化应激及凋亡相关的caspase3,cytochrome c,BAX 及BCL2蛋白的表达。结果 辅酶Q10可改善暴露于氧化应激环境中的人RGC活力,并能在一定程度上抑制RGC的凋亡。DCFH-DA法结果表明辅酶Q10能够抑制RGC内ROS的产生。动物模型实验结果显示,巩膜上静脉烧灼术可以稳定地升高动物眼压。辅酶Q10可以保护RGC免受高眼压损伤。Western印迹法结果显示,经辅酶Q10预处理后的RGC及动物模型caspase3,cytochrome c及BAX表达量降低,而抑制凋亡的BCL2表达升高。结论 辅酶Q10对体外培养的人RGC及高眼压动模型具有抗氧化损伤的保护作用,这种保护作用可能与抑制细胞凋亡有关。(中国眼耳鼻喉科杂志,2014,14:165-170,176)
辅酶Q10; 氧化应激损伤; 视网膜神经节细胞; 青光眼
青光眼是一种以视神经萎缩和视野缺损为特征的疾病,最终导致不可逆性视力丧失[1]。据统计,目前全世界有超过6 800万人患有青光眼,其中大约700万人因此致盲,致盲率居全世界致盲性眼病的第二位[2]。有关专家预测,到2020年,全球青光眼患者将增加到7 960万[3]。在西方国家,原发性开角型青光眼(primary open angle glaucoma, POAG)是最常见的青光眼类型[4]。流行病学调查[5]显示,我国以原发性闭角型青光眼(primary angle closure glaucoma,PACG)为最常见的类型。但近年来随着人口老龄化和诊断水平的提高,我国的POAG患病率有上升趋势。尽管目前POAG的确切发病机制尚不十分清楚,但眼压(intraocular pressure, IOP)增高、机械性损伤、遗传异常因素、氧化损伤、谷氨酸水平增高、一氧化氮代谢异常等因素都参与POAG的发病过程[4-5]。近年来越来越多的研究表明,氧化损伤在POAG的发病机制中占有重要作用。
辅酶Q10,也称为泛醌,在线粒体中参与ATP的生物合成,并且其还原形式是一种脂质抗氧化剂,因此,辅酶Q10在氧化代谢过程中起着关键的作用[6]。辅酶Q10是一种比维生素E和其他一些抗氧化剂更有效的脂类抗氧化剂。辅酶Q10可清除活性氧,并回收利用维生素E[7]。辅酶Q10水平的下降被认为是衰老的重要原因之一,并且在许多退化性或慢性疾病,如动脉粥样硬化、帕金森、阿尔茨海默症和白内障的发病机制中起着重要的作用[8]。已经发现,随着年龄的增长,视网膜内辅酶Q10的水平可降低约40%[9]。这种含量的下降可能会降低视网膜的抗氧化能力,并造成视网膜内ATP合成减少。因此,辅酶Q10水平降低可能与年龄相关性黄斑变性的发生和发展有关。在本研究中,我们通过体外及体内实验研究了辅酶Q10对视网膜神经节细胞(retinal ganglion cell,RGC)及高眼压模型的抗氧化作用及其可能的作用机制。
1 材料与方法
1.1 细胞处理 体外常规用DMEM-F12(Hyclone,US)培养基及10%血清(Hyclone,US)培养人RGC(ATCC,RGC-5 视网膜神经节细胞株细胞,货号AA-CELL-5)。培养细胞经过Thy1.1细胞标记进行鉴定。培养细胞经不同浓度辅酶Q10溶液预处理48 h后置于200 μmol/L的过氧化氢(H2O2)溶液中继续孵育2 h。实验分组为:无处理的正常细胞对照组、单纯H2O2处理对照组、10 μmol/L辅酶Q10溶液预处理组、1 μmol/L辅酶Q10溶液预处理组和0.1 μmol/L辅酶Q10溶液预处理组。
1.2 细胞形态学观察 RGC消化传代接种于6孔板中,静置培养24 h后吸弃上清液,更换为无血清培养液,同步化处理24 h,用完全培养液将辅酶Q10储存液稀释为10、1、0.1 μmol/L,分别加入6孔板中。其中正常对照、H2O2对照孔加入完全培养液2 mL,置于细胞培养箱中继续培养48 h。吸弃上清,加入磷酸盐缓冲液(phosphate-buffered saline, PBS)漂洗2次。用基础培养液将H2O2稀释为200 μmol/L,每孔加入2 mL。其中正常对照只加基础培养液。置于培养箱中继续培养2 h。在倒置相差显微镜下观察各组细胞形态变化,并采集图像。
1.3 细胞活性、增殖检测(CCK-8法) 96孔板接种1×104RGC。设立正常对照及单纯H2O2处理2 h对照组。其他组RGC经不同浓度(10、1、0.1 μmol/L)辅酶Q10溶液预处理48 h后,置于200 μmol/L的H2O2溶液中继续孵育2 h。将10%的CCK-8工作液(用完全培养基稀释配制)加入各组样品中,同时设立空白对照(无细胞,只加入CCK-8工作液)。置于培养箱中静置30 min。用酶标仪检测每孔OD值,检测波长为450 nm。每组设立5个复孔,实验重复3次。
1.4 细胞凋亡检测(Annexin V/PI法) 6孔板接种RGC。设立正常对照及单纯H2O2处理3 h对照组。其他组RGC经不同浓度(10、1、0.1 μmol/L)辅酶Q10溶液预处理48 h时后,置于200 μmol/L的H2O2溶液中继续孵育2 h。收集细胞,加入500 μL上样液重悬细胞,分别加入5 μL Annexin V 和10 μL PI 吹打混匀,室温下避光孵育5 min。立即用流式细胞仪检测(ex/em=488/530 nm),用FITC通道(FL1)检测Annexin V,PE通道(FL2)检测PI。
1.5 细胞内活性氧检测(DCFH-DA) 利用荧光探针DCFH-DA进行活性氧检测。细胞内的活性氧可以氧化无荧光的DCFH,生成有荧光的DCF,从而检测细胞内活性氧(ROS)的水平。6孔板接种RGC。设立正常对照及单纯H2O2处理2 h对照组。其他组RGC经不同浓度(10、1、0.1 μmol/L)辅酶Q10溶液预处理48 h后,置于200 μmol/L的H2O2溶液中继续孵育2 h。收集细胞,每管分别加入新鲜置备1 μmol/L DCFH-DA工作液500 μL,重悬细胞吹打混匀,置于37 ℃恒温培养箱内避光孵育30 min。终止孵育,弃探针工作液后,分别加入500 μL PBS重悬细胞。立即用流式细胞仪检测(ex/em= 488/530 nm),每次收集10 000个细胞。实验至少重复3次。
1.6 大鼠高眼压(慢性视神经损伤)动物模型的建立及给药方法 纵向切开3条巩膜上静脉相应处结膜,利用30号烧灼头,以25~30 V电压烧灼2条背侧巩膜上静脉及1条颞侧巩膜上静脉,直至静脉完全阻塞,无血流通过。回复结膜瓣,结膜囊内涂抗生素眼膏,静置大鼠于复温毯直至清醒。所有高眼压模型右眼为实验眼,左眼为对照眼。Tono-Pen XL测量大鼠眼压,取连续的4个读数进行记录,连续4个读数的平均值为该日的日平均眼压,眼压测量均于9:00~10:30进行。对于任意时间点 (除外手术后即刻) 高眼压模型的眼压低于正常对侧眼眼压的1.6倍,或高于对侧眼2.8倍者予以排除。同时用盖玻片压平角膜,观察高眼压动物模型眼底。对于具有缺血表现者也予以排除。
所有大鼠每日给予辅酶Q10灌肠给药,给药剂量为10 mg/kg/day[10],持续4周。4周后处死大鼠进行相关检测。实验分组为:正常大鼠对照组、高眼压模型对照组、PBS对照处理组、辅酶Q10处理组。
1.7 荧光金上丘逆行标记及细胞计数 大鼠置于三维立体定位仪,耳棒固定大鼠头部,尖刀切开顶骨中央皮肤。于冠状缝后6.0 mm水平线上,在矢状缝两侧旁开1.0 mm位置打孔,直径为1.5 mm×1.5 mm。刮除位于上丘之上部分大脑皮质,将配制好的4%荧光金染料 (Fluorochrome, Englewood, Colorado) 经显微注射系统注入两侧上丘各2 μL,明胶海绵填塞缺损区处。5-0黑丝线对位缝合皮肤。高眼压动物模型在实验终止前1周进行标记。
取出眼球后,角膜剪全周剪开巩膜,移去眼前节及玻璃体腔液体。将眼杯浸泡在4%多聚甲醛溶液中固定30 min。剥离视网膜后将其按照4个象限方向剪开,平铺于载玻片上,并在Zeiss荧光显微镜(Carl Zeiss Meditec, Jena, 德国)蓝色光源20×放大倍率情况下进行视网膜图像采集。采集图像时,移动载物台,同时在距离视神经1、2、3 mm处分别采集视网膜图像1张,每个象限采集3张,全视网膜4个象限共12张图片。对所有图片中的RGC进行计数,所有实验的RGC均以OD(右眼)/OS(左眼)%进行计算,RGC计数以均数±标准误进行记录。
1.8 Western印迹法检测Fas蛋白表达量 经过不同处理的RGC以及大鼠视网膜进行蛋白提取,BCA法测定蛋白浓度并绘制标准曲线。加入等量的蛋白Marker及各组蛋白样品进行电泳分离,所有电泳的SDS-PAGE胶为12%。转膜时电流一般不超过0.15 A,电压为20~25 V。转膜2 h,把膜在洗涤缓冲液中洗后,放入20 mL脱脂奶粉(0.05 g/mL)内封闭,4 ℃过夜;取出后在TBST内洗一下后,加入一抗4 ℃过夜;经TBST洗涤后,加二抗振摇1 h,加入发光液进行曝光。一抗为抗caspase3,cytochrome c,BAX 及BCL2抗体,均来源于Cell signaling technology,按照1∶1 000比例进行稀释。Western印迹法重复3次,将胶片扫描,用Image J 软件对曝光的条带进行灰度分析,并进行统计学处理。
1.9 统计学处理 使用Graphpad Prism 5.0统计软件(Graphpad software Inc., Sandiego, CA)进行统计分析。所有实验至少重复3次,计量资料数据以mean±SEM表示,多组之间用单因素方差分析(Oneway ANOVA分析),P<0.05为差异有统计学意义。
2 结果
2.1 辅酶Q10保护H2O2诱导的RGC形态改变 通过倒置相差显微镜观察(图1),200 μmol/L H2O2处理细胞2 h后,形态发生了明显的变化,表现为细胞胞体皱缩变圆,呈空泡状,部分细胞脱壁导致细胞密度减少。相比之下,辅酶Q10(0.1、1、10 μmol/L)干预对RGC具有一定的保护作用,RGC保持相对健康的形态。

图1. 倒置相差显微镜观察不同干预组细胞形态变化 左图control为正常对照;中间图为经过1 μmol/L辅酶Q10处理的RGC;右图为单纯200 μmol/L H2O2处理细胞2 h 后RGC形态。显微镜×100
2.2 辅酶Q10抑制H2O2诱导的RGC增殖抑制及活性降低 如图2所示辅酶Q10预处理组细胞活性较单纯H2O2处理组活细胞数量多,且细胞活性强。1、10 μmol/L的辅酶Q10预处理48 h组与H2O2组相比,差异均有统计学意义。辅酶Q10的这种保护作用呈浓度依赖性,与其浓度呈正相关。实验重复至少3次。
2.3 辅酶Q10抑制H2O2诱导的RGC凋亡 细胞凋亡采用Annexin V/PI双染色,用流式细胞仪定量检测。如图3所示,在给予相同浓度及作用时间(200 μmol/L,2 h)的H2O2的情况下, 给予预处理的辅酶Q10浓度越高,凋亡细胞的百分比越低。0.1 、1、10 μmol/L的辅酶Q10预处理的抗氧化应激抗细胞凋亡作用依次增强,1、10 μmol/L预处理组与单纯H2O2处理组相比,差异有统计学意义。
2.4 辅酶Q10抑制H2O2诱导的RGC内ROS的产生 氧化损伤会导致细胞内ROS生成增加。采用DCFH-DA法流式细胞仪检测。如图4所示,H2O2组与基线相比,有着显著的ROS水平增高;与H2O2组相比,0.1、1、10 μmol/L的辅酶Q10预处理组的细胞内ROS的水平均有所下降,且辅酶Q10的浓度越高,细胞内ROS水平越低,即辅酶Q10抑制ROS产生的作用呈剂量依赖性。其中,1、10 μmol/L的辅酶Q10预处理组与H2O2组相比,差异均有统计学意义。
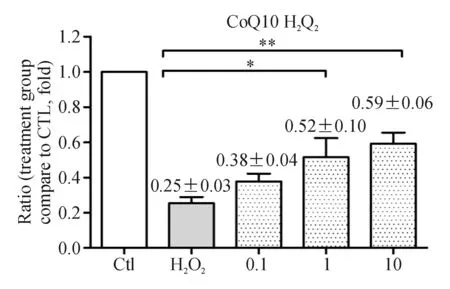
图2. CCK-8法检测细胞活性 0.1,1,10分别表示为0.1、1、10 μmol/L的辅酶Q10预处理48 h组;Ctl为正常对照;H2O2为单纯H2O2处理2 h组;F=8.654,P=0.029 6; 1 μmol/L组P=0.041 2,10 μmol/L组P=0.0016;*P<0.05;**P<0.01
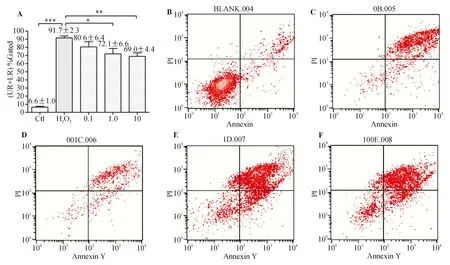
图3. Annexin V/PI双染色,流式细胞仪检测RGC凋亡 A.统计分析柱状图;B. 正常对照组;C. H2O2对照组;D. 0.01 μmol/L辅酶Q10预处理48 h组;E. 1 μmol/L辅酶Q10预处理48 h组;F. 10 μmol/L辅酶Q10预处理48 h组。UR:晚期凋亡细胞(右上方格);LR:早期凋亡细胞(右下方格)。F=9.874,P=0.010 64。1 μmol/L组P=0.031 6,10 μmol/L组P=0.004 0;*P<0.05;**P<0.01;***P<0.001
2.5 辅酶Q10抑制H2O2诱导的RGC caspase3,cytochrome c及BAX表达量,促进抑制凋亡的BCL2表达 如图5所示,氧化损伤会导致RGC内与凋亡相关的caspase3,cytochrome c及BAX表达增加,以及使抑制凋亡的BCL2表达量减少。与H2O2处理组相比,1、10 μmol/L的辅酶Q10预处理组的细胞内caspase3,cytochrome c及BAX表达水平均有所下降,而BCL2表达增加。且辅酶Q10的浓度越高,细胞内凋亡相关蛋白水平越低,即呈剂量依赖性。
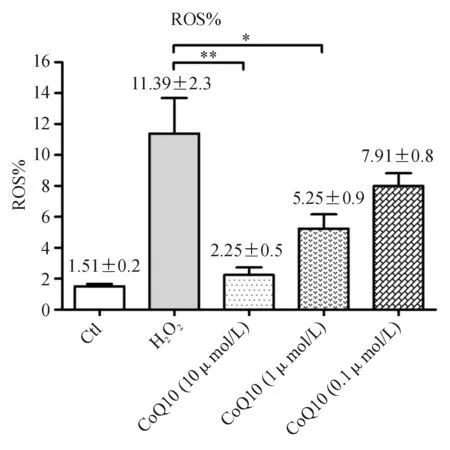
图4. DCFH-DA法流式细胞仪检测RGC内ROS水平 统计分析柱状图显示辅酶Q10抑制ROS产生的作用呈剂量依赖性F=7.745 6,P=0.021 7,n=5。1 μmol/L组P=0.028 4,10 μmol/L组P=0.007 3;*P<0.05;**P<0.01
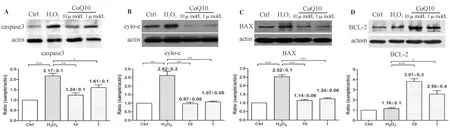
图5. Western印迹法检测RGC caspase3,cytochrome c,BAX及BCL2蛋白表达 图A、B、C、D分别显示Western印迹法检测caspase3,cytochromec,BAX及BCL2蛋白的条带及统计分析柱状;F=9. 956,P=0.013,n=3,*P<0.05;**P<0.01;***P<0.001
2.6 辅酶Q10保护高眼压模型神经节细胞存活 高眼压模型建立的成功与否关键需要对眼压进行检测。在本动物模型中,如图6所示,建模即刻眼压骤升,随后趋于平稳,但始终保持在20 mm Hg(1 mm Hg=0.133 kPa)以上的眼压, 说明此动物模型在4周的建模时间内为稳定的高眼压模型。
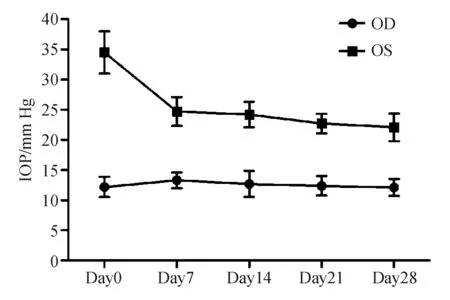
图6. 高眼压动物模型眼压曲线图 OD:右眼;OS:左眼;IOP:眼压
RGC是青光眼性视神经损伤中最主要的受累细胞。在高眼压模型中,RGC计数也是最关键的评价指标。如图7所示,高眼压模型中,RGC的存活率与正常视网膜相比为(71.15±1.13)%,PBS对照组的存活率为(72.51±1.93)%,而辅酶Q10处理组的RGC存活率为(85.33±2.41)%,明显高于未处理组网膜。
2.7 辅酶Q10抑制高眼压模型中caspase3,cytochrome c及BAX表达量,而促进抑制凋亡的BCL2表达 如图8所示,高眼压损伤会导致高眼压模型视网膜与凋亡相关的caspase3,cytochrome c及BAX表达增加,以及使抑制凋亡的BCL2表达量减少。与单纯青光眼模型相比,辅酶Q10经胃肠给药的大鼠视网膜中caspase3,cytochrome c及BAX表达水平均减低,而BCL2表达增加。
3 讨论
RGC位于视网膜最内层,将视觉信息传递至大脑。目前认为青光眼致视功能损害的共同病理基础是神经节细胞的进行性死亡和神经纤维丢失,导致不可逆性视神经萎缩和视野改变,构成青光眼的最终改变[11]。许多因素如高眼压、氧化损伤、视网膜缺血再灌注损伤等都可能与RGC凋亡有关[11]。作为人体内代谢较活跃的细胞之一,RGC更易受到氧化损伤[12]。在正常视网膜,代谢过程中产生的氧自由基能被机体自身的抗氧化系统中和;而在青光眼患者,过度产生的氧自由基超过了机体的抗氧化能力,最终导致RGC发生细胞凋亡。
辅酶Q10是一种内源性抗氧化剂,是机体自身存在的物质,且目前临床上已应用于许多其他疾病,这是其药物安全性的保障。据文献报道口服辅酶Q10,人体血清中、线粒体及心肌内的辅酶Q10水平升高[13]。因此,给予辅酶Q10外源补充后,视网膜内辅酶Q10含量可以适当提高,这也构成了本研究的实验基础。几乎所有的人体组织,包括心、肺、脾、肾、肝、胰腺、肾上腺等组织,辅酶Q10的含量都随着年龄的增长而下降[13-14]。由于辅酶Q10在体内作用的广泛性,认为它的下降与老化及许多退化性和(或)慢性疾病的发生、发展密切相关。辅酶Q10参与ATP在线粒体内的生物合成,在氧化代谢中起着不可或缺的作用。此外,其还原形式有抗脂质过氧化作用[13-14]。辅酶Q10能保护细胞膜磷脂脂质过氧化,保护线粒体膜蛋白质和DNA免受氧化损伤[13]。已发现血浆中的辅酶Q10水平随着年龄的增长而下降。辅酶Q10的保护作用机制尚不清楚。在本研究中,我们试图研究辅酶Q10是否可以在体内和体外保护氧化损伤的RGC和高眼压的视网膜组织。
本研究探讨了辅酶Q10对H2O2诱导的体外培养的人RGC氧化损伤的保护作用。H2O2是最常用的氧化剂之一,并且在青光眼患者前房水以及玻璃体液中均能检出。作为RGC的氧化损伤诱导剂,H2O2在体外

图7. 上丘逆行标记荧光金显示CoQ10可以延缓青光眼模型RGC死亡 分别在视网膜的不同部位选取RGC进行拍照计数,经统计显示辅酶Q10可以延缓高眼压所致的RGC死亡
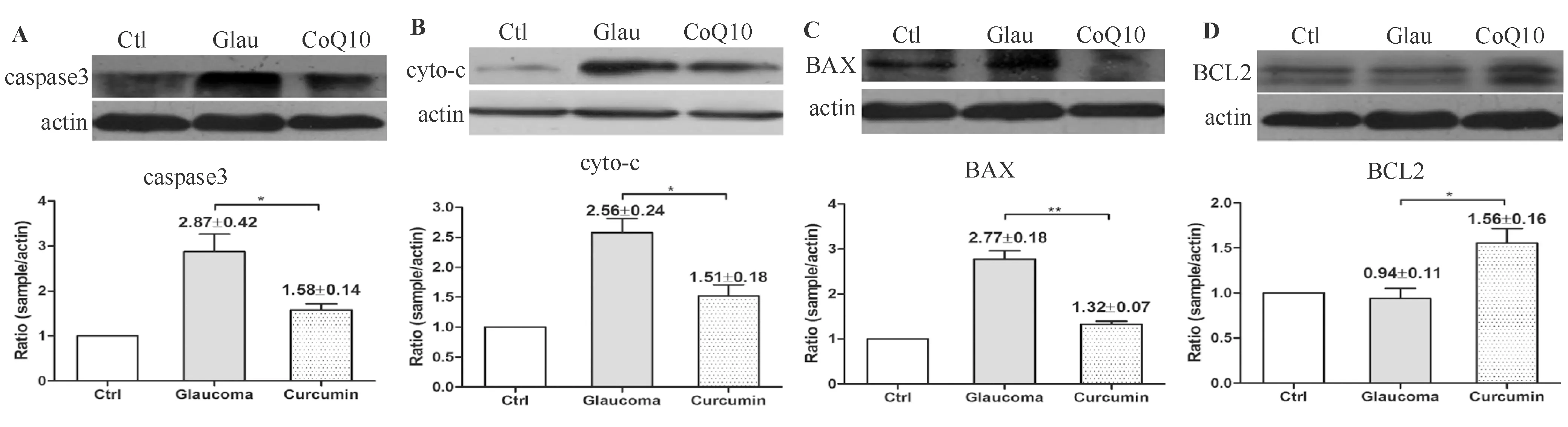
图8. Western印迹法检测高眼压模型视网膜中caspase3,cytochrome c,BAX及BCL2蛋白表达 图A、B、C、D分别显示Western印迹法检测caspase3,cytochrome c,BAX及BCL2蛋白的条带及统计分析柱状。与对照组相比,差异均有统计学意义(*P<0.05,**P<0.01,***P<0.001)
能诱导 ROS 产生和细胞凋亡,因此被广泛用于各种急性和(或)慢性氧化损伤模型[14]。我们的研究结果显示了H2O2对RGC样细胞(RGC-5细胞系)具有氧化损伤的作用,并呈现时间依赖性。随着时间的延长,其损伤逐渐加深。虽然RGC-5细胞系并非真正的人RGC,但是在我们的前期观察中发现,RGC-5细胞株可以表达神经细胞特异的Thy1.1标记,因此具有一定的研究意义。在我们的实验中,通过分子生物学手段证实了辅酶Q10可以抑制H2O2对RGC造成的损伤,其可能的机制是通过抑制细胞的氧化损伤,抑制凋亡相关因子如caspase-3、cyto-c、BAX等,同时上调凋亡抑制因子BCL-2而起作用的。同时,为了进一步验证我们的体外结果,我们在高眼压动物模型上也进行了验证。而在Wistar动物模型中的结果与体外结果一致,更进一步证实了该结果的可靠性。
以往关于辅酶Q10在眼科的应用及相关的基础研究很少。我们的研究结果提示,辅酶Q10在体外有抗氧化损伤、保护RGC样细胞的作用,在体内可以通过抗凋亡作用,保护高眼压模型视网膜免受损伤,因此提示辅酶Q10可能成为一种有前景的青光眼神经保护治疗药物之一。虽然本实验中对于辅酶Q10在氧化损伤中的作用机制及高眼压动物模型中的保护机制进行了一定的探索,但鉴于氧化损伤与线粒体代谢有着极为重要的关系,因此,还需要在下一步的实验研究中对线粒体的形态、功能及呼吸链进行深入的研究与探索。
志谢:感谢温州医科大学基础实验平台帮助构建动物模型,桑迪亚医药技术(上海)有限责任公司帮助完成有关细胞试验及细胞检测项目和动物模型构建成功后的组织检测。
[ 1 ] Fan BJ , Wiggs JL . Glaucoma: genes, phenotypes, and new directions for therapy [J]. J Clin Invest, 2010, 120(9):3064-3072.
[ 2 ] Majsterek I, Malinowska K, Stanczyk M, et al. Evaluation of oxidative stress markers in pathogenesis of primary open-angle glaucoma[J]. Exp Mol Pathol, 2011, 90(2):231-237.
[ 3 ] Wang L, Zhang X, Cai S, et al. Correlated or not: Glaucoma prevalence and modern industrialization [J]. Med Hypotheses, 2011, 76(2):220-224.
[ 4 ] Resnikoff S, Pascolini D, Etya′ale D, et al. Global data on visual impairment in the year 2002 [J]. Bull World Health Organ, 2004, 82(11):844-851.
[ 5 ] Liang Y, Friedman DS, Zhou Q, et al. Prevalence and characteristics of primary angle-closure diseases in a rural adult Chinese population: the Handan Eye Study[J]. Invest Ophthalmol Vis Sci, 2011, 52(12):8672-8679.
[ 6 ] Frei B, Kim MC, Ames BN. Ubiquinol-10 is an effective lipid-soluble antioxidant at physiological concentrations [J]. Proc Natl Acad Sci USA, 1990, 87(12):4879-4883.
[ 7 ] Yildirim Z, Ucgun NI, Yildirim F. The role of oxidative stress and antioxidants in the pathogenesis of age-related macular degeneration [J]. Clinics (Sao Paulo), 2011, 66(5):743-746.
[ 8 ] Dusting GJ, Triggle C. Are we over oxidized? Oxidative stress cardiovascular disease, and the future of intervention studies with antioxidants [J]. Vasc Health Risk Manag, 2005, 1(2):93-97.
[ 9 ] Qu J, Kaufman Y, Washington I. Coenzyme Q10 in the human retina [J]. Invest Ophthalmol Vis Sci, 2009, 50(4):1814-1818.
[10] Rosenfeldt FL, Pepe S, Linnane A, et al. Coenzyme Q10 protects the aging heart against stress: studies in rats, human tissues, and patients[J]. Ann N Y Acad Sci, 2002, 959: 355-359; discussion 463-465.
[11] Ray K, Mookherjee S. Molecular complexity of primary open angle glaucoma: current concepts [J]. J Genet, 2009 , 88(4):451-467.
[12] Chrysostomou V, Trounce IA, Crowston JG. Mechanisms of retinal ganglion cell injury in aging and glaucoma[J]. Ophthalmic Res, 2010, 44(3):173-178.
[13] Bliznakov EG. Aging, mitochondria, and coenzyme Q10: the neglected relationship [J]. Biochimie (Paris), 1999, 81(12):1131-1132.
[14] Haudek VJ, Gundacker NC, Slany A, et al. Consequences of acute and chronic oxidative stress upon the expression pattern of proteins in peripheral blood mononuclear cells [J]. J Proteome Res, 2008,7(12):5138-5147.
(本文编辑 诸静英)
Protective effect of coenzyme Q10 for retinal ganglion cells and glaucoma against oxidative stress injury
WANGHong,ZHOUGuo-yi,LINZhou-qiao,LINDan-dan.
DepartmentofOphthalmology,People’sHospitalofLeqinginZhejiangProvince,Leqing325600,China
WANG Hong, Email: wg_2009@126.com
Objective To investigate the protective effect of coenzyme Q10 (CoQ10) for retinal ganglion cells (RGC) and glaucoma against oxidative stress injury, and to analyze its potential mechanisms. Methods The RGC line was used for theinvitrostudies. RGCs were pretreated with 10, 1, 0.1μmol/L CoQ10 for 1 h, and sustained oxidative stress was induced by subjecting RGCs to 200 μmol/L hydrogen peroxide (H2O2) for 24 h. CCK-8 assay was used to determine cell viability. Changes of intracellular reactive oxygen species (ROS) and apoptosis were analyzed by DCFG-DA and flow cytometry. Three episcleral veins were cauterized to induce high intraocular pressure (IOP) in Wistar rats and the IOP was measured by Tonopen. The rats were fed with CoQ10 every day. Surviving RGCs were quantified. Activation of caspase3, cytochrome c, BAX and BCL2 was quantified by Western blotting in RGCs bothinvitroandinvivo. Results Theinvitrostudy showed that when RGCs were pretreated with CoQ10, the cell viability increased; while the intracellular ROS and apoptosis significantly decreased. In theinvivostudy, chronic mild IOP elevation was induced for 4 weeks. In the CoQ10-treated rats, CoQ10 protected the RGCs from death. In both H2O2-treated RGCs and RGCs in the glaucoma model, caspase3, cytochrome c and BAX were down-regulated and BCL2 was up-regulated in CoQ10 treated groups. Conclusions CoQ10 was shown to have protective effect for RGC cells and glaucoma against oxidative stress damage. The protective effect may be associated with the down-regulation of pro-apoptotic proteins. (Chin J Ophthalmol and Otorhinolaryngol,2014,14:165-171,176)
Coenzyme Q10; Oxidative stress injury; Retinal ganglion cell; Glaucoma
浙江省乐清市人民医院眼科 乐清 325600
王洪(Email:wg_2009@126.com)
2013-11-07)
