金黄色葡萄球菌SirH主要抗原表位区的表达及其抗血清制备
2014-03-06刘丽娜胡祖权钟乃凤谭承建
刘丽娜,张 洁,周 静,胡祖权,贾 义,钟乃凤,谭承建
(1.贵阳医学院生物技术教研室,贵州贵阳550004;2.贵州民族大学化学与环境科学学院,贵州贵阳550025)
金黄色葡萄球菌(Staphylococcus aureus,SA)是一种重要的人兽共患病病原菌[1],是引起奶牛乳房炎的主要病原菌。此菌感染奶牛后,会在乳腺内迅速增殖,造成组织损伤,最终导致奶牛产奶量和奶质量的下降。在世界范围内,奶牛乳房炎是造成奶牛养殖业主要经济损失的疾病之一[2],兽医临床上主要依赖使用抗生素来进行预防和治疗奶牛乳房炎[3]。目前,牛奶安全问题越来越受到政府及民众的关注,全世界都在呼吁限制抗生素和治疗性药物在奶牛上的使用,众多研究者们设法从疫苗着手研究防控对策[4-5]。
作为机体免疫应答的刺激因子,表面暴露蛋白、分泌蛋白和毒力相关因子是具有吸引力的疫苗候选抗原[6-8]。SirH是铁调控细胞壁锚定蛋白,位于金黄色葡萄球菌表面,被认为是有潜力的疫苗候选抗原。本研究对SirH主要抗原表位区的编码序列进行原核表达,并利用纯化的重组蛋白制备多克隆抗体,为进一步研究SirH疫苗奠定基础。
1 材料与方法
1.1 材料
金黄色葡萄球菌临床分离株、大肠埃希菌DH 5α和BL21由贵阳医学院生物技术教研室培养和保存;质粒pGEX-4T-1为贵阳医学院生物技术教研室保存;限制性核酸内切酶BamHⅠ、XhoⅠ、T4DNA连接酶、Ex Taq DNA聚合酶、dNTP为宝生物工程(大连)有限公司产品;6月龄新西兰大白兔为山东大学实验动物中心产品;HRP标记的羊抗兔IgG为北京中杉公司产品;HRP标记的山羊抗牛IgG为北京华美生科生物技术有限公司产品;弗氏完全佐剂、弗氏不完全佐剂为Sigma公司产品;引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 生物信息学分析 以SirH的氨基酸序列为基础,用DNA Star软件预测其B细胞抗原表位,用Syfpeithi软件预测其T细胞抗原表位,综合分析确定SirH的主要抗原表位区。
1.2.2 SirH主要抗原表位区编码序列的扩增及重组表达载体的构建 根据sirH基因637nt-1 377nt的序列设计合成引物,进行PCR扩增。上游引物为:5′-CCGGGATCCAAGTTGCCAATTAAATTAGTATC-3′,带BamHⅠ酶切位点,下游引物 为:5′-CCGCTCGAGTTCTTTATCAACGAT-TCTGACATGG-3′,带XhoⅠ酶切位点。回收PCR产物用BamHⅠ和XhoⅠ双酶切后,与用BamHⅠ和XhoⅠ线性化的表达载体pGEX-4T-1于16℃水浴连接18h。连接产物转化DH 5α感受态细胞,摇菌培养提取质粒,酶切鉴定。阳性克隆送上海英骏生物技术有限公司测序并对测序结果进行分析,测序正确的质粒命名为pGEX4T1-sirH。
1.2.3 重组蛋白的表达及表达产物的形式鉴定将重组表达载体pGEX4T1-sirH转化大肠埃希菌BL21,菌液培养至OD600nm达到0.8左右时,加入终浓度为1mmol/L IPTG诱导,于诱导0、2、4、6、8h取样,同时用空载体菌作为对照,采用SDSPAGE分析重组SirH的表达。将5mL诱导表达的菌液以8 000r/min离心10min,收集菌体,用PBS悬浮菌体,超声破菌后,离心分别收集上清及沉淀样品进行SDS-PAGE电泳,分析重组表达产物的表达形式。
1.2.4 表达产物的纯化 收集超声破菌后的上清液,加Triton X-100至终浓度为1%,室温作用30min,上样于Glutathione Sepharose 4B亲和层析柱中,用20mL预冷的1×PBS洗柱,用含5mmol/L还原型谷胱甘肽的50mmol/L Tris-HCl 5mL洗柱,收集洗脱液,反复洗柱2次,收集的样品用120g/L分离胶进行SDS-PAGE鉴定。
1.2.5 Western blot分析 取10μL纯化蛋白,加入等体积2倍SDS上样缓冲液,沸水中变性5min后进行SDS-PAGE,然后电转移至NC膜上,用含10g/L BSA的TTBS液4℃封闭过夜。封闭后的NC膜置于适当稀释的乳房炎患病奶牛恢复期血清中,37℃摇床反应1h。TTBS液洗膜后,用HRP标记的山羊抗牛IgG作为二抗,37℃摇床反应30min,最后DAB显色至目的条带清晰时终止反应。
1.2.6 兔多抗的制备 选健康的6月龄新西兰大白兔,第1次按500μg纯化重组蛋白加等体积弗氏完全佐剂乳化后进行背部皮下多点注射;2周后,以等量抗原加等体积弗氏不完全佐剂乳化后第2次背部皮下多点注射;间隔2周后,同第2次免疫方法进行第3次注射;再次间隔2周后心脏采血,分离血清。
1.2.7 间接ELISA测定抗血清效价 用纯化重组蛋白按0.2μg/mL包被96孔板,抗血清和免疫前阴性血清分别从1∶400开始倍比稀释,羊抗兔IgGHRP 1∶3 000稀释,酶标仪检测不同稀释度抗血清和免疫前阴性血清孔OD450nm值,以P/N>2.1的最高血清稀释倍数作为抗血清效价。
2 结果
2.1 SirH主要抗原表位区分析
综合DNA Star和Syfpeithi软件分析预测的结果,确定SirH主要抗原表位区位于213-459氨基酸残基处。
2.2 重组表达载体的构建和鉴定
以金葡菌基因组DNA为模板进行PCR扩增,PCR产物用BamHⅠ和XhoⅠ双酶切后,与预先用BamHⅠ和XhoⅠ线性化的表达载体pGEX-4T-1连接构建重组表达载体pGEX4T1-sirH。转化感受态DH 5α,挑取单克隆摇菌并提取质粒,用BamHⅠ和XhoⅠ进行双酶切,琼脂糖凝胶电泳后得到1条约759bp的目的条带和1条约5 000bp的载体条带(图1),与试验设计相符。测序结果表明,插入的DNA片段序列正确,为SirH主要抗原表位区编码序列,且读框正确。

图1 重组表达质粒pGEX4T1-sirH的双酶切鉴定Fig.1 Identification of recombinant plasmid pGEX4T1-sirH by double enzymes digestion
2.3 重组表达载体pGEX4T1-sirH在E.coli中的表达和重组蛋白的纯化
收集培养的重组工程菌进行SDS-PAGE分析,以空载体为对照,发现在54ku附近出现1条新的蛋白带,与预计分子质量大小相符。收集菌体经超声破菌后,离心分别取上清和沉淀进行SDS-PAGE检测,结果显示上清和沉淀中都有目的蛋白存在。收集菌体超声裂解上清,GST亲和层析纯化重组蛋白,经SDS-PAGE检测显示获得了纯化的重组蛋白SirH (图2)。
2.4 纯化重组蛋白的Western blot分析
如图3所示,纯化蛋白SirH能与乳房炎患病奶牛恢复期血清发生阳性反应,说明获得的纯化重组蛋白SirH具有较好的反应原性。
2.5 兔多抗的制备及抗体效价测定
用纯化重组蛋白SirH免疫新西兰大白兔后,心脏采血,收集血清,间接ELISA检测抗血清效价。如图4所示,血清稀释倍数为1∶819 200时,P/N<2.1,故抗体效价为1∶409 600。

图2 融合蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of purified fusion proteins

图3 融合蛋白的Western blot分析Fig.3 Western blot analysis of purified fusion proteins
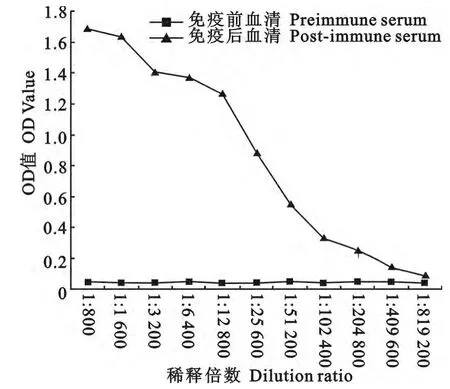
图4 兔多抗血清的效价测定Fig.4 Titer detection of rabbit polyclonal antibodies against SirH
3 讨论
金黄色葡萄球菌是一种可以引起人和动物多种疾病的重要致病菌[9-10],也是引起奶牛乳房炎的主要病原菌,目前主要使用抗生素和治疗性药物来预防和治疗此病,但是抗生素的耐药性、药物残留等问题一直是世界范围内亟待解决的难题[11-12]。疫苗免疫是预防和控制传染病最有效的手段,但是目前仍然没有有效的金黄色葡萄球菌疫苗可供临床使用,免疫候选分子的筛选已成为疫苗研究的一个方向。
研究表明,理想的金黄色葡萄球菌疫苗候选抗原应该既能诱导机体的细胞免疫应答,又能刺激机体产生体液免疫应答[13]。因此,本研究在预测表面蛋白SirH的主要抗原表位区时,既分析了T细胞抗原表位,又分析了B细胞抗原表位,希望最后获得的重组蛋白既含有T细胞抗原表位,又含有B细胞抗原表位,能同时诱导机体的体液免疫应答和细胞免疫应答。
本研究通过基因工程手段实现了金黄色葡萄球菌SirH主要抗原表位区编码序列在大肠埃希菌中的表达,表达产物中既有包涵体形式表达的蛋白,又有可溶性表达的蛋白。为了使重组蛋白保持天然构象,选用可溶性表达的重组蛋白进行纯化。用纯化的重组蛋白免疫家兔获得了高效价的抗血清,说明SirH主要抗原表位区能刺激机体产生有效的体液免疫应答,该研究为后续探讨抗血清的作用和该纯化蛋白的免疫保护作用奠定了基础。
[1]Yin R L,Li C,Yang Z T,et al.Construction and immunogenicity of a DNA vaccine containing clumping factor A of Staphylococcus aureus and bovine IL18[J].Vet Immunol Immunopathol,2009,132(2-4):270-274.
[2]Wallemacq H,Bedoret D,Pujol J,et al.CD40triggering induces strong cytotoxic T lymphocyte responses to heat-killed Staphylococcus aureus immunization in mice:a new vaccine strategy for staphylococcal mastitis[J].Vaccine,2012,30(12):2116-2124.
[3]Zecconi A,Piccinini R,Fox L K.Epidemiologic study of intramammary infections with Staphylococcus aureus during a control program in nine commercial dairy herds[J].J Am Vet Med Assoc,2003,223(5):684-688.
[4]Maira-Litrán T,Bentancor L V,Bozkurt-Guzel C,et al.Synthesis and evaluation of a conjugate vaccine composed of Staphylococcus aureus poly-N-acetyl-glucosamine and clumping factor A[J].PLoS One,2012,7(9):e43813.
[5]Pereira U P,Oliveira D G,Mesquita L R,et al.Efficacy of Staphylococcus aureus vaccines for bovine mastitis:A systematic review[J].Vet Microbiol,2011,148(2-4):117-124.
[6]KylväjäR,Kankainen M,Holm L,et al.Adhesive polypeptides of Staphylococcus aureus identified using a novel secretion library technique in Escherichia coli[J].BMC Microbiol,2011,11:117.
[7]马康康,李忠玉.沙眼衣原体疫苗候选抗原研究进展[J].微生物学免疫学进展,2012,40(1):60-63.
[8]王 磊,李天松,刘玉秀,等.犬瘟热新型疫苗研究进展[J].动物医学进展,2011,32(3):99-103.
[9]许君艳,姚运亮,李 杰,等.金黄色葡萄球菌Hla基因的原核表达及其溶血活性鉴定[J].动物医学进展,2013,34(3):21-24.
[10]冯 昊,刘乐锋,迟佳琦.金黄色葡萄球菌凝集因子A的免疫原性[J].生物工程学报,2009,25(8):1180-1186.
[11]Leitner G,Lubashevsky E,Trainin Z.Staphylococcus aureus vaccine against mastitis in dairy cows,composition and evaluation of its immunogenicity in a mouse model[J].Vet Immunol Immunopathol,2003,93(3-4):159-167.
[12]史 红,王 娟,郑增忍,等.金黄色葡萄球菌耐药性及肠毒素分型研究[J].动物医学进展,2012,33(6):87-90.
[13]Spellberg B,Daum R.Development of a vaccine against Staphylococcus aureus[J].Semin Immunopathol,2012,34(2):335-348.
