伊维菌素PLA及PLGA微球混悬液在犬体内的药代动为学研究
2014-03-05肖田安怀彬彬李帅鹏陈杖榴黄显会
肖田安,怀彬彬,李帅鹏,陈杖榴,黄显会
(1广东省兽药饲料质量检验所,广东广州 510230;2华南农业大学兽医学院,广东 广州 510642)
伊维菌素(Ivermectin,IVM)属于大环内酯类抗生素,因其广谱、高效、低毒的特性被广泛应用于动物体内外多种寄生虫的治疗.同时伊维菌素与其他抗寄生虫药无交叉耐药性,国内外亦出现伊维菌素搭配其他不同种类药物的复方制剂以期得到更广、更好的抗寄生虫效果[1-2].目前,伊维菌素的剂型研究有很多种,包括注射液、乳剂、喷剂、预混剂、浇泼剂、片剂、缓释巨丸剂、粉剂等,兽医临床批准使用且应用最多的剂型还是普通注射剂.但是普通注射剂存在单次给药药效维持时间较短,需多次给药的缺点[3].目前国外已经成功研制出伊维菌素长效控释剂,并投入应用.微球(Microspheres,MS)是近些年出现并快速发展的新型长效控释剂,以天然或人工合成的高分子材料作为药物载体,具有控制释放、靶向给药、降低毒副作用等特点.微球制剂在人医上应用广泛,兽医中的应用主要集中在疫苗制备和皮下埋植促生长等领域[4],少数开始应用于抗寄生虫药控制体内外寄生虫[5-6].研究伊维菌素微球的药代动力学(简称药动学),可准确认识其在体内的释药规律.本试验旨在通过对伊维菌素聚乳酸(Poly lactic acid,PLA)、乙交酯丙交酯共聚物(Poly lactic-co-glycolic acid,PLGA)微球在犬体内药动学的研究,评价其体内释药特征,为伊维菌素长效控释制剂的研制及在犬的临床应用提供理论依据.
1 材料与方法
1.1 药品与试剂
伊维菌素对照品(含B1a质量分数92.0%,B1b质量分数2.14%,由中国兽药监察所提供),阿维菌素对照品(含B1a 99.0%,由广东省兽药监察所提供),伊维菌素原料(质量分数为96.72%,由广东省农科院兽医研究所药物研究室提供),聚乳酸(PLA)(相对分子质量为50 000,由山东省医药研究所提供),乙交酯丙交酯共聚物(PLGA)[m(LA)∶m(GA)=90∶10,由浙江省医学院计划生育研究所合成室提供],甲醇、乙腈为色谱纯,其他试剂均为分析纯.
伊维菌素PLA微球:平均粒径184μm,质量分数为24.79%;伊维菌素PLGA微球:平均粒径298 μm,质量分数为24.72%,均由华南农业大学药理实验室通过溶剂挥发法研究制备.伊维菌素微球混悬液:分别称取伊维菌素PLA和PLGA微球适量,用稀释液配成含伊维菌素0.05 g·mL-1的混悬液即得.伊维菌素普通注射液:称取伊维菌素原料适量,用稀释液配成含伊维菌素0.005 g·mL-1的混悬液即得.
1.2 仪器设备
HP1100高压液相色谱仪(带1046荧光检测器,美国惠普公司),EBA-8S离心机(德国 Hettich公司),MS1型漩涡混合器(IKA公司),电子分析天平(AE 160型,瑞士Mettler公司),HY-4型调速多用振荡器(广州市富城仪器厂).
1.3 溶液配制
标准品贮备液:取伊维菌素标准品,用甲醇溶解,配成500μg·mL-1,置4℃条件下保存;临用前用甲醇稀释成系列工作液,当日使用.内标贮备液:内标为阿维菌素,准确称取13.70 mg,溶于100 mL甲醇中,置4℃条件下保存;临用前配成5.20 μg·mL-1的溶液,2~3 d内使用.注射用稀释液:称取2 g羧甲基纤维素钠,用100 mL V(吐温20)∶V(生理盐水)=1∶97的混合液溶解即得.衍生化试剂:按体积比2∶3∶9的比例,将N-甲基咪唑、乙酸酐和N,N-二甲基甲酰胺混合均匀即得.临用时现配.
1.4 试验动物与给药
18只Beagle犬,购自顺德实验动物研究所,11月龄左右,平均体质量为(11.97±0.24)kg.每犬1笼,按常规饲养管理,正常饮水与采食,犬粮不含任何抗寄生虫药物.临床观察1周,表现健康.18只Beagle犬随机分成3组,每组6只,分别皮下注射伊维菌素普通注射液、伊维菌素PLA微球混悬液及伊维菌素PLGA微球混悬液,其中普通注射液的给药剂量为0.3 mg·kg-1,微球组给药剂量均为3 mg·kg-1.
1.5 血样采集
给犬佩戴保护头套,1人协助保定.随机分3组,分别按“1.4”所述剂量颈部皮下注射,给药前采集空白血样.伊维菌素普通注射液皮下注射给药后分别于 30 min和 1、2、4、8、12 h、1、2、4、10、16、23、30 d自前臂静脉采集血样.伊维菌素PLA及PLGA微球混悬液皮下注射给药后分别于30 min和 1、2、4、8、12 h、1、2、4、10、16、23、30、35、42、49、56、70、84、98、112、126、140 d自前臂静脉采集血样.每次采集5 mL左右,肝素抗凝,4 000 r·min-1离心10 min,分离血浆,置于-20℃冰箱,待测.
1.6 血药浓度测定
1.6.1 血浆样品前处理 取血浆1 mL,置于10 mL的试管中,加入内标工作液40μL(200 ng),混合均匀,加入5 mL乙醚,加盖,以120 r·min-1往返振荡20 min,收集乙醚层,重复提取1次,合并2次乙醚提取液,置于尖底玻璃带盖离心管中,用氮气流于50~55℃下挥发至干.向上述离心管中加入200μL衍生试剂,漩涡振荡使残留物溶解,加盖,置95~100℃水浴中,加热反应1 h,取出,在室温下放置10 min后,加入0.3 mL乙腈,混合均匀,过膜,上机检测.
1.6.2 标准曲线和最低检测限 准确量取950μL空白血浆,添加50μL伊维菌素对照品工作液,分别配制 0.1、0.2、0.5、1.0、2.0、5.0、10.0、15.0、20.0、25.0、40.0 ng·mL-1系列质量浓度的加标样品,再向各样品中加入内标工作液40μL(200 ng),涡旋混匀,放置 30 min.按“1.6.1”方法处理样品,按“1.7”色谱条件进行测定,根据结果确定最低检测限.将伊维菌素与内标的色谱峰面积之比作为纵坐标(y),相对应的药物质量浓度作为横坐标(x)作图,求得标准曲线方程和相关系数,共作5个批次.
1.6.3 回收率和精密度 精密吸取伊维菌素对照品工作液,加入到空白血浆中,制备低(5 ng·mL-1)、中(10 ng·mL-1)、高(20 ng·mL-1)3个质量浓度水平的样品.按“1.6.1”方法处理样品,按“1.7”色谱条件进行测定,每批次每个质量浓度设5个平行样品,共5个批次,以样品伊维菌素峰面积与标准溶液衍生化后上机测定的伊维菌素峰面积之比,求得低、中、高3种浓度的回收率,分别计算批内和批间变异系数.
1.7 色谱条件
色谱柱:C18,150.0 mm×4.6 mm×3.0μm,美国Supelco公司;流动相:V(乙腈)∶V(甲醇)∶V(水)=20∶75∶5;流速:1.25 mL·min-1;进样体积:50μL;荧光检测器:激发波长365 nm,发射波长465 nm.
1.8 药时数据处理与统计分析
根据血浆药物浓度平均值-时间数据,作出药时曲线图.使用美国Pharsight公司药动学软件Winnonlin 5.2.1的非房室模型来处理伊维菌素组药动数据;微球组用梯形法计算药时曲线下面积(AUC),血浆峰浓度和达峰时间为实测值.计算出每只试验犬的药动学参数,然后计算平均值(¯X)及标准误(SE).采用方差非齐性t检验分析数据的显著性.
2 结果与分析
2.1 色谱条件的适用性
按照上述色谱条件,伊维菌素、阿维菌素与血浆中的其他组分分离良好,相互之间无干扰,峰型较佳,阿维菌素和伊维菌素的保留时间分别为7.2和11.8 min左右,保留时间稳定,色谱图见图1~图3.

图1 犬空白血浆样品色谱图Fig.1 Chromatograms of blank plasma samples of dogs
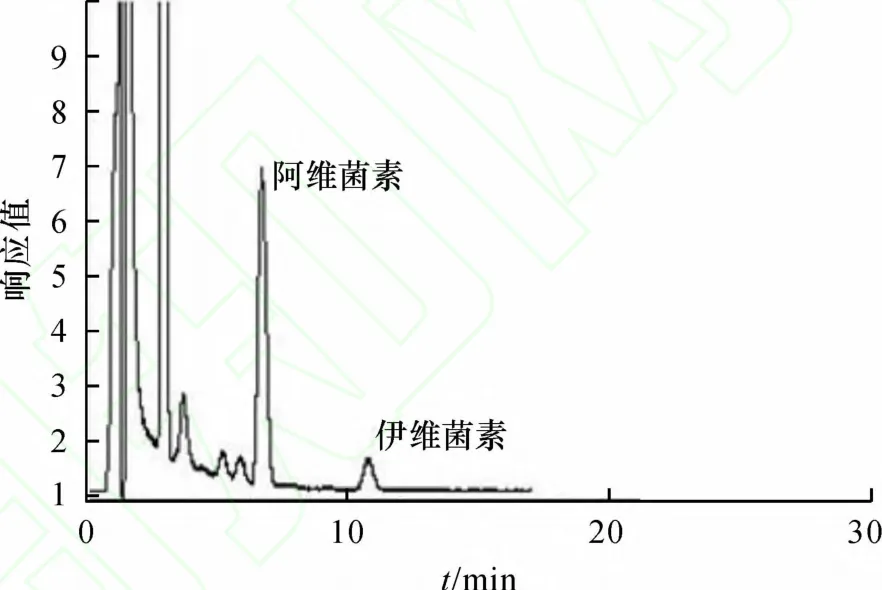
图2 犬空白血浆加入内标阿维菌素200 ng·mL-1和伊维菌素2 ng·mL-1的样品色谱图Fig.2 Chromatograms of blank plasma samples of dogs spiked with avermectin 200 ng·mL-1 and ivermectin 2 ng·mL-1

图3 实测给药后犬血浆样品色谱图Fig.3 Chromatograms of plasma samples of dogs after administration
2.2 标准曲线和最低检测限
空白血浆添加伊维菌素的质量浓度在1~40 ng·mL-1范围内,线性关系良好,回归方程为 y=0.007 4x+0.000 5,相关系数r=0.997 3.该方法检测限为0.5 ng·mL-1,定量限为1 ng·mL-1,结果见表1.表明该方法灵敏度高,能满足血浆中伊维菌素检测需要.
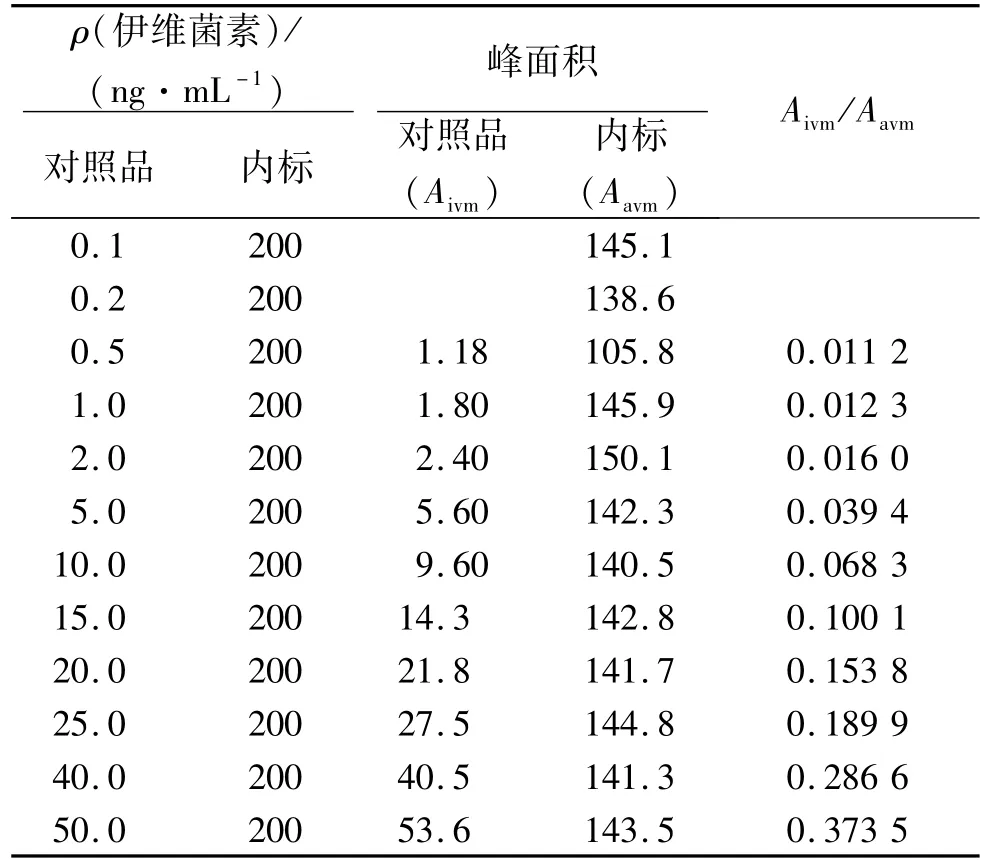
表1 标准曲线回归1)Tab.1 Standard curve regression
2.3 回收率和变异系数
按上述处理方法,血浆中的伊维菌素的绝对回收率在70.00%~99.30%,其中5 ng·mL-1水平的回收率为(80.84±1.48)%,批内变异系数为6.27%~10.60%,批间变异系数为8.17%.10 ng·mL-1水平的回收率为(83.39±1.73)%,批内变异系数为4.84%~8.67%,批间变异系数为9.28%.20 ng·mL-1水平的回收率为(84.61±1.51)%,批内变异系数为6.14%~7.53%,批间变异系数为7.97%.该方法回收率较高,批内和批间变异系数均不超过20.00%,满足生物样品测定要求.
2.4 血药浓度和主要动力学参数
犬皮下注射伊维菌素普通注射液(0.3mg·kg-1)、伊维菌素PLA及PLGA微球混悬液(3 mg·kg-1)后的药时曲线见图4.
采用Winnonlin 5.2.1的非房室模型分析方法处理药时数据,得到药动学参数,计算出各组参数平均值见表2.从表2可以看到,试验犬皮下注射伊维菌素普通注射液后,峰浓度(Cmax)为(44.3±5.1)ng·mL-1,达峰时间(tmax)为(1.33±0.21)d,吸收半衰期(t1/2ka)和消除半衰期(t1/2kel)分别为(0.17±0.02)和(4.96±0.66)d,平均滞留时间(MRT)为(7.40±0.95)d,药时曲线下面积(AUC0-∞)为(323.26±23.56)ng·mL-1·d.皮下注射伊维菌素PLA及 PLGA微球混悬液组,Cmax分别为(56.2±5.9)、(48.6±2.7)ng·mL-1,tmax分别为(0.83±0.11)、(0.81±0.13)d,AUC0-∞分别为(1 041.47±73.73)、(1 461.77±102.54)ng·mL-1·d.另外,从图4可以看出,PLA微球组药-时曲线明显出现3个峰,PLGA微球组出现2个峰.
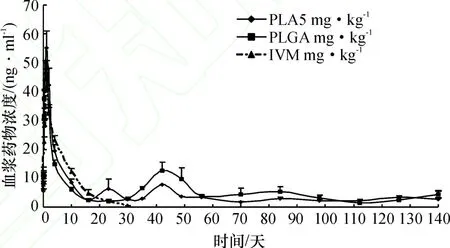
图4 伊维菌素、伊维菌素PLA和PLGA微球混悬液在犬皮下给药后的药时曲线Fig.4 Plasma concentration-time curve of IVM and IVM PLA/PLGA-MS injected subcutaneously to dogs

表2 犬皮下注射伊维菌素普通注射液(0.3 mg·kg-1)、伊维菌素PLA及PLGA微球混悬液(3 mg·kg-1)的药动学参数Tab.2 Summary of themean(±SE)plasma pharmacokinetic parameters in dogs adm inistered a single subcutaneous injection of IVM(0.3 mg·kg-1),IVM-PLA-M S and IVM-PLGA-MS(3 mg·kg-1)respectively
3 讨论与结论
3.1 伊维菌素普通注射液在犬体内的药动学特征
本试验 Beagle犬经皮下注射伊维菌素(0.3 mg·kg-1)后,Cmax为 44.3 ng·mL-1,AUC为 323.26 ng·mL-1·d,分别是刘仁杰[7]报道的皮下注射 0.1 mg·kg-1时 Cmax12.76 ng·mL-1的 3.5倍,AUC 79.52 ng·mL-1·d的4.1倍,这可能是给药剂量相差3倍和动物个体差异造成的;tmax为1.33 d,和刘仁杰[7]报道(1.47 d)基本一致.本试验中,犬皮下给药后,消除半衰期为4.96 d,血药质量浓度可监测到约30 d.伊维菌素皮下注射给药后,消除缓慢是因为注射部位刺激性炎症反应和药物结晶性沉淀延缓了药物的吸收[8].在不同种属动物中,皮下注射伊维菌素的药动学特征表现出很大的差异.消除半衰期以兔最短,为 1.5[6]和 1.8 d[9],马为 3.7 d,山羊 4.03 d[10],绵羊 5.1 d[11],猪为 5.4 d[12],牛最长的报道是8.3 d[13].
3.2 伊维菌素微球在犬体内的药动学特征
伊维菌素PLA和PLGA微球混悬液,与伊维菌素普通注射液相比,虽然剂量大10倍,但产生的峰浓度没有差异(P>0.05),维持1 ng·mL-1以上的时间却长达140 d以上,AUC0-∞比普通组大3~5倍.PLA、PLGA微球混悬液的第1个峰浓度产生的时间分别为0.83、0.81 d,达峰时间比普通组(1.33 d)略快.伊维菌素PLA微球混悬液在第23和第42天又分别出现2个药峰,伊维菌素PLGA微球混悬液在第42天出现第2个峰.肖田安[14]报道的山羊经皮下注射伊维菌素PLA、PLGA微球混悬液,第2个峰出现在20~30 d之间,PLGA微球混悬液的血药质量浓度可监测到105 d,PLA微球混悬液在133 d以后.其药-时曲线特征与在犬体内极其相似.显然,第1个峰的出现是因为微球表面黏附的伊维菌素所致的突释效应,及少量伊维菌素从微球扩散而共同产生的,第2个峰则是PLA和PLGA微球在皮下降解与溶蚀,引起伊维菌素的释放与继续扩散而产生的结果.第2个峰出现的时间只与聚合物有关,聚合物相对分子质量的大小、共聚物的比例及微球大小的选择等制备工艺都会影响药物释放过程.因为聚酯类微球系统释药前有一个迟滞期(lag period),直到聚合物相对分子质量经水解减少到某一临界值,才开始释放药物,故在第1峰和第2峰之间出现了低谷.
3.3 伊维菌素微球的应用前景
伊维菌素具有使用剂量低、作用强的特点.已有研究表明,伊维菌素在粪中的质量浓度为1 ng·g-1时对某些粪中繁殖的昆虫具有杀灭作用[15],当血药质量浓度在2 ng·mL-1以上时,牛疥螨虫产卵率减少到50%以下[16].体外试验表明,伊维菌素在0.1 ng·mL-1下明显抑制盘尾丝虫的3和4期幼虫的蜕变,半数有效量(50%effective dose,ED50)为 0.19 ng·mL-1[17].本 试验 犬 血 浆 中 伊 维 菌 素 维 持 1 ng·mL-1以上质量浓度的时间却长达140 d以上,提示伊维菌素PLA和PLGA微球对犬的驱虫作用有可能维持在140 d以上.综上所述,微球混悬液比普通注射剂的优点是延长了释药时间和驱虫作用期,排除或减少了产生毒副作用的可能性(微球本身降解后也无毒副作用),表明伊维菌素微球制剂具有开发研究的价值和广阔的市场前景.本试验通过皮下注射给药研究了伊维菌素普通注射液与PLA、PLGA微球混悬液在犬体内的药动学特征,试验结果表明,伊维菌素2种微球均具有明显的缓释特性,对兽医临床上预防和治疗犬的肠道线虫、耳螨、疥螨、心丝虫和微丝蚴等体内外寄生虫病有重要意义,可以进一步作为临床新制剂开发应用.
[1]TANG Shusheng,CHEN Linlin,GUO Zhaoxu,et al.Pharmacokinetics of a new ivermectin/praziquantel oil suspension after intramuscular administration in pigs[J].Vet Parasitol,2012,185(2/3/4):229-235.
[2]魏海涛,倪姮佳,方秋华,等.伊维菌素药动学研究进展[J].中国兽药杂志,2010,44(9):50-52.
[3]赵凯,孙庆申,李国新,等.伊维菌素缓释微球片剂的体外释放评价[J].高分子通报,2008,05:50-56.
[4]李冬,肖昭彭,陈志田,等.改性壳聚糖缓释微球的制备及对口蹄疫病毒吸附力的初步观察[J].中国兽医科技,1997,27(12):19.
[5]李贵玉.伊维菌素PLA/PLGA缓释微球的研究[D].兰州:甘肃农业大学,2012.
[6]王敏儒,陈杖榴,冯淇辉.伊维菌素微球在家兔体内的药动学[J].畜牧兽医学报,2000,31(2):171-178.
[7]刘仁杰.伊维菌素、双羟萘酸噻嘧啶咀嚼片在犬的药动学及药效学研究[D].扬州:扬州大学,2011.
[8]PÉREZ R,CABEZAS I,GARCÍA M,etal.Comparison of the pharmacokinetics ofmoxidectin(Equest®)and ivermectin(Eqvalan®)in horses[J].JVet Pharmacol Therap,1999,22(3):174-180.
[9]张瑞丽,崔亮亮,郝智慧,等.5种伊维菌素注射液在家兔体内的比较药动学研究[J].中国畜牧兽医,2011,38(11):188-190.
[10]ALVINERIE M,SUTRA J F,GALTIER P.Ivermectin in goat plasma andmilk after subcutaneous injection[J].Vet Res,1993,24(5):417-421.
[11]陈琳琳,肖希龙,郭召绪,等.伊维菌素和吡喹酮复方注射液在绵羊体内的药代动力学[J].中国兽医杂志,2011,47(6):73-76.
[12]郭召绪,王鲁君,肖希龙,等,伊维菌素和吡喹酮复方注射液在猪体内的药代动力学研究[J],中国兽医杂志,2011,47(2):72-74.
[13]COURTNEY C H,ROBERSON E L.Antinematodal drugs[M]∥ADAMSH R.Veterinary pharmacology and therapeutics.7th ed.Iowa:Iowa State University Press,1995:816-825.
[14]肖田安.伊维菌素微球的制备及其药动学与药效学研究[D].广州:华南农业大学,2001.
[15]STRONG L,JAMES S.Some effects of ivermectin on the yellow dung fly,Scatophaga stercoraria[J].Vet Parasitol.1993,48(1/2/3/4):181-191.
[16]GUILLOT F S,WRIGHT F C,OEHLER D.Concentration of ivermectin in bovine serum and its effect on the fecundity of psoroptic mange mites[J].Am J Vet Res,1986,47(3):525-527.
[17]LOK JB,POLLACK R J,DONNELLY JJ.Studies of the growth-regulating effects of ivermectin on larval Onchocerca lienalis in vitro[J].JParasitol.1987,73(1):80-84.
【责任编辑 柴 焰】
