柠檬酸铁铵合成的新工艺研究
2014-03-04王宇闫静李泽淳王学炜
王宇,闫静,李泽淳,王学炜
(西陇化工股份有限公司,广东汕头515064)
柠檬酸铁铵合成的新工艺研究
王宇,闫静,李泽淳,王学炜
(西陇化工股份有限公司,广东汕头515064)
研究了以还原铁粉为原料,将其与柠檬酸反应生成柠檬酸亚铁,再与NH3·H2O反应,并通过双氧水的氧化制得柠檬酸铁铵。考察了柠檬酸亚铁的制备条件、柠檬酸和铁粉的比例、反应时间、反应温度、双氧水用量对产品含铁量的影响,确定了最佳工艺条件为:n(柠檬酸)∶n(还原铁粉)为1.1∶1,反应温度为60℃,反应时间为1.5h,H2O2用量为理论量的1.0~1.2倍。
还原铁粉;柠檬酸铁铵;柠檬酸亚铁;食盐抗结剂;双氧水
柠檬酸铁铵又名枸橼酸铁铵,是柠檬酸铁FeC6H5O7和柠檬酸铵(NH4)3C6H5O7的复盐,一般认为其组成因合成条件不同而异,没有确切的化学式。有棕色和绿色两种,均无臭,有咸味及铁腥味,极易吸潮,因光可还原成亚铁盐,溶液状态下更不稳定,易溶于水,不溶于乙醇、乙醚等有机溶剂,水溶液呈中性,绿色较棕色更易遇光被还原。柠檬酸铁铵是一种含铁量较高,性能稳定,水合较好的高价铁盐,广泛用于补血药,以治疗缺铁性贫血;利用柠檬酸铁铵中Fe3+的光致还原性,可用于气象分析和制作晒蓝图纸;此外,柠檬酸铁铵作为食盐抗结剂的应用在国内也有研究,作为一种新型的绿色食品食盐用抗结剂,可有效取代亚铁氰化钾[1-4]。
柠檬酸铁铵的合成技术,根据国内的一些文献报道如以硫酸亚铁或铁泥等为原料,经氧化和水解得到Fe(OH)3,再用Fe(OH)3与柠檬酸和氨反应生成柠檬酸铁铵。该方法由于要经过制备Fe(OH)3的过程,而生成的Fe(OH)3为胶体沉淀,其洗涤过程比较困难,能耗大,污染严重,合成周期长[5-7]。
本文以还原铁粉为原料,通过其与柠檬酸和氨反应,并经氧化处理直接得到柠檬酸铁铵。新工艺避免了生成难于脱水和洗涤的Fe(OH)3中间产物,可有效缩短生产周期,提高产品质量。
1 实验部分
1.1 主要仪器与试剂
还原铁粉、一水合柠檬酸、NH·3H2O、30%H2O2均为分析纯。
美国Nicolet-380傅立叶红外光谱仪;RE-53型旋转蒸发仪(上海申生科技有限公司);DA-500电子天平(亚太计量仪器有限公司);pH计(梅特勒-托利多仪器(上海)有限公司)。
1.2 实验原理
以铁粉为原料制备柠檬酸铁铵可分为以下几个步骤:首先,铁粉与柠檬酸溶液进行置换反应,生成柠檬酸亚铁,柠檬酸亚铁是一种白色或微灰绿色的沉淀;柠檬酸亚铁与NH·3H2O作用生成柠檬酸亚铁铵,柠檬酸亚铁铵易溶于水,形成墨绿色溶液;用H2O2氧化柠檬酸亚铁铵得到柠檬酸铁铵。
主要化学反应如下:
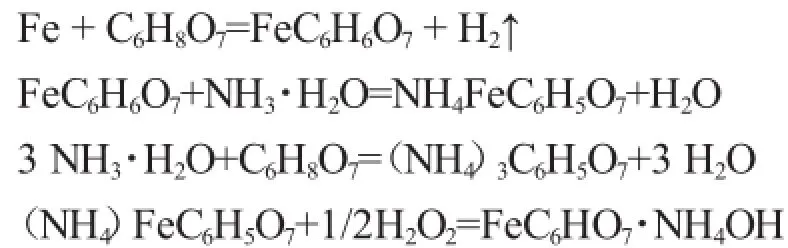
1.3 实验步骤
将柠檬酸溶于一定量水中,在80~85℃下分次加入还原铁粉,搅拌反应,生成柠檬酸亚铁的白色沉淀。搅拌下向柠檬酸亚铁中滴加氨水,使柠檬酸亚铁溶解。室温下缓慢向溶液中滴加定量的H2O2,然后升至一定温度保温反应,氧化得到柠檬酸铁铵。溶液过滤并进行真空浓缩,直到液体形成膏状,转入烘箱中在80℃以下干燥即得产物柠檬酸铁铵。
2 结果与讨论
2.1 柠檬酸亚铁的生成
2.1.1 铁粉与柠檬酸的投料比例对柠檬酸铁铵含量的影响铁粉与柠檬酸发生固液相的置换反应生成柠檬酸亚铁并释放出H2,当体系平衡时,未反应的铁粉将最终通过过滤操作离开体系,未反应的的柠檬酸则在体系中继续参与反应。因此,铁粉与柠檬酸的投料比对产物柠檬酸铁铵的含铁量、产量和外观都有影响,实验结果见图1和表1。
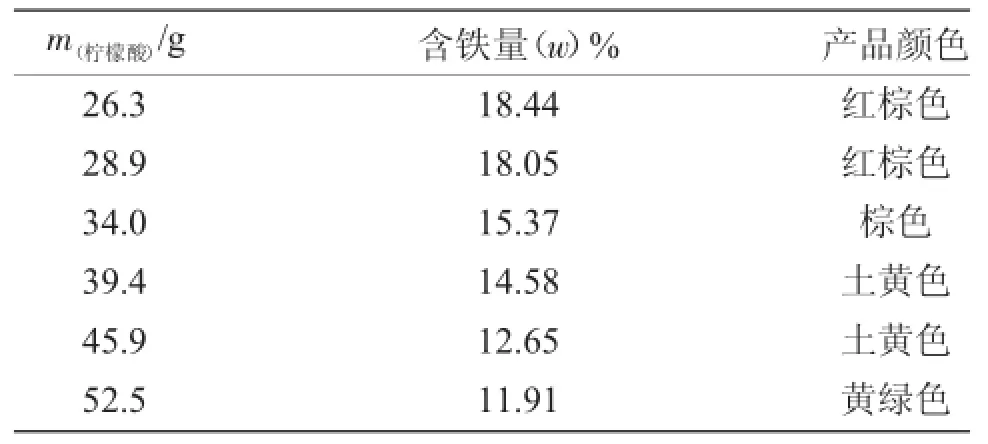
表1 柠檬酸加入量与产品含铁量和颜色的关系Tab.1The relation between the amount of citric acid added and the iron content and color of product
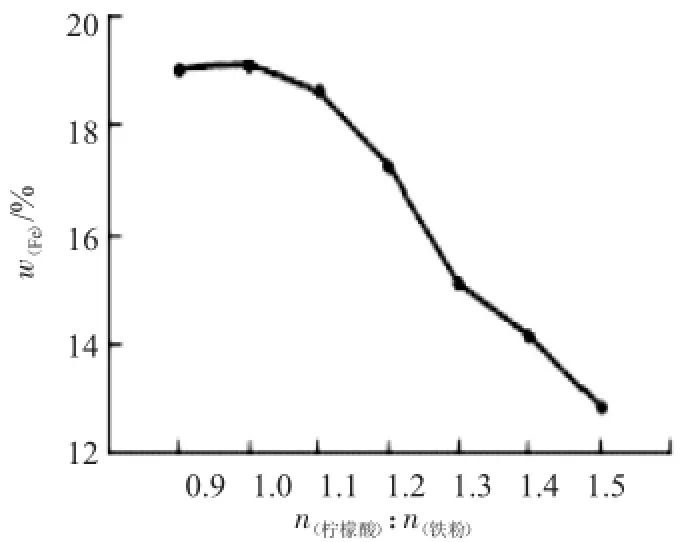
图1 柠檬酸与铁粉投料比对产品含铁量的影响Fig.1Effect of weight ratio of citric acid and iron poweron the content of iron in the product
根据图1可知,随着柠檬酸加入量的增加,柠檬酸铁铵的含铁量逐渐降低。这是由于过量的柠檬酸与氨反应生成柠檬酸铵,并随着物料的浓缩、干燥而留在产物中,从而使生成的柠檬酸铁铵在产物中的比例相对减少,所以产物的含铁量随着柠檬酸加入量的增加而减少。同时随着产物中柠檬酸铁铵比例的减少,产物的颜色也由红棕色转为黄绿色,见表1。但降低柠檬酸的加入量,会使反应要经历较长时间才能进行完全,所以本实验选取柠檬酸与铁粉的摩尔比为1.1∶1,此时生成的柠檬酸铁铵含铁量高,其颜色为红棕色。
2.1.2 反应时间、温度对反应速度的影响柠檬酸与铁粉反应的速度受反应温度和反应时间的影响,当反应进行至无气体产生并且体系的pH值不再继续升高时,即到反应终点。温度低于50℃时,无明显反应,随着反应温度的升高反应速度逐渐加快,温度高于80℃时,反应速度较快,有大量气泡产生。控制柠檬酸和铁粉投料摩尔比为1∶1,反应温度80~85℃,反应2h出现白色沉淀,3h后体系pH值达到4,继续延长反应时间,pH值不再发生变化。
2.2 柠檬酸铁铵的合成
2.2.1 双氧水用量对柠檬酸铁铵含铁量的影响H2O2将柠檬酸亚铁铵氧化为柠檬酸铁铵的过程中,溶液颜色由墨绿色转为红棕色。实验中保持反应过程的温度、时间不变,改变双氧水的加入量,其结果见表2。
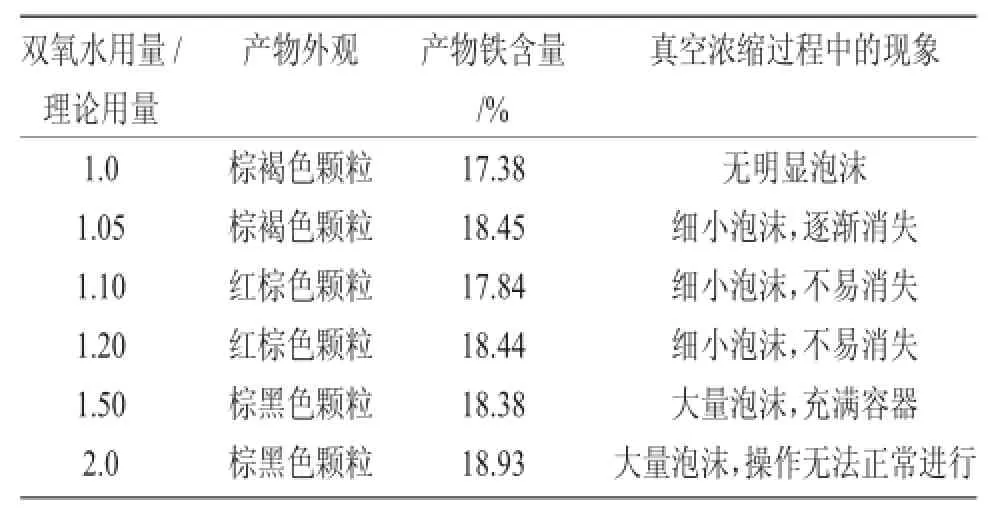
表2 H2O2用量对反应和产物的影响Tab.2Effect of the amount of hydrogen peroxide on reaction and product
从表2可以看出,H2O2加入量对产物含铁量、外观影响不大。H2O2加入量比理论量过量20%以上,浓缩过程中溶液形成浆状物时会产生大量泡沫,不利于操作,甚至使操作无法正常进行。但由于H2O2易分解,所以选择H2O2用量为理论用量的1.0~1.2倍。
2.2.2 反应时间对柠檬酸铁铵含铁量的影响其他条件不变,改变氧化反应的时间,其对生成柠檬酸铁铵含铁量的影响见图2。
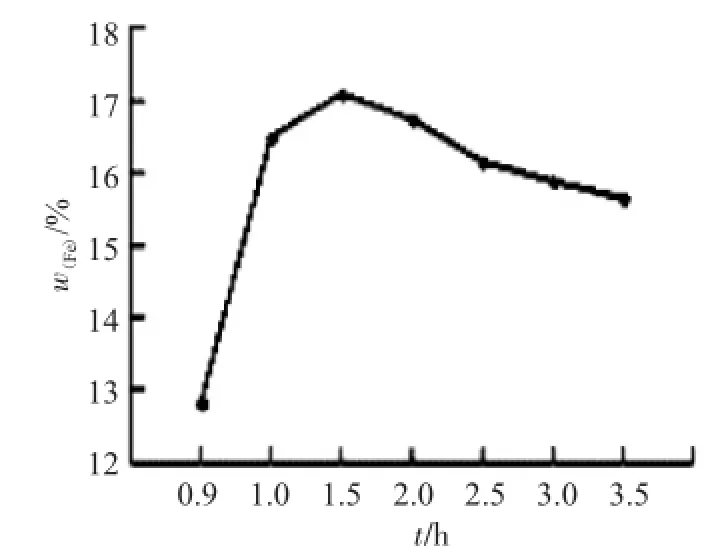
图2 反应时间对产物含铁量的影响Fig.2Effect of reaction time onthe content of iron in the product
由图2可以看出,H2O2的氧化过程在1h以内反应不充分,产物含铁量较低。1.5h反应完全,产物含铁量高。但长时间反应会造成产物含铁量降低,这是由于氨与柠檬酸铁络合能力较低,在长时间加热过程中,部分分解,影响产物的溶解性,所以选择1.5h为最佳反应时间。
2.2.3 反应温度对柠檬酸铁铵含铁量的影响其他条件不变,改变反应的温度,其对生成柠檬酸铁铵含铁量的影响见图3。
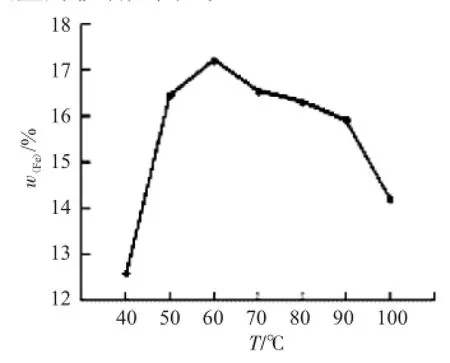
图3 反应温度对产物含铁量的影响Fig.3Effect of reaction temperature on the content of iron in the product
从图3可知,在50℃以下,由于氧化反应不充分,造成产物含铁量低(可以通过延长反应时间来使氧化反应进行彻底),50~80℃氧化反应进行充分,产物含铁量高,但高于80℃由于高温下氨的损失加大,部分产物分解,90~100℃时反应中有少量黄色沉淀生成,虽然不确定沉淀物的组成,但明显会造成产物含铁量降低。因此,反应过程要求温度控制在50~60℃为最佳。
2.3 柠檬酸铁铵的表征
用KBr压片法在400~4000cm-1测定了所得产品的红外光谱,结果如图4、5所示。所得产品和标准品的红外谱图相比,可看出主要吸收峰相同,证明为同一种物质。
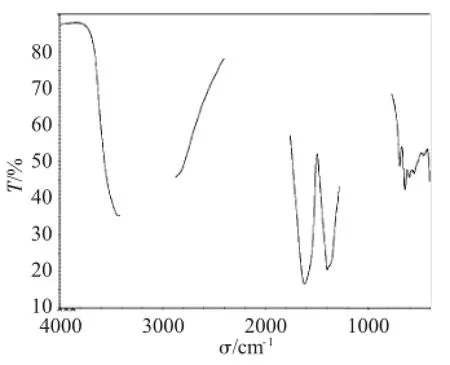
图4 柠檬酸铁铵产品的红外谱图Fig.4Infrared spectrum of ammonium ferric citrate prepared
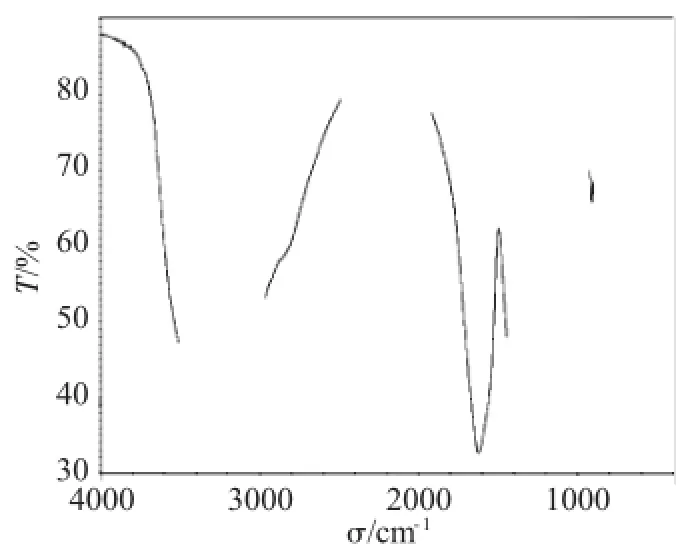
图5 柠檬酸铁铵标准品的红外谱图Fig.5Standard infrared spectrum of ammonium ferric citrate
柠檬酸铁铵的结构如下:
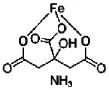
图中3428cm-1吸收峰为O-H的伸缩振动,3185cm-1为C-H的伸缩振动(-CH2-),1615、1396 cm-1为C=O的伸缩振动,1069、921、857cm-1为C-O的伸缩振动。
3 结论
(1)考察了以还原铁粉为原料,经与柠檬酸反应生成柠檬酸亚铁,再与NH3·H2O和H2O2反应制备柠檬酸铁铵的方法,得到了最佳反应条件,并在最佳反应条件下,所得产物含铁量17.64%~18.99%,颜色为棕红色,符合国家有关标准,其他杂质项目也符合药用标准。
(2)在柠檬酸与铁粉反应的阶段,反应温度、反应时间对反应速度有影响,而原料配比则对产物的含铁量有影响。柠檬酸与铁粉投料比为1.1∶1,反应时间3h,反应温度80℃。
(3)在用H2O2氧化制备柠檬酸铁铵的阶段,双氧水用量在理论量以上对产物含铁量无明显影响,为了使氧化反应进行充分,选择H2O2过量20%。反应时间和反应温度对产物含铁量有影响,反应温度60℃,反应时间1.5h为最佳反应条件。
[1]张丽清,董晓华,舒燕,等.工业废料铁泥制备柠檬酸铁铵的研究[J].沈阳化工学院学报,2009,23(2):109-113.
[2]张太平,万如锴.柠檬酸铁铵的制备方法[J].高等函授学报(自然科学版)2004,17(1):37-38.
[3]张文广,戴小明,徐婧.两种抗结剂用于食盐抗结的可行性探讨[J].苏盐科技,2010,(3):11-13.
[4]石荣铭,钟国清.利用含铁废渣制取高纯柠檬酸亚铁的研究[J].无机盐工业,2006,38(10):50-52.
[5]张志朋,蒋琪英,罗小军,等.饲料添加剂柠檬酸亚铁的制备工艺研究[J].中国饲料,2008,(12):41-43.
Research on new technology of synthesis of ferric ammonium citrate
WANG Yu,YAN Jing,LI Ze-chun,WANG Xue-wei
(Xilong Chemical Co.,Ltd.,Shantou 515062,China)
The reduced iron powder used as raw material is reacted with citric acid to synthesize the ferrous citrate.Then,the ferrous citrate is reacted with ammonia and the ferric ammonium citrate is synthesized by the oxidation of hydrogen peroxide.The conditions that affect the iron content of product include the preparation condition of ferrous citrate,the proportion of citric acid and iron powder,reaction time,temperature and the amount of hydrogen peroxide are discussed.The optimum technological conditions for preparation of ammnium ferric citrate are determined:n(citricacid)∶n(reducedironpowder)is 1.1∶1,reaction temperature is 60℃,reaction time is 1.5 h,and 1.2 times the amount of hydrogen peroxide for theory.
reduced iron powder;ferric ammonium citrate;ferrous citrate;salt anticaking agent;hydrogen peroxide
TS202.3;TS369
A
1002-1124(2014)11-0076-03
2014-06-16
王宇(1971-),男,工程师。1993年毕业于陕西师范大学化学系化学教育专业,本科,学士学位。
