小鼠腺病毒PCR检测方法的建立及初步应用
2014-03-04李晓波冯育芳王淑菁岳秉飞贺争鸣
王 吉, 付 瑞, 卫 礼, 李晓波, 冯育芳, 王淑菁, 巩 薇, 岳秉飞, 贺争鸣
(中国食品药品检定研究院, 国家实验动物微生物、遗传检测中心, 北京 100050)
小鼠腺病毒PCR检测方法的建立及初步应用
王 吉, 付 瑞, 卫 礼, 李晓波, 冯育芳, 王淑菁, 巩 薇, 岳秉飞, 贺争鸣
(中国食品药品检定研究院, 国家实验动物微生物、遗传检测中心, 北京 100050)
目的 建立小鼠腺病毒(MAdV) PCR检测方法,应用于长爪沙鼠、小鼠等实验动物MAdV的检测。方法 根据已发表的小鼠腺病毒(MAdV)E1B基因序列,设计合成引物。建立RT-PCR方法,并对方法的特异性、敏感性、稳定性等进行验证。用建立的方法对65只长爪沙鼠、12只小鼠进行检测。结果 建立的MAdV PCR检测方法与小鼠微小病毒、多瘤病毒无交叉反应;以MAdV DNA为模板,所能检测DNA最小模板浓度为1.67pg/μl,可检测病毒最小滴度为10-7/ml; MAdV DNA在-30℃冰箱放置12个月,仍能扩增出大小约606 bp的可见目条带。经PCR检测,65只沙鼠和12只小鼠均为阴性。结论 建立的小鼠腺病毒(MAdV) PCR检测方法特异、敏感、稳定,可用于小鼠、长爪沙鼠等实验动物MAdV的检测。
小鼠腺病毒; 聚合酶链式反应; 长爪沙鼠; 小鼠
长爪沙鼠又称蒙古沙鼠(Merions Unguieulataus; Mongolian gerbil), 分类学上属于啮齿目、仓鼠科、沙鼠亚科、沙鼠属,产于我国内蒙、河北、山西、甘肃等地,是一种正在开发、有着广阔前景的多功能的实验动物。国内外大量研究资料表明,长爪沙鼠由于其在多个方面独特的生物学特性,已被广泛应用于医学、生物学、行为学等研究[1~4]。另外,该动物的乳鼠对出血热易感,一直用作流行性出血热疫苗的研究及生产[2,4]。
长爪少鼠虽已广泛应用,但国内外却缺乏沙鼠质量控制要求及检测标准,对沙鼠微生物携带情况,尤其是病毒携带情况报道甚少。小鼠腺病毒(Mouse Adenovirus, MAdV)属腺病毒科,哺乳动物腺病毒属,核酸型为双股DNA,病毒粒子直径65~80 nm,呈二十面体等轴对称,是一种人兽共患病毒,分布十分广泛。在小鼠群中多呈隐性感染,带毒和排毒时间较长,是影响小鼠健康的重要因素之一[5]。腺病毒主要通过呼吸道飞沫和直接接触传播,也可通过粪、口传播。且能引起人类呼吸系统、眼部、胃肠道、肝脏、脑、泌尿系统疾病[5~8]。但目前国内外并未见长爪沙鼠是否能感染MAdV的报道。
本实验旨在建立简单、快速、特异、敏感的MAdV PCR检测方法,通过分子生物学手段,开展对小鼠、长爪沙鼠等实验动物携带MAdV核酸的检测,以保证小鼠、长爪沙鼠等实验动物的质量。同时通过对开放饲养的65只沙鼠腺病毒携带情况进行检测,为长爪沙鼠病毒感染谱筛查及实验沙鼠质量控制标准的制定提供参考依据。
1 材料与方法
1.1 病毒及样品
小鼠腺病毒(MAdV)购自美国ATCC(VR-550);小鼠细小病毒(MVM)、小鼠多瘤病毒(PolyV), 中国食品药品检定研究院实验动物质量检测室保存; 65 只开放饲养的长爪沙鼠, 3~15月龄, 雌性30只,雄性35只,来源于首都医科大学实验动物科学部[SCXK(京)2005-0006]; 12只小鼠,来自国内某单位送检的成年清洁级KM小鼠; 7只用于MAdV感染的6周龄雌性,SPF小鼠,体质量20~22 g,来源于中国食品药品检定研究院动物生产供应室[SCXK (京)2009-0017],以上动物均按实验动物使用的3R原则给予人道关怀。

表1 用于扩增E1B基因的引物序列及位置Table 1 Used for amp lification E1B gene p rimer sequence and position
1.2 主要试剂
DNA快速提取试剂盒购自Xygen公司; 逆转录试剂盒购自Fermentas; dNTP、Taq DNA聚合酶和100 bp DNA marker均购自TaKaRa公司; PCR仪、核酸琼脂糖凝胶电泳仪、紫外图像分析系统等。
1.3 引物设计及合成
分析已报道的MAdV基因组E1B基因序列, 将不同株基因进行比对, 根据GenBank中登陆的MadV A株基因(序列号: 000942)选择保守区域作为靶基因, 用Primer Premier 5.0软件设计2组两组引物见表1, 引物由上海生物工程技术服务有限公司合成。
1.4 病毒DNA提取
对正常BALB/c 3T3细胞、MAdV感染BALB/c 3T3细胞、小鼠细小病毒(MVM)、小鼠多瘤病毒(PolyV),按照DNA快速提取试剂盒(Xygen)操作方法进行DNA提取。冻存于-70℃冰箱备用。
1.5 PCR检测方法建立
以获得的DNA为模板进行PCR扩增。对2组引物PCR反应体系的dNTPs浓度、10×Buffer浓度、Taq HS酶浓度、引物、模板量、及反应体系的退火温度及循环次数等进行优化,通过对正常BALB/c 3T3细胞、MAd感染BALB/c 3T3细胞进行PCR扩增来确定PCR反应的最佳模式。
1.6 PCR产物检测
取5 μl扩增产物于1.0%琼脂糖凝胶(含0.5 μg/ml EB)进行电泳鉴定。电泳缓冲液为1×TAE(0.04mol/L Tris乙酸, 0.001 mol/L EDTA, pH8.0), 110 V电泳30 min,在紫外成像仪下观察PCR产物条带在凝胶中的位置,以100bp DNA ladder Marker为参照物,判定结果。PCR阳性扩增片段进行测序,通过与Genbank 中MAdV序列进行比对以确定PCR检测的准确性。
1.7 特异性试验
分别以小鼠腺病毒(M AdV)、小鼠微小病毒(MVM)、多瘤病毒(PolyV)及正常BALB/c 3T3细胞的DNA为模板,用引物1建立的PCR方法进行扩增,扩增产物用琼脂糖凝胶电泳做初步鉴定。
1.8 敏感性试验
1.8.1 MAdV病毒液浓度梯度检测 取感染滴度为10-4.25/m l MAdV病毒液,用PBS做系列倍比稀释,分设10-1~10-11共9个稀释度。取每个稀释度病毒液各0.5 m l制备模板,用引物1进行PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳鉴定,确定所能检测病毒最小滴度。
1.8.2 MAdV DNA浓度梯度检测 将起始浓度为16.7 μg/μl的DNA样本做倍比稀释, 分设10-1~10-8共7个浓度梯度,用引物1进行PCR扩增,扩增产物经1.0 %琼脂糖凝胶电泳鉴定,判断所能扩增的最小DNA模板浓度。
1.9 稳定性和重复性实验
取MAdV DNA及同一批PCR检测试剂于-30℃冰箱放置6个月、12个月时,进行PCR检测。两次试验各做3个重复。扩增产物经1.5 %琼脂糖凝胶电泳鉴定。
1.10 初步应用
对7只(编号分别为A 1~A 7)经腹腔人工感染M AdV的A 1~A 7小鼠脑、脾、心、肾、肺、肝组织、盲肠及内容物, A 1~A 3、A 7下颌腺组织,A 3~A 7胸腺组织,A 1、A 3~A 7胰腺组织,A 7小肠组织及正常3T3细胞与MAdV同时提取DNA, 用引物1进行PCR扩增。扩增产物用琼脂糖凝胶电泳做初步鉴定。
将65只沙鼠全血接种3T3细胞,盲传3代后,提取DNA, 用引物1进行PCR扩增。扩增产物用琼脂糖凝胶电泳做初步鉴定。将62 只沙鼠(编号: 1~62)脑组织、12只小鼠(编号: 63-74)脑、心、脾和胰腺及正常3T3细胞与MAdV同时提取DNA, 用引物1进行PCR扩增。扩增产物用琼脂糖凝胶电泳做初步鉴定。扩增到的阳性样品进行测序。测序结果经BLAST分析,与GenBank中MAdV核酸序列进行比对,验证检测结果的准确性。
2 结果
2.1 PCR检测方法建立
通过对两组引物PCR反应条件及反应体系的优化,确定了PCR最佳反应体系为: 10×ExTaqBuffer (Mg2+Free) 2 μl, dNTPs M ixture(10 mmol/L) 2 μl, Taq HS酶(5 U/μl)0.5 μl, 上下游引物(10 pmol/μl)各1 μl,cDNA 2 μl, 补水至20 μl; PCR最佳反应条件为: 94℃预变性5 min; 94℃变性30 s,56℃退火30 s, 72℃延伸1 min, 共35个循环; 72℃再延伸5 min。
2.2 RT-PCR产物检测
利用引物1(P-1)能扩增到约606 bp可见目的条带(图1)。 而引物2(P-2)对MAd和3T3细胞均未见目的条带。
2.3 检测结果准确性
选择引物1 的PCR扩增阳性片段进行测序, 测序结果经BLAST分析, 与GenBank中MAdV核酸序列同源性为99%(图3), 说明该方法检测准确性较好。
2.4 特异性验证
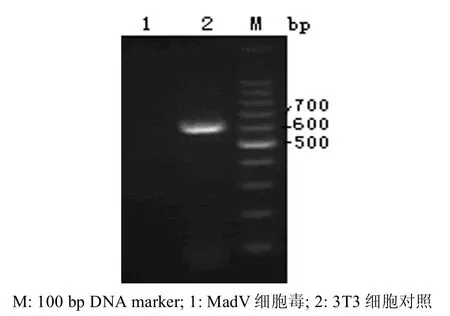
图1 引物1 PCR优化结果M: 100 bpDNA marker;1: MAd virus; 2∶3T3 cell controlFigure 1 The results of primer 1 PCR reaction conditions optim ization
引物1在以MAdV为模板进行扩增有明显目的条带出现,小鼠微小病毒(M VM V)、多瘤病毒(PolyV)及正常3T3细胞均无目的条带出现(图2)。
2.5 敏感性试验
2.5.1 MAdV细胞毒浓度梯度检测 引物1在病毒液稀释至10-4/m l时,仍可见目的条带出现(图4)。2.5.2 MAdV DNA浓度梯度检测 引物1在MAdV DNA模板稀释至10-7时仍可见目的条带出现(图5),即所能检测到的最小DNA模板浓度至少能达到1.67 pg/μl。
2.6 稳定性和重复性实验
电泳结果显示, MAdV cDNA 在-30℃冰箱放置6个月、12个月时,用引物1进行检测,仍能扩增出大小约606 bp可见目的条带(图6)。
2.7 初步应用
2.7.1 MAdV感染小鼠组织检测 利用引物1检测7只人工感染MAdV的小鼠脑、脾、心、肾、肺、肝、盲肠,A 1~A 3、A 7下颌腺组织,A 3~A 7胸腺组织,A 1、A 3~A 7胰腺组织,A 7小肠组织,电泳结果显示除A4~A6号盲肠没有扩增到目的条带外,其他组织均扩增到大小约606 bp左右目的条带。A 1~A 7号小鼠脑、脾及心脏组织电泳检测结果见图7(其他组织样品电泳检测结果图略)。
2.7.2 沙鼠血接种细胞检测 利用引物1建立的PCR检测方法,对65只沙鼠血接种3T3细胞、盲传3代后(细胞无CPE出现,结果均为阴性)的样品进行检测,结果均为阴性。1-22号样品电泳检测结果见图8(其他样品电泳检测结果图略)。
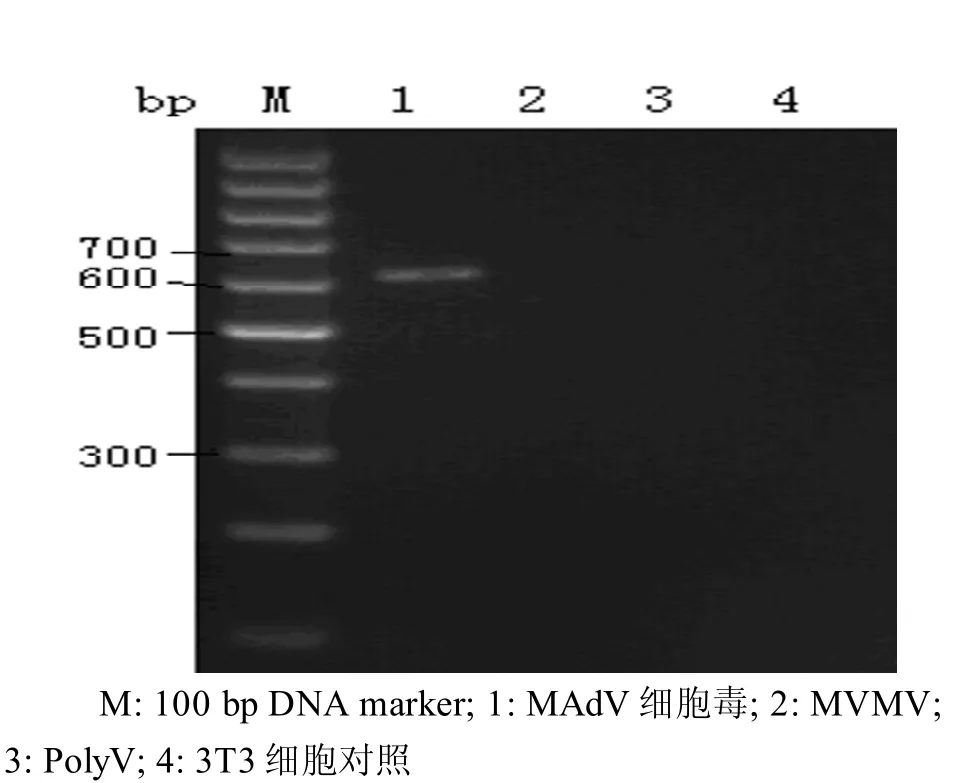
图2 引物1特异性条件验证M:100 bp DNA marker; 1: MAd virus; 2: MVM virus; 3: Poly virus; 4: 3T3 cell controlFigure 2 Specific validation results of p rimer 1
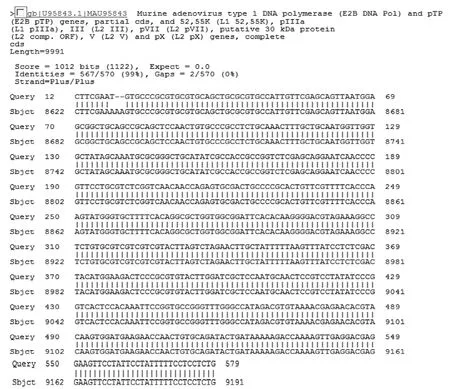
图3 引物1 PCR扩增MAdV阳性片断与GenBank中M AdV比对结果Figure 3 The comparison results of primer 1 PCR M AdV Positive amp lification fragment W ith M AdV in GenBank
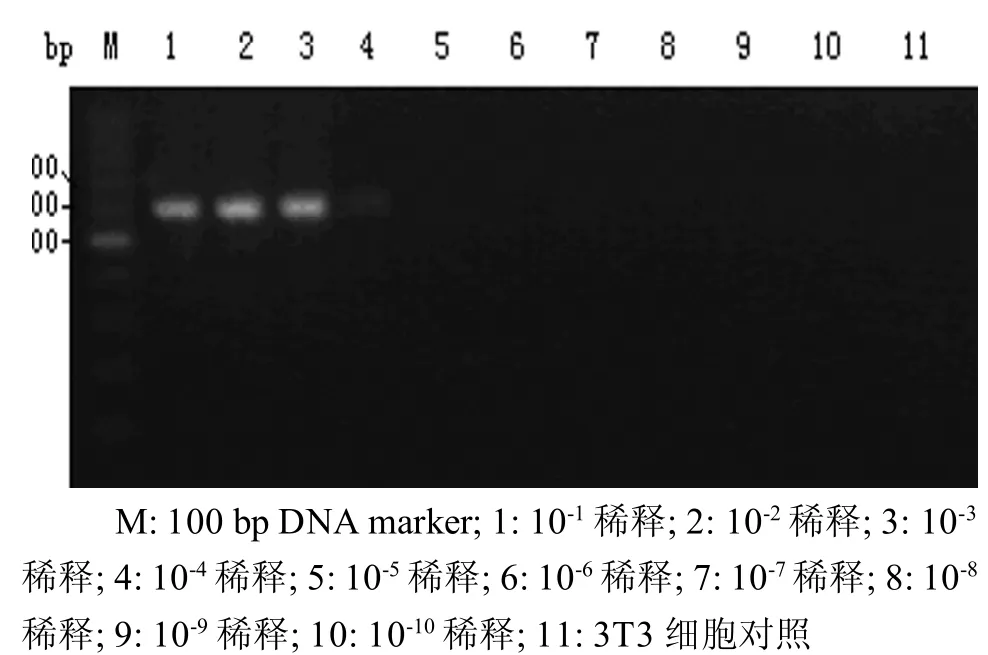
图4 引物M Ad-1PCR检测敏感性测定——M Ad细胞毒浓度梯度M: 100 bp DNA marker; 1: 10-1 dilution; 2: 10-2 dilution; 3: 10-3 dilution; 4: 10-4 dilution; 5: 10-5 dilution; 6: 10-6 dilution; 7:10-7 dilution; 8: 10-8 dilution; 9: 10-9 dilution; 10: 10-10 dilution; 11: 3T3 cell controlFigure 4 The sceptibility testing results of PCR using primers M Ad-1-Cytotoxic concentration gradient of M Ad
2.7.3 沙鼠、小鼠组织检测 利用引物1检测62只沙鼠及12只小鼠,结果均为阴性,1~22号沙鼠脑组织检测电泳结果见图9(其他组织样品检测结果电泳图略)。
2.7.4 检测结果的验证 将MAdV感染的A1号小鼠脑、脾、心、肾、肺、肝、盲肠、下颌腺、胰腺及A 3号胸腺及A 7号小肠扩增产物测序,与GenBank中MAdV标准株核苷酸序列进行比对,其同源性均为99%。
3 讨论
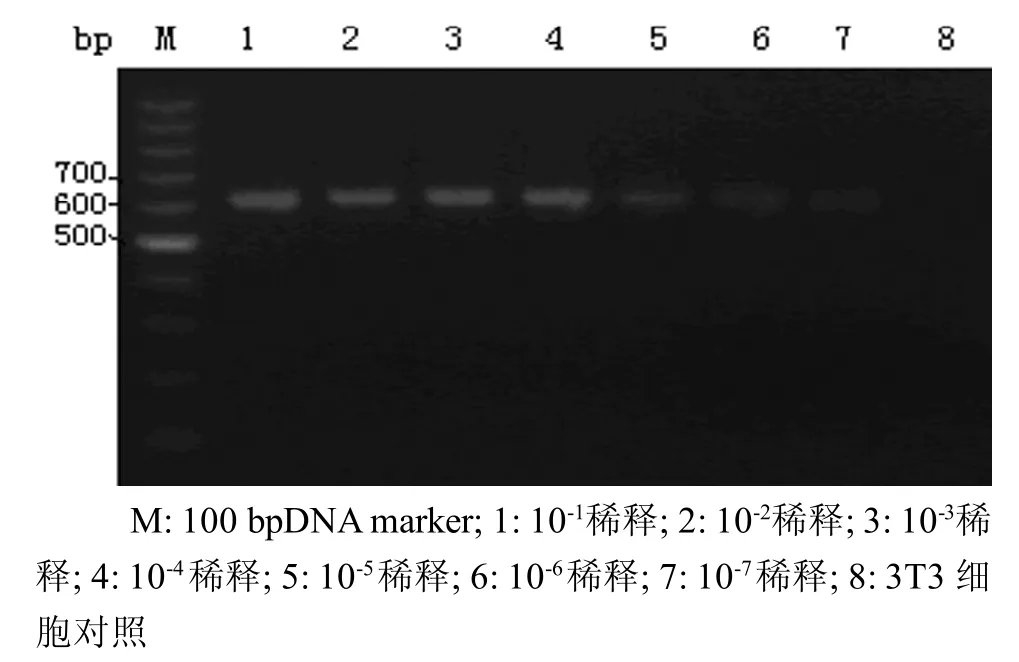
图5 引物M Ad-1 PCR检测敏感性测定——M Ad DNA模板浓度梯度M: 100 bp DNA marker; 1: 10-1dilution; 2: 10-2dilution; 3: 10-3dilution; 4: 10-4dilution; 5: 10-5dilution; 6: 10-6dilution; 7: 10-7dilution; 8: 3T3 cell controlFigure 5 The sceptibility testing results of PCR using primers MAd-1-DNA template concentration gradient of MAd

图6 引物1 PCR检测稳定性测定M: 100 bp DNA marker; 1-3: The DNA save -30℃refrigerator 6 months; 4-6: The DNA save -30℃ refrigerator 12 monthsFigure 6 The repeatability and stability testing resu lts of PCR using primers 1

图7 引物1 PCR检测人工感染M AdV小鼠脑、肝、脾组织M: 100 bp DNA marker; 1: MAd;2:3T3 cell control; 3~9: 1~7 brain; 10~16: 1~7 liver; 17~23: 1~7 spleenFigure 7 The resu lts of Primers 1 PCR to detect the brain,liver and sp leen tissues from experimental M AdV in fected m ice

图8 PCR检测1~22沙鼠血接种3T3细胞M: 100 bp DNA marker; 1~22: 3T3 cells inoculated w ith 1~22 gerbils blood; 23: 3T3 cell; 24: MAdVFigure 8 The resu lts of Primers 1 PCR to detect 3T3 cells inoculated w ith 1~22 gerbils b lood

图9 PCR法检测1~22号沙鼠脑组织样品M: 100 bp DNA marker; 1: MAdV; 2: 3T3 cell control; 3-24: 1-22 gerbil brain tissueFigure 9 The resu lts of primers 1 PCR detect 1~22 gerbil brain tissue
MAdV作为人兽共患传染病病原体,在SPF小鼠国家标准中要求对其检测[9,10]; 在《中华人民共和国药典》三部中,对鼠源性生物制品要求检测的8种人兽共患病病毒中包括MAdV[11]。不论是实验动物国家标准,还是中国药典三部,其规定的检测方法主要是血清学方法。目前国内并未见关于小鼠腺病毒(MAdV)分子生物学检测方法的建立及应用的报道。本实验针对MAdV抗原性最强的E1B基因,选择保守片段,设计引物(引物1)。建立MAdV PCR检测方法,其目的主要是用于长爪沙鼠、小鼠等实验动物的检测,亦可考虑用于鼠源性生物制品及原材料潜在MAdV的检测。
7只小鼠经人工感染MAdV 72 h后,A1~A4号小鼠死亡,剖检见脑部有淤血、脾脏肿大、胃及盲肠胀气,并有出血点;A 5~A 7号小鼠出现被毛逆立、行走时后肢迟缓、精神沉郁、站立不稳,剖检见脑部淤血、脾脏肿大、盲肠胀气,其他组织无明显病变。用建立的PCR方法,检测7只小鼠脑、脾、心、肾、肺、肝、盲肠、下颌腺、胰腺、胸腺及小肠等组织,除A 4~A6号小鼠盲肠未检到M AdV外,其他组织检测结果均为阳性。说明MAdV确实能感染小鼠,且小鼠脑、脾、心、肾、肺、肝、盲肠、下颌腺、胰腺、胸腺及小肠均可携带MAdV。同时也说明建立的PCR方法确实能从感染MAdV的动物组织中,检测出MAdV核酸。
根据人工感染小鼠MAdV后,小鼠临床均表现脑炎症状,剖检脑部均有淤血, PCR检测脑组织MAdV阳性率为100%,初步确定脑为MAdV主要靶器官,因而选择沙鼠脑组织作为主要靶器官进行MAdV检测。
试验对开放饲养的65只沙鼠进行了MAdV感染筛查,并检测了62只沙鼠脑组织,结果均为阴性,与65只沙鼠全血转染3T3细胞均为阴性结果一致; 同时与用PCR方法检测65只沙鼠全血接种3T3细胞的第3代,结果均为阴性一致。初步说明,沙鼠自然感染MAdV的可能性确实很小。但此次对65只长爪沙鼠MAdV的检测结果只是一个初步筛查结果,如果要确切了解我国长爪沙鼠对MAdV的感染情况,还需要扩大检测样本量,并有必要用其他分子生物学检测方法或结合血清学检测方法进行验证。因为本实验室不具备饲养长爪沙鼠的条件,所以没有做MAdV人工感染沙鼠实验。
本实验所建立的PCR检测方法,特异、敏感、可靠,稳定性好,检测准确性高,可用于小鼠、长爪沙鼠等实验动物MAdV的检测。同时也为实验室将来开展人用鼠源性材料及人用鼠源性生物制品MAdV核酸的检测奠定基础。
[1] 冯育芳, 邢进, 王吉, 等. 普通环境长爪沙鼠肠道菌群的分离鉴定[J]. 实验动物科学, 2012, 29(3):27-30.
[2] 刘月环, 吴旧生, 施张奎. 鼠肝炎病毒在长爪沙鼠消化系统的分布及其组织病理学改变[J]. 中国比较医学杂志, 2007, 17(4):197-200.
[3] 刘先菊, 扬帆, 林树柱, 等. 长爪沙鼠IgG的纯化及抗血清的制备[J]. 中国比较医学杂志, 2007, 17(11):641-643.
[4] 聂金荣, 聂朝晖. Z: ZCLA长爪沙鼠培育及其生物学特性研究[J]. 医学研究通讯, 2004, 33(6):27-28.
[5] 田克恭. 实验动物病毒性疾病[M]. 北京: 农业出版社, 1992.41-44.
[6] Weinberg JB, Stempfle GS, W ilkinson JE, et al. Acute respiratory infection w ith mouse adenovirus type 1[J]. Virology, 2005, 340(2):245-254.
[7] Hamelin C, Jacques C, Lussier G. Genome typing of mouse adenoviruses[J]. J Clin M icrobiol, 1988, 26(1):31-33.
[8] Hsu TH, Althaus IW, Foreman O, et al. Contribution of a single host genetic locus to mouse adenovirus type 1 infection and encephalitis[J]. MBio, 2012 , 3(3):e00131-12.
[9] GB 14922.2-2001.实验动物 微生物学等级及监测[S].
[10] GB/T 14926.27-2001. 实验动物 微生物学检测方法[S].
[11] 绍明立, 马晓伟, 吴浈, 等. 中华人民共和国药典[S].2010版三部(附录Ⅻ H), 鼠源性病毒检查法: 108-109.
Development and Preliminary Application of RT-PCR Method for Detection of Mouse Adenovirus
WANG Ji, FU Rui, WEI Li, LI Xiao-bo, FENG Yu-fang,WANG Shu-jing, GONG Wei,YUE Bing-fei, HE Zheng-ming,
(National Institutes for Food and Drug Control, National Center for Quality of Laboratory Animal, Beijing 100050, China)
ObjectiveTo develop a RT-PCR method for detection of Mouse Adenovirus (MAdV) in M ongolian gerbils and Laboratory mice.MethodsThe primers were designed and synthesized according to the published MAdv specific sequences of E1B gene . PCR method is established, and the specificity, sensitivity, stability test were carried out. The method is used to detect 65 Mongolian gerbils, and 12 mice.ResultsThe developed PCR method was no cross reaction w ith M inute virus, Polyoma virus, its minimum detection limit ,using the recombinant plasmid containing MAdV gene as a template, was 1.67 pg/μl, and the lowest detection virus titer is 10-7/m l. The MAdV cDNA maintained at -30℃ for 12 months, still can enlarge the size of about 606 bp visible mesh belt. The 65 M ongolian gerbils and 12 mice were all negative about MAdv detected by PCR.ConclusionThe developed PCR method is good in specificity, sensitivity, stability,and may be used for detecting the MAdv in laboratory animal, such as Mongolian gerbils and mice.
Mouse Adenovirus; PCR; Mongolian gerbil; Mouse
R-33Q95-33
A
1674-5817(2014)01-0035-07
10.3969/j.issn.1674-5817.2014.01.007
2013-05-30
国家科技支撑计划项目(2011BAI15B01)
王 吉(1974-), 女, 副研究员, 研究方向: 微生物学和免疫学
贺争鸣(1957-), 男, 博士, 研究员, 研究方向: 微生物学和免疫学。E-mail: zhengm inghe57@163.com
