新橙皮苷二氢查尔酮对流感病毒诱导小鼠肺气血屏障损伤的保护作用
2014-03-04毛栋森余陈欢胡毅翔张才乔
毛栋森, 陈 勤, 余陈欢, 胡毅翔, 张才乔
(1. 浙江大学动物科学学院, 杭州 310058; 2. 浙江省医学科学院, 杭州 310013; 3. 浙江大学医学院附属第二医院, 杭州 310009)
新橙皮苷二氢查尔酮对流感病毒诱导小鼠肺气血屏障损伤的保护作用
毛栋森1,2, 陈 勤3, 余陈欢2, 胡毅翔2, 张才乔1
(1. 浙江大学动物科学学院, 杭州 310058; 2. 浙江省医学科学院, 杭州 310013; 3. 浙江大学医学院附属第二医院, 杭州 310009)
目的 探讨新橙皮苷二氢查尔酮(NHDC)对流感病毒诱导小鼠肺气血屏障损伤的保护作用。方法 建立流感病毒感染小鼠肺炎模型,给予NHDC灌胃治疗。计算小鼠肺指数、湿干比值、肺组织切片HE染色观察其病理形态变化,ELISA法检测感染后第6天血清中IL-6、LTB4和ICAM-1的含量。免疫组化法检测肺组织水通道蛋白5(AQP5)蛋白表达水平。结果 流感病毒感染小鼠肺指数和湿干比值明显升高、肺组织间质炎性细胞渗出,以中性粒细胞浸润为主,伴明显的肺泡充血、水肿,肺组织AQP5蛋白表达水平明显下降;而NHDC可明显逆转上述病理症状。结论 NHDC对流感病毒诱导的小鼠肺组织气血屏障损伤有明显的保护作用,其可能是通过上调AQP5蛋白表达而发挥作用。
新橙皮苷二氢查尔酮(NHDC); 流感病毒; 气血屏障损伤; 水通道蛋白5(AQP5)
流感是一种高传染性的常见呼吸道疾病,可引起严重的肺部感染,诱导急性肺损伤,甚至发展形成急性呼吸窘迫综合征从而引起极高的死亡率。在流感病毒诱导的一系列病理生理改变过程中,肺气血屏障功能缺陷居于中心地位[1]。气血屏障的破坏将导致液体、蛋白、炎性介质进入肺泡腔,是流感病毒造成急性肺损伤主要的病理基础。水通道蛋白(AQPs)是近年来发现的一类调节机体内外环境水液代谢平衡的关键蛋白。其中,AQP5主要表达在I型肺泡上皮细胞和毛细血管内皮细胞上,定位于肺气血屏障两侧,可介导水分子通过肺气血屏障,对改善流感病毒诱导的渗透性肺水肿等病理症状发挥着重要作用,是肺脏通调水液转运的生理基础[2]。目前尚缺少具有抗病毒及抑制肺水肿双重疗效以达到标本兼治的的化学药。新橙皮苷二氢查尔酮(NHDC)是从芸香科植物中提取得到的新橙皮苷氢化而成的黄酮类衍生物[3]。近年来研究表明,其具有抗氧化、降血糖、抗肝纤维化等多种药理活性,且无明显的毒副作用[4~6]。项目组前期研究发现,NHDC具有潜在的抗炎和抗病毒活性,可降低流感病毒诱导的肺组织炎症浸润和肺水肿,提示其可改善流感病毒诱导的肺气血屏障损伤[7]。但其具体的药效作用及作用靶点尚不清楚,故本实验拟进一步通过体内实验,以肺脏水液代谢和气血屏障功能的指标蛋白AQP5为切入点,观察NHDC对流感病毒诱导小鼠肺损伤的影响,以及对AQP5表达的调控作用,为NHDC的临床应用和抗流感病毒药物的研发提供实验依据。
1 材料与方法
1.1 试剂与仪器
新橙皮苷二氢查尔酮(批号: 30702, 纯度=98%),西安开来生物工程有限公司; 利巴韦林泡腾片(批号: 091210), 浙江艾康礼德制药有限公司。免疫组化试剂盒和DAB显色盒购自武汉博士德生物技术有限公司。Class II Type/A/B2生物安全柜: 美国Beker公司。DC300莱卡图像处理显微镜, 德国莱卡公司。
1.2 病毒株
甲型流感病毒小鼠肺适应株A/PR/8/34, 由浙江省疾病预防控制中心病毒所提供。病毒效价为1∶512。本实验在浙江省疾病预防控制中心ABSL-2生物安全实验室中进行。
1.3 动物与分组
清洁级ICR小鼠,雌雄各半,18~22g,由浙江省实验动物中心提供[SCXK(浙) 2008-0033]。按体质量随机分为6组: 正常对照组、模型对照组、利巴韦林给药组(75 mg/kg)和NHDC高剂量给药组(400 mg/kg)、NHDC中剂量给药组(200 mg/kg), NHDC低剂量给药组(100 mg/kg),每组10只[SYXK (浙)2008-0113]。
1.4 流感病毒半数致死量的测定
将收集的流感病毒原液(鸡胚尿囊液)10倍梯度稀释,得到10-1、10-2、10-3、10-4、10-5浓度的病毒液。取ICR小鼠50只,采用单纯随机抽样法,随机平均分成5组,每组10只。每只小鼠经乙醚轻度麻醉后分别滴鼻感染不同稀释度病毒液25 μl。记录感染后14 d内小鼠自主行为、死亡时间、死亡数, 第14日不死亡的,按14日计算, 感染24 h内死亡的视为非感染死亡。计算各病毒感染剂量下的小鼠死亡率及流感病毒半数致死量(LD50)[7,8]。
1.5 模型建立及给药
除正常对照组给予等剂量生理盐水滴鼻外,其余各组在乙醚轻度麻醉下以10 LD50病毒量滴鼻感染小鼠, 30 μl/只。于感染后24 h开始灌胃给药[7]。正常对照组和模型对照组在同等条件下给予生理盐水灌胃,每日1次,连续4 d。
1.6 取材及保存
于末次给药后禁食禁水8 h,称重,摘眼球取血后处死,迅速取肺组织,用生理盐水洗净并用无菌滤纸吸干后称全肺重,并计算肺指数及肺指数抑制率[9]。取左侧肺叶称湿量(W),80℃烘箱中烘烤48 h后称干量(D),计算肺组织W/D比值[8]。取右侧肺组织10%福尔马林液固定,用于HE染色和免疫组化分析。
1.7 血清炎性介质的测定
对于脱空区,由于其中充满潮湿的空气,含水率不可知,其波速也不可测,因而无法准确的确定脱空高度,只能给出一个概值。
将摘眼球后所取血液置试管中4℃, 3 000 r/min离心30 min,吸取上清,置-20℃冰箱中,备用。采用双抗体夹心ABC-ELISA法,分别测定小鼠血清中IL-6、LTB4和ICAM-1含量。检测程序按照试剂盒说明书进行。
1.8 肺脏形态学观察
将固定后的肺组织样本行石蜡包埋切片,切片5 μm,经HE染色、中性树胶封固后显微镜观察照相。
1.9 免疫组化分析
肺组织常规包埋切片后,脱蜡、透明。采用一步法,一抗浓度为4 mg/m l,同时设立阴性对照片(用抗体稀释液体PBS替代一抗),DAB颜色,苏木精复染,中性树胶封片。阳性结果为细胞膜(AQP5)上显棕黄色颗粒沉淀; 阴性对照片显示细胞核及细胞膜呈蓝色, 胞质及整片组织呈淡蓝色背景。采用HM IAS-2000软件分析, 计算图像光密度值。
1.10 统计方法
实验数据采用SPSS 17.0统计分析软件进行统计学处理,所得结果以x-± s表示。取P<0.05作为显著性差异水平。
2 结果
2.1 流感病毒半数致死量
采用W u等[7]的方法,计算其LD50为10-3.60,实验用10LD50流感病毒量,以确保病毒模型组死亡率处于60%~90%。
2.2 肺指数及W/D比值观察
表1结果表明, 模型对照组肺指数及肺W/D值均显著升高,与正常对照组比较,具有显著性差异(P<0.01),表明流感病毒诱导的炎症反应可导致肺毛细血管内皮细胞和肺泡上皮细胞严重受损,造成肺气血屏障损伤和肺水肿。NHDC高、中、低各剂量给药组均可明显降低感染小鼠的肺指数和肺W/D值,提高肺指数抑制率,减轻小鼠流感病毒所致肺炎的病变程度,呈一定的量效关系,表明NHDC能明显减轻流感病毒导致的毛细血管通透性增加和肺间质性水肿。
2.3 血清炎性介质检测
由表2结果可知,病毒模型对照组小鼠血清中
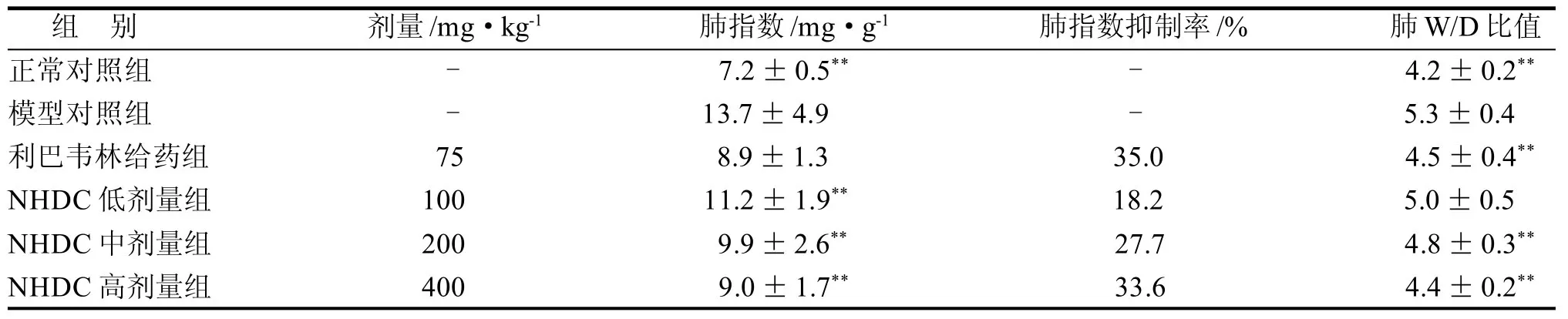
表1 流感感染诱导小鼠肺损伤及NHDC的保护作用

表2 流感感染小鼠血清炎性介质含量及NHDC的抑制作用
IL-6、LTB4和ICAM-1含量明显升高,与正常对照组相比较,具有显著性差异(P<0.01),表明流感病毒可诱导感染小鼠机体炎性介质的大量释放,促进肺气血屏障损伤; 而经NHDC给药治疗后血清中IL-6、LTB4和ICAM-1含量均明显降低,与模型对照组相比较,均具有极显著性差异(P<0.01或P<0.05),且呈一定的量效关系,表明NHDC可抑制流感病毒感染引起的炎症反应的作用。
2.4 肺组织病理学观察

图2 流感感染小鼠肺组织AQP5蛋白表达水平
光镜下观察各组小鼠肺脏病理组织学变化如图1,正常对照组肺泡大小较一致,肺泡壁菲薄,支气管上皮完整,管腔内无分泌物,其外周未见炎性细胞浸润。模型对照组则呈重度间质性肺炎病变,可见支气管上皮脱落,肺泡间隔增厚,充血,肺泡壁和细支气管壁周围大量单个核细胞浸润,形成实变区,肺泡腔内大量浆液性惨出。与模型对照组相比, NHDC高、中、低剂量给药组肺损伤病变程度均较模型对照组明显减轻,肺泡和血管内中性粒细胞聚集不明显, 肺组织间隙中性粒细胞浸润明显减少,红细胞渗出不明显。
2.5 AQP5免疫组化分析
AQP5阳性物质呈棕黄色、颗粒状,主要在肺泡上皮细胞的肺泡腔面,气道分泌上皮顶质膜上也有分布。由图2和图3结果可知,在正常对照组小鼠肺组织中AQP5蛋白表达较多,表现为细胞浆或细胞核内弥漫性黄色或棕黄色颗粒,而病毒模型组小鼠肺细胞核中AQP5蛋白表达则明显减少。与模型对照组相比较,NHDC各剂量给药组AQP5表达较正常对照组明显增加(P<0.01),表明NHDC可上调流感病毒引起的肺组织AQP5表达减少。
3 讨论
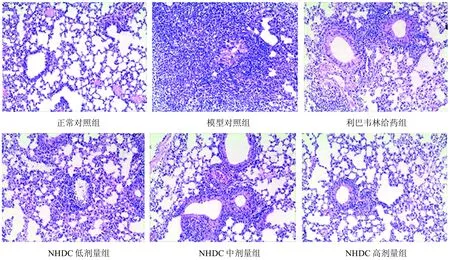
图1 流感感染小鼠肺组织HE染色病理观察(×200)
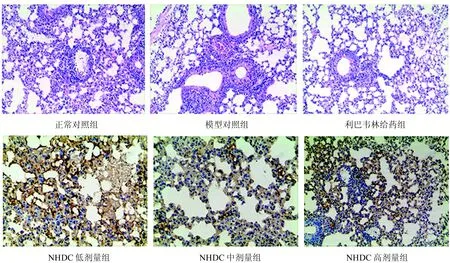
图3 流感感染小鼠肺组织AQP5蛋白免疫组化结果
流感病毒属呼吸道病毒。在病毒性肺炎发生过程中,机体会出现炎症介质失衡,同时产生大量的氧自由基,引起脂质过氧化,直接导致急性肺损伤(ALI)损伤。其中,气血屏障的破坏是流感病毒造成肺损伤主要的病理基础[10,11],其以肺泡毛细血管膜损伤为基础,渗透性肺水肿和炎症反应为特征。流感病毒可导致感染小鼠肺组织炎症的形成,致使肺泡间隔增厚、充血、肺泡腔内大量浆液性惨出、肺组织重量增加,同时流感病毒感染小鼠的体重往往降低或不增加。因此,从宏观上,肺指数值的大小可以反映肺部病变炎症反应的严重程度。而肺W/D比值可作为衡量肺组织毛细血管通透性增加、间质和肺泡水肿的指标。IL-6是流感病毒诱导的特异性炎性细胞因子,其与LBT4作为为重要的炎性趋化因子,可促进血管内皮细胞表达ICAM-1、VCAM-1等,促使中性粒细胞表达CD11b/CD18、CD11c/CD18等,从而增加白细胞与血管内皮细胞的黏附作用,促进炎性细胞移动到炎症灶,引起以单核细胞浸润为主的间质性肺炎。本实验结果表明,流感病毒感染后,模型对照组小鼠肺指数及肺W/D值显著升高,病理组织观察也发现模型对照组呈重度间质性肺炎病变,可见支气管上皮脱落,肺泡间隔增厚,充血,肺泡壁和细支气管壁周围大量单个核细胞浸润,形成实变区,肺泡腔内大量浆液性惨出,证明流感病毒诱导的小鼠气血屏障损伤模型建立成功。经NHDC给药治疗后,小鼠肺组织炎症病理状态明显改善,肺指数和肺W/D值明显下降,与病毒模型组比较具有显著性差异(P>0.01)。
AQPs是一类对水有特异通透性的细胞膜蛋白,对机体内外环境稳态平衡有重要的生理和病理意义。其中,AQP5在肺泡上皮细胞上大量表达,是肺脏通调水转运的分子生物学基础[2]。肺组织AQP5表达或功能的下降,可导致机体清除过多水液的能力下降,加重肺泡及肺间质性水肿。因此,AQP5的差异性表达是反映肺损伤肺内气血屏障功能改变的一个重要指标[12]。本实验免疫组化结果显示,流感病毒感染小鼠肺组织AQP5蛋白表达明显下降,并与机体炎症病理状态的变化趋势相一致;同时AQP5蛋白表达的下降不局限于肺部感染部位,而可见于全肺,证明AQP5与机体感染时肺部水液的异常转运有关。而经NHDC给药干预后,感染小鼠肺组织中AQP5蛋白表达显著升高,且水肿情况和炎性介质含量相对较轻,提示NHDC可通过调节AQP5蛋白的表达量对流感病毒引起的AQP5表达量减少, 从而抑制或缓解了流感病毒所致肺水肿的发展, 起到了对肺组织的保护作用,这可能是NHDC治疗流感病毒所致气血屏障损伤的药效靶点。但进一步的药效机制尚需深入研究。
[1] Butler D. Caution urged for mutant flu work [J]. Nature, 2012, 481: 417-418.
[2] Törnroth-Horsefield S, Hedfalk K, Fischer G, et al. Structural insights into eukaryotic aquaporin regulation [J]. FEBS Lett, 2010, 584(12):2580-2588.
[3] 温辉梁, 欧阳振宇, 胡晓波, 等. 新橙皮苷二氢查尔酮的研究进展[J]. 中国调味品, 2008, 10:70-73.
[4] Suarez J, Herrera MD, Marhuenda E. In vitro scavenger and antioxidant properties of hesperidin and neohesperidin dihydrochalcone [J]. Phytomedicine, 1998, 5(6):469-473.
[5] Zhang J, Sun C, Yan Y, et al. Purification of naringin and neohesperidin from Huyou (Citrus changshanensis) fruit and their effects on glucose consum ption in human HepG2 cells [J]. Food Chem, 2012, 135(3):1471-1478.
[6] 张硕, 洪波, 王庆林, 等. 4种黄酮类化合物对CCl4致小鼠肝纤维化的防治作用[J]. 华西药学杂志, 2012, 27(1):141-143.
[7] Wu Q, Yu C, Yan Y, et al. Antiviral flavonoids from Mosla scabra [J]. Fitoterapia, 2010, 81:429-433.
[8] 杨玉琴, 朱召芹, 徐春华, 等. 流感病毒气溶胶感染小鼠模型的初步研究[J]. 实验动物与比较医学, 2013, 33(3):180-184.
[9] Towne JE, Harrod KS, Crane CM, et al. Decreased expression of aquaporin (AQP) 1 and AQP 5 in mouse lung after acute viral infection [J]. Am Respir Cell Mol Biol, 2007, 22(1):34-44.
[10] Koyama S, Ishii KJ, Coban C, et al. Innate immune response to viral infection [J]. Cytokine, 2008, 43(3):336-341.
[11] 刘忠华, 李志东, 刘香梅, 等. 不同剂量禽流感H5N1病毒对小鼠体温体重的影响[J]. 实验动物与比较医学, 2006, 26(4): 239-241.
[12] 邓时贵,巫莉萍,黄海定.水通道蛋白mRNA表达与肺卫失宣大鼠肺损伤的相关性及大黄的调节作用[J]. 中国实验方剂学杂志, 2011, 17(3):177-180.
Protective Effect of Neosperidin dihydrochalcone on Influenza Virus-induced Air-blood Barrier Injury in Mice
MAO Dong-sen1,2, CHEN Qin3, YU Chen-huan2, HU Yi-xiang2, ZHANG Cai-qiao1
(1. College of Animal Sciences, Zhejiang University, Hangzhou 310058, China; 2. Zhejiang Academy of Medical Sciences, Hangzhou 310013, China; 3. Department of Clinical Laboratory Medicine, Second affiliated hospital, Zhejiang university college of medicine, Hangzhou 310009, China)
ObjectiveTo explore protective effects of neosperidin dihydrochalcone (NHDC) on air-blood barrier injury in influenza virus infected mouse model.MethodsThe pneumonia model was established by infection of influenza virus. Model mice were treated w ith NHDC at different dose by gavage. The pulmonary index, wet/dry mass (W/D) ratio and the pathological changes of lung tissue stained w ith HE were investigated. The levels of serum IL-6, LTB4and ICAM-1 were determined by ELISA, while expression of aquaporin 5 (AQP5) was detected by immunohistochemistry.ResultsAfter challenge, the infected mice had obvious increase in pulmonary index and W/D ratio, which manifested by accum lation of significant numbers of neutrophils, accompanied by marked pulmonary edema and high levels of serum IL-6, LTB4and ICAM-1. The expression of AQP5 was also significantly increased in the lung of infected mice. However, oral administration of NHDC significantly reversed those adverse factors.ConclusionInfluenza virus could cause air-blood barrier damage in the lung of infected mice, and it may be related to the expression of AQP5. NHDC shows obvious effect to the injury.
Neosperidin dihydrochalcone(NHDC); Influenza Virus; Air-blood Barrier Injury; Aquaporin 5(AQP5)
Q95-33
A
1674-5817(2014)01-0012-06
10.3969/j.issn.1674-5817.2014.01.003
2013-07-30
国家自然科学基金项目(81202977), 浙江省自然科学基金项目(LQ12H28007, LY13H280002), 浙江省医学科学院博士科研启动基金
毛栋森(1983-), 男, 助理实验师, 研究方向: 实验动物学研究, E-mail: maodongsen8396@163.com
张才乔(1965-), 男, 教授, 博士生导师, 研究方向:基础兽医学, E-mail: cqzhang@zju.edu.cn
