普鲁兰酶的分离纯化及部分酶学性质
2014-03-04周念波
周念波
(武汉生物工程学院生物工程系,湖北武汉430415)
普鲁兰酶的分离纯化及部分酶学性质
周念波*
(武汉生物工程学院生物工程系,湖北武汉430415)
对盐球菌(Halococcus sp.)Z1、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis)所产的普鲁兰酶粗酶液的耐热耐酸性进行了比较研究,并采用(NH4)2SO4盐析、透析、DEAE-Sephadex A25阴离子交换、Sephadex G-100凝胶过滤对Halococcus sp.Z1所产普鲁兰酶进行分离纯化,并测定了其部分酶学性质。结果表明Halococcus sp.Z1所产普鲁兰酶在低于65℃和pH4.0~7.5范围内有很好的稳定性,最适反应温度为60℃,最适反应pH为5.0~5.4,相对分子质量为8.17×104,Km值为0.24 mg/mL。
普鲁兰酶;纯化;性质
普鲁兰酶(Pullulanase,EC 3.2.1.41)是能够专一性地作用于普鲁兰糖、支链淀粉、糖原及相应低聚糖中的α-1,6-糖苷键,从而切下整个侧枝的一种脱支酶,已广泛应用于以淀粉为原料的各种工业生产中。
文献报道过的普鲁兰酶有多种,在应用方面近年来主要以开发耐热耐酸普鲁兰酶为主。本试验以实验室筛选所得的盐球菌(Halococcus sp.)Z1、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis)的发酵粗酶液为研究对象,探讨其在热稳定性和酸碱稳定性方面的性质,对其中符合耐热耐酸特性的普鲁兰酶,进一步进行分离纯化和其他方面酶学性质的研究。
1 材料与方法
1.1 试剂
普鲁兰糖,纯度99%,上海普奥生物科技有限公司;DEAE-Sephadex A25,上海楷洋生物技术有限公司;Sephadex G-100,南京都莱生物技术有限公司;低分子量标准蛋白质,相对分子量1.44×104~9.74×104,大连宝生物工程有限公司。
1.2 菌种及培养基
盐球菌(Halococcus sp.)Z1、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis),武汉生物工程学院酶工程实验室自筛。
产酶发酵培养基:每100 g培养基中添加糯米淀粉2.5 g,蛋白胨1 g,(NH4)2SO40.25 g,MgSO4· 7H2O 0.05 g,FeSO40.001 g,KH2PO40.1 g,pH5.0。
摇瓶产酶条件:35℃,160 r/min,摇瓶培养48 h。
1.3 方法
1.3.1 粗酶液制备
摇瓶培养后,收集发酵液,5 000 r/min低温离心后取上清液,制得粗酶液。
1.3.2 蛋白质浓度测定
蛋白质浓度测定采用Folin-酚试剂法(Lowry法)。
1.3.3 酶活测定
酶活测定参照参考文献[7]。
1.3.4 硫酸铵分级沉淀
向粗酶液中缓慢加入(NH4)2SO4至25%饱和度,4℃静置过夜后7 500 r/min冷冻离心,弃去沉淀。在清液中继续加入(NH4)2SO4,使其饱和度达到75%,4℃静置过夜后7 500 r/min冷冻离心,将沉淀溶于0.02 mol/L pH7.0的磷酸盐缓冲液,置于透析袋中,用0.02 mol/L pH7.0的磷酸盐缓冲液透析24 h。
1.3.5 DEAE-SephadexA25离子交换层析
将透析后的酶液上样至已平衡好的层析柱(2 cm×15 cm),用0.02 mol/L pH7.0的磷酸盐缓冲液(内含0.0 mol/L~0.5 mol/L的NaCl)进行梯度洗脱,控制流速为0.5 mL/min,每管5.0 mL收集,测定酶活,合并酶活较高的部分,用PEG20000进行浓缩。
1.3.6 SephadexG-100凝胶过滤层析
上步浓缩后的酶液上样至已用0.02 mol/L pH7.0的磷酸盐缓冲液平衡的层析柱(1.5 cm×50 cm),用相同缓冲液进行洗脱,控制流速为0.2 mL/min,每3.0 mL收集一管,测定各管酶活,合并酶活较高的部分,用PEG20000进行浓缩。
1.3.7 SDS-聚丙烯酰胺凝胶电泳
采用不连续垂直平板电泳系统,对纯化后的普鲁兰酶进行SDS-PAGE纯度分析。浓缩胶和分离胶质量浓度分别为3%和15%,考马斯亮蓝R-250染色。
2 结果与分析
2.1 温度对普鲁兰酶活性及稳定性的影响
分别于不同温度下测定普鲁兰酶活力,以活力最高者为100%对照,试验温度对3种菌株所产普鲁兰酶活力的影响,结果见图1。由图1可知,菌株Halococcus sp.Z1所产酶在低于60℃范围内,酶活随温度升高而升高,当温度超过60℃后,酶活逐渐下降;菌株Bacillus amyloliquefaciens所产酶在60℃~70℃范围内酶活较高,65℃时酶活最高;菌株Bacillus subtilis所产酶在50℃时酶活最高。因此菌株Halococcus sp.Z1、Bacillus amyloliquefaciens和Bacillus subtilis所产普鲁兰酶的最适作用温度分别为60℃、65℃和50℃。

图1 温度对普鲁兰酶活力的影响
将普鲁兰酶液分别在不同温度下保温60 min后,再按1.3.3的方法测定残余酶活,以活力最高者为100%对照,试验温度对3种菌株所产普鲁兰酶稳定性的影响,结果见图2。由图2可知,菌株Halococcus sp.Z1所产普鲁兰酶在低于65℃时稳定性较好,残余活力在76%以上,温度高于65℃后,酶活开始迅速下降;菌株Bacillus amyloliquefaciens所产酶热稳定性范围为低于70℃,残余活力在80%以上;而菌株Bacillus subtilis所产酶的热稳定性较前两者稍差,残余活力在80%以上的温度范围为低于55℃。

图2 温度对普鲁兰酶稳定性的影响
2.2 pH对普鲁兰酶活性及稳定性的影响
分别于不同的pH值下测定普鲁兰酶活力,以活力最高者为100%对照,试验pH对3种菌株所产普鲁兰酶活力的影响,结果见图3。由图3可知,pH对3种菌株所产酶的活性均有较大的影响。菌株Halococcus sp.Z1所产普鲁兰酶在pH5.0~5.4范围内对底物普鲁兰糖分解能力最强,酶活性最高;菌株Bacillus amyloliquefaciens所产酶在pH7.0~8.0范围内对底物的分解能力最强,而菌株Bacillus subtilis在pH5.4时酶活性最高。因此,菌株Halococcus sp.Z1、Bacillus amyloliquefaciens和Bacillus subtilis所产普鲁兰酶的最适作用pH分别为5.0~5.4、7.0~8.0和5.4。

图3 pH对普鲁兰酶活力的影响
将普鲁兰酶液在不同pH值缓冲液中于室温保持24 h后,再按1.3.3的方法测定残余酶活,以活力最高者为100%对照,试验pH对3种菌株所产普鲁兰酶稳定性的影响,结果见图4。由图4可知,菌株Halococcus sp.Z1所产普鲁兰酶在pH4.0~7.5范围内表现出较高的稳定性,残余酶活力在88%以上,超出此pH范围后酶的稳定性下降;菌株Bacillus amyloliquefaciens所产酶在pH6.0~8.0范围内稳定性较高,残余活力在90%以上;而菌株Bacillus subtilis所产酶的较高稳定性表现在pH4.4~7.5范围内,残余酶活力在86%以上。

图4 pH对普鲁兰酶稳定性的影响
2.3 耐热耐酸普鲁兰酶的确定
菌株Halococcus sp.Z1、Bacillus amyloliquefaciens和Bacillus subtilis所产普鲁兰酶的最适作用温度、最适作用pH及热稳定性和酸碱稳定性范围见表1。

表1 3种菌株所产普鲁兰酶的最适作用温度、pH及稳定性范围
从表1可以看出,菌株Halococcus sp.Z1和Bacillus amyloliquefaciens所产普鲁兰酶具有较高的最适作用温度和热稳定性,符合耐热的特性;菌株Halococcus sp.Z1和Bacillus subtilis所产普鲁兰酶的最适作用pH在pH5.0~5.4和pH5.4,酸碱稳定性分别在pH4.0~7.5和pH4.4~7.5范围内,具有耐酸的特性。综合考虑,菌株Halococcus sp.Z1所产普鲁兰酶既具有耐热又具有耐酸的特性,因此以菌株Halococcus sp.Z1所产普鲁兰酶作为后续试验样品。
2.4 普鲁兰酶的纯化
普鲁兰酶经盐析、透析、离子交换和凝胶过滤后,结果见表2。经纯化后,普鲁兰酶的纯化倍数为10.78倍,酶活力回收率为26.91%。DEAESephadex A25离子交换层析和Sephadex G-100凝胶过滤层析的洗脱曲线分别见图5和图6。
2.5 普鲁兰酶纯度鉴定和分子量测定
将纯化后的普鲁兰酶及标准分子量蛋白进行SDS-PAGE,电泳结果见图7。纯化后的普鲁兰酶经SDS-PAGE后只有一条蛋白质谱带,说明该酶达到了均一的程度。测得该普鲁兰酶的相对分子质量约为81 700。
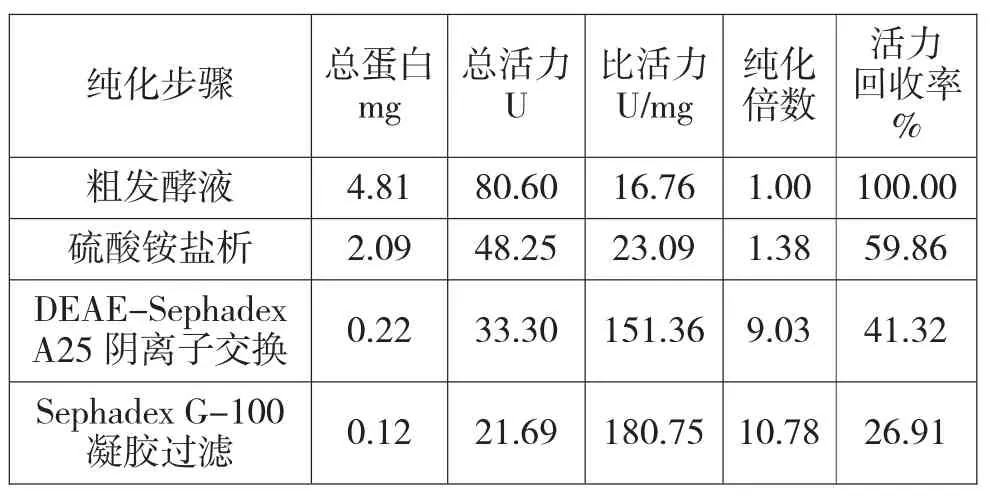
表2 普鲁兰酶的纯化结果

图5 普鲁兰酶的DEAE-Sephadex A25柱洗脱曲线

图6 普鲁兰酶的Sephadex G-100柱洗脱曲线

图7 普鲁兰酶的SDS-PAGE图
2.6 动力学参数
将普鲁兰酶与不同质量浓度的普鲁兰糖溶液保温反应,测定反应速度,以反应速度的倒数为纵坐标(1/V),普鲁兰糖质量浓度的倒数(1/[S])为横坐标作Lineweaver-Burk图,结果如图8所示,从而得出普鲁兰酶米氏常数Km为0.24 mg/mL,Vm值为10.11 μmol/(min·mL)。
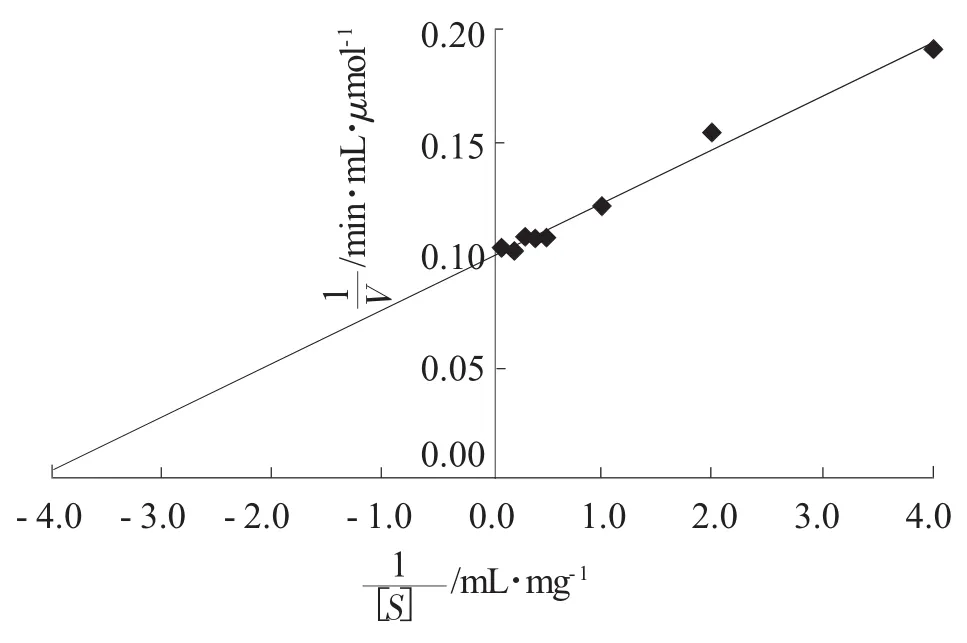
图8 普鲁兰酶Lineweaver-Burk图
3 结论
对实验室筛选得到的具有较高酶活的菌株Halococcus sp.Z1、Bacillus amyloliquefaciens和Bacillus subtilis的酶学性质进行了简单的初探,研究表明Halococcus sp.Z1所产普鲁兰酶最适反应温度为60℃,在低于65℃范围内较稳定,最适反应pH为5.0~5.4,在pH4.0~7.5范围内较稳定。相对菌株Bacillus amyloliquefaciens和Bacillus subtilis所产酶而言,菌株Halococcus sp.Z1所产普鲁兰酶具有耐热耐酸性质,较适合于工业生产应用。
对菌株Halococcus sp.Z1所产普鲁兰酶进行了分离纯化,测得其相对分子质量为81 700,Km值为0.24 mg/mL。
[1]TANIGUCHI H,SAKANO Y,OHNISHI M,et al.Pullulanase[J].Tanpakushitsu Kakusan Koso,1985,30(8):989-992.
[2]唐宝英,朱晓慧,刘佳.耐酸耐热普鲁兰酶菌株的筛选及发酵条件的研究[J].微生物学通报,2001,28(1):39-43.
[3]马晓军,陈拓,张晓君,等.碱性普鲁兰酶产生菌选育和发酵条件的研究[J].西北植物学报,2003,23(9):1 561-1 564.
[4]夏子芳,王正祥.Termotoga maritima普鲁兰酶的基因克隆与酶学性质研究[J].食品与发酵工业,2007,33(4): 19-22.
[5]闵伟红,刘艳,沈淑杰,等.普鲁兰酶产生菌的筛选及诱变技术研究[J].吉林农业大学学报,2007,29(3):343-346.
[6]陈钧辉,陶力,李俊,等.生物化学实验[M].北京:科学出版社,2003.
[7]周念波,魏丙卓,孙杰,等.普鲁兰酶产生菌的筛选及部分酶学性质研究[J].现代农业科技,2008(13):7-8.
[8]何忠效.生物化学实验技术[M].北京:化学工业出版社,2004.
Purification and properties ofpullulanase
ZHOUNian-bo*
(Department ofbioengineering,Wuhan bioengineeringinstitute,Hubei Wuhan430415,China)
Heat-resistance and acid-resistance of pullulanase from Halococcus sp.Z1,Bacillus amyloliquefaciens and Bacillus subtilis was studied.The pullulanase from Halococcus sp.Z1 was purified by ammonium sulfate fractionation, dialysis,DEAE-SephadexA25 ion-exchange chromatographyand sephadexG-100 gel filtration,and partial enzymatic properties was examined.It is stable below65℃and within the pH range from4.0~7.5.Its optical temperature is 60℃and optical pH is 5.0~5.4.The purified pullulanase was demonstrated bySDS-PAGE tobe a homogeneous protein.The molecularweightofpullulanaseis8.17×104,andtheMichaelisconstantis0.24 mg/mL.
pullulanase;purification;property
TS201.2+5
A
1673-6044(2014)01-0037-04
10.3969/j.issn.1673-6044.2014.01.012
*周念波,男,1979年出生,2011年毕业于湖北大学生化与分子生物学专业,硕士,工程师。
2013-12-06
