臭氧催化氧化机理及其技术研究进展
2014-03-04朱秋实陈进富姜海洋郭绍辉刘洪达
朱秋实,陈进富,姜海洋,郭绍辉,刘洪达
(1 中国石油大学(北京)环境工程系,北京 102200;2 中国石油炼化工程建设项目部,北京 100028;3 中油辽河工程有限公司,辽宁 盘锦 124010)
臭氧催化氧化技术是一种高效的污水深度处理技术,是近年来工业污水处理领域的研究热点。目前,对臭氧催化氧化催化剂制备、催化机理以及降解污染物已有大量的研究。与臭氧单独作为氧化剂相比,臭氧在催化剂的作用下形成的 OH·与有机物的反应速率更高[1]、氧化性更强,几乎可以氧化所有的有机物。如可以氧化臭氧单独氧化无法降解的小分子有机酸、醛等,可以将有机物完全矿化,提高污水TOC的去除率。但研究人员对催化机理的认识却相差很大,同种有机物使用同一类型的催化剂所得的实验结果却截然相反[2-3]。本文对臭氧催化氧化的机理及其研究进展进行了综述,以期对臭氧催化氧化技术有更深入的了解,为应用研究提供指导。
1 臭氧催化氧化机理
1.1 均相臭氧催化氧化机理
均相臭氧催化氧化机理一般可分为两种:一种是臭氧在催化剂的作用下分解生成自由基;另一种是催化剂与有机物或O3之间发生复杂的配位反应,从而促进臭氧与有机物之间的反应。
自由基反应机理是一种类Fenton反应机理,即臭氧在催化剂的作用下分解形成具有强氧化作用的自由基。以Fe2+为例,Sauleda等[4]在Fenton氧化机理的基础上提出了其催化分解臭氧形成 OH·的机理,反应如式(1)、式(2)。
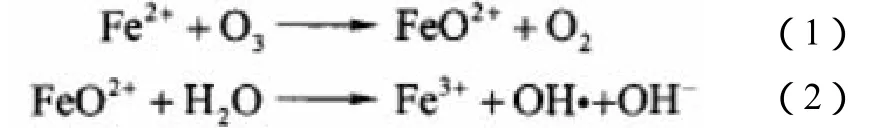
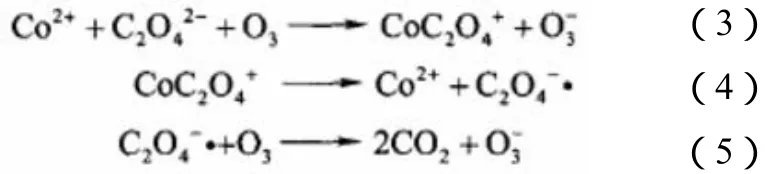
另一种反应机理是Pines等[5]在研究Co2+催化氧化草酸时提出的。首先,臭氧在碱性条件下更易分解形成OH·,他们却发现催化氧化的反应速率以及草酸的去除率随着pH值的增加而降低;其次,反应速率不受自由基抑制剂的影响。因此他们认为Co2+催化氧化草酸是通过如式(3)~式(5)反应进行的。
由于均相催化氧化的催化剂为离子形态,在实际应用中需要回收金属离子催化剂以避免造成水体的重金属污染和催化剂的浪费,运行操作不便,其研究已鲜有报道。
1.2 非均相臭氧催化氧化机理
对于非均相臭氧催化氧化,目前被大部分学者认同的反应机理有3种,分别为自由基反应机理、表面配位络合机理以及二者的结合。
Jans等[6]发现,对氯苯甲酸不与臭氧分子直接反应,在活性炭上的吸附量也较低,但在活性炭存在的条件下可以被臭氧氧化,加入自由基抑制剂后对氯苯甲酸的去除速率明显下降,因此推测有机物是被形成的OH·氧化分解的。Ma等[7-9]认为,臭氧分子可以与催化剂表面含氧基团通过氢键、静电作用力等形成五元环,然后通过电子转移的方式分解形成自由基。首先,他们认为催化剂的活性中心为表面羟基,如图1(a)所示[8]。
在之后的研究中,他们发现反应过程中溶液的pH值均低于催化剂的pHpzc值,根据质子化理论,此时催化剂的表面羟基主要以OH形式存在,因此催化臭氧分解的活性中心应为 OH,如图1(b)所示[9]。
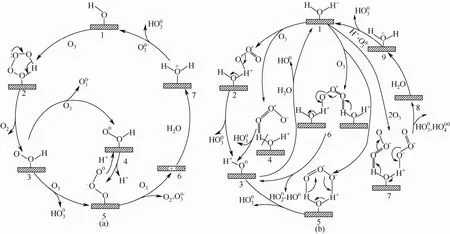
图1 臭氧在催化剂表面的分解机理[8-9]
自由基反应机理是最被认可的非均相臭氧催化氧化机理,但是却无法解释某些研究结果。Andreozzi等[10]在使用MnO2催化降解草酸时发现,当溶液的pH值小于MnO2的pHpzc值时,MnO2的催化活性较好;当溶液pH值大于其pHpzc值时,MnO2几乎没有催化活性。Tong等[11]发现,MnO2的形态对催化分解臭氧的影响较大,但对磺基水杨酸的降解效果基本一致。Beltrán等[12]通过动力学研究发现,TiO2/Al2O3催化氧化草酸时,催化剂对有机物的吸附为反应速率控制步骤。综合上述结果,有研究人员提出另一种臭氧催化氧化机理,即催化剂通过配位络合作用吸附有机物,然后被催化剂表面、液相中的氧化剂(O3、OH·等)氧化分解。Lugube等[1]根据实验结果提出的载体负载金属催化剂的催化机理就属于此种催化机理,他将其分为两种形式:一种是催化剂上负载的金属在催化反应中价态不变,仅起到配位络合作用;另一种是金属的价态发生改变,参与氧化还原反应,如图2所示。

图2 负载金属的催化剂上的臭氧催化氧化机理[1]
非均相臭氧催化氧化的第三种反应机理是催化剂与臭氧和有机物均有相互作用,反应既可以发生在催化剂表面,也可以发生在液相主体。同样使用活性炭催化降解草酸,Beltrán等[3]发现,叔丁醇对草酸的降解率影响较大,Faria等[2]却发现叔丁醇对催化效果几乎没有影响,而pH值对催化反应的效果影响较大。Liu等[13]在使用多壁碳纳米管催化降解草酸时发现在溶液中有 H2O2生成,但叔丁醇对草酸的去除率有较小的影响,仅从80%下降至70%。因此他们推测催化剂对臭氧和有机物均有吸附。臭氧在催化剂上分解形成O·,既可与吸附在催化剂表面的草酸发生反应,也可脱附形成OH·,与液相中的草酸反应,如图3所示。
2 臭氧催化氧化技术研究进展
2.1 催化剂
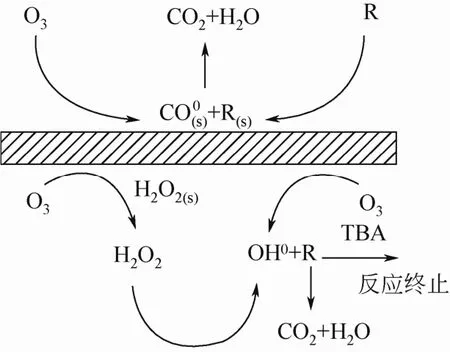
图3 多壁碳纳米管催化氧化草酸的机理[13]
臭氧催化氧化使用的催化剂的活性组分一般为过渡金属元素,类型主要有过渡金属氧化物、负载在载体上的过渡金属及其氧化物,作者对近两年来国内外发表的 75篇研究论文中所使用的活性组分进行了归纳总结,如图4所示。由图中可以看出,以Mn、Fe、Cu等廉价过渡金属元素以及储量较丰富的Ce稀土元素做为催化剂活性组分的研究较多,约占50%。同时,以TiO2作为光催化剂,可见光辅助强化臭氧催化氧化技术以及AC作为吸附剂、催化剂的研究应用也较多。
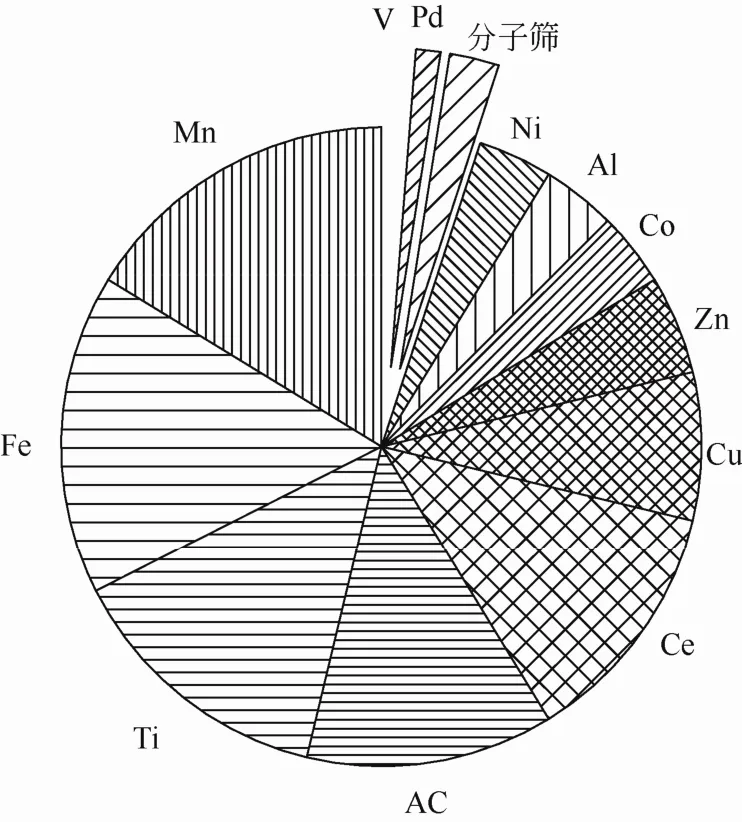
图4 催化剂活性组分的应用统计(2012—2013)
催化剂制备技术主要有溶胶-凝胶纳米技术[14-16]、浸渍-焙烧法[12-13,17-18]等。其催化性能主要受氧化物晶型、催化剂的孔结构及其表面化学性质等因素影响。如制备纳米TiO2催化剂时,随着焙烧温度的升高,TiO2的晶型由锐钛矿向金红石转化,催化活性不断增加[15]。由于有机物的吸附以及臭氧分解一般发生于催化剂的中孔结构中,因此具有较大中孔体积的催化剂的催化性能明显优于其他催化剂。Yamamoto等[14]以溶胶-凝胶缩聚技术制备的碳冷凝胶珠催化剂具有较大的中孔体积,对有机物的去除效果高于经过微孔化处理的活性炭G-70R。碳纳米管的管状孔结构有利于有机物的扩散,有效催化面积比普通GAC大,所以CNT的催化性能比GAC好[17]。表面化学性质中表面含氧基团类型和催化剂 pHpzc值对催化活性的影响最大。研究表明催化剂的催化活性中心一般为其表面碱性含氧基团,催化剂经O3[13]及HNO3[2]预处理后其表面碱性含氧基团减少,酸性含氧基团增加,催化活性降低。同样,催化剂经多次使用后其表面的酸碱度也会发生变化,影响催化剂的活性[19]。而催化剂的 pHpzc值不仅决定催化剂表面基团的离子形态[8-9],同时还影响催化剂表面的电负性[10-11],从而影响有机物的吸附。
2.2 对模型化合物的降解效果
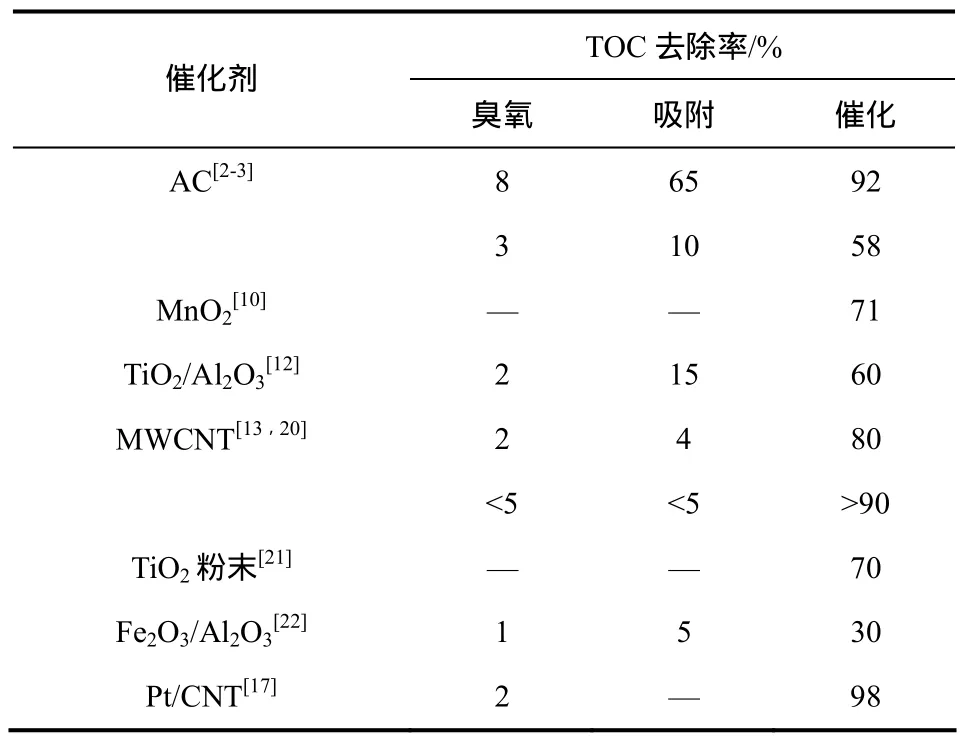
表1 臭氧催化氧化对草酸的去除效果
草酸几乎不与臭氧分子反应,而且在大多数情况下,臭氧分子氧化其他有机物时也会产生草酸,但在催化剂存在的条件下,臭氧可以通过自由基机理、催化剂表面反应机理等方式氧化降解草酸。目前对降解草酸所使用的催化剂、催化机理、动力学等方面已有大量的研究报告。表1分别列出了臭氧氧化、催化剂吸附以及臭氧催化氧化3种工艺对草酸溶液TOC去除的典型研究结果。由表1可以看出,臭氧催化氧化对草酸的去除效果明显高于臭氧氧化和吸附对草酸去除效果之和,明确了催化剂的催化作用。
除草酸外,使用臭氧催化氧化处理其他有机物的研究也较多,主要包括:小分子有机酸、酚类化合物、苯的衍生物以及稠环芳烃等,代表性的研究报道如表2所示。结果表明,臭氧催化氧化不仅能快速降解模型化合物,对反应的中间产物也有较好的去除效果,对污水TOC的去除率较高。
2.3 对工业污水的降解效果
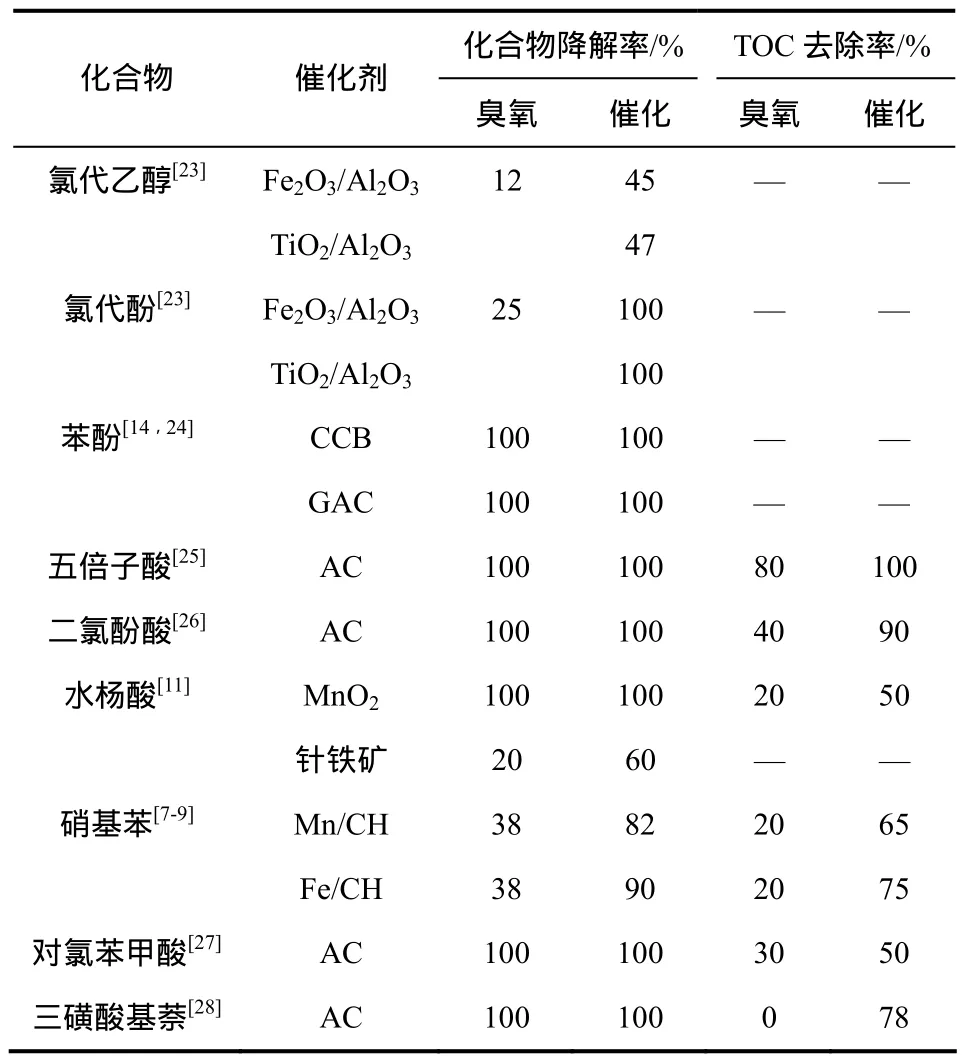
表2 臭氧催化氧化对其他模型化合物的去除效果
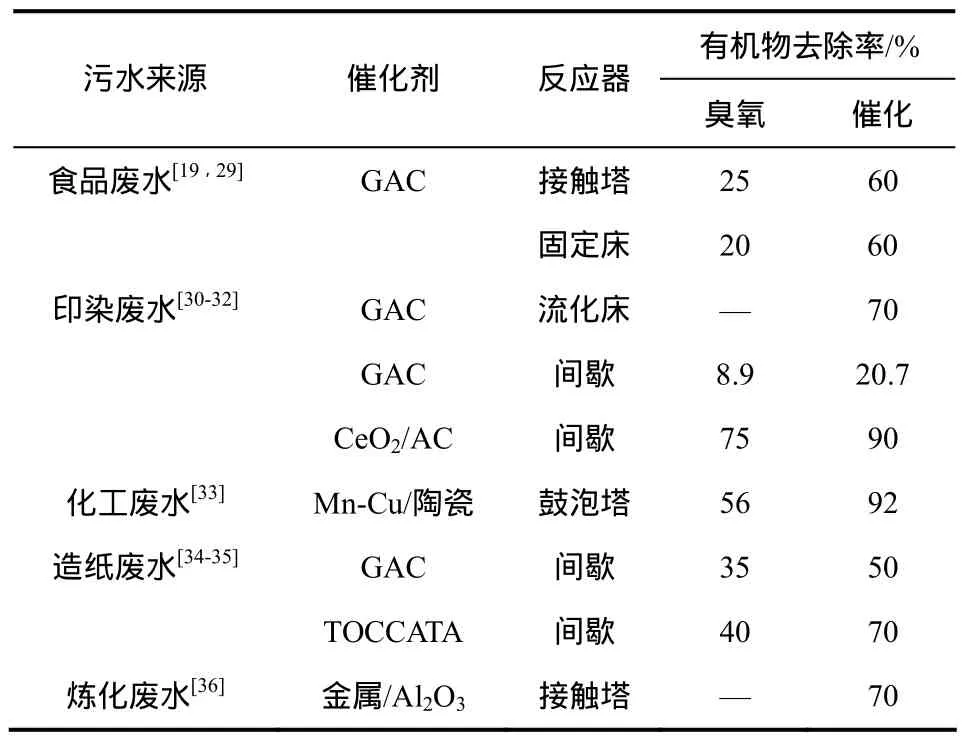
表3 臭氧催化氧化处理污水的效果
由于臭氧分子本身可以与有机物中的发色基团快速反应,因此在处理许多色度较高的工业污水时经常使用臭氧氧化的方法,如食品废水、纺织废水、造纸废水等。但臭氧单独氧化对废水的TOC去除效率不高,使用催化臭氧氧化可以在很大程度上提高废水的TOC去除率,见表3。
臭氧催化氧化在油田采出水处理方面的研究至今还未见报道,本文作者所在研究团队自2010年开始进行该方面的研究。对催化剂的活性组分、载体、制备条件、工艺参数等进行了筛选与优化,开发出了一种高效稳定的油田采出水深度处理技术。目前该技术正在进行中试实验研究,初步的实验结果表明,当进水COD为150 mg/L时,臭氧催化氧化工艺可以将其降至70 mg/L以下,且运行稳定,抗冲击能力较强。
3 结 语
臭氧催化氧化技术被认可的主要原因是它对许多不能被臭氧单独氧化的有机物有较好的去除效率,臭氧的利用率和污水TOC的去除率高。但催化氧化有机物的过程比较复杂,反应的影响因素较多,在发表的众多学术文章中,许多研究人员并没有对催化剂的晶体结构、表面化学性质、溶液pH值等因素进行详细的研究和表述,结果的对比性较差。另外,目前所提出的催化机理中催化剂结构、表面化学性质与有机物的降解途径之间没有明确的关系,如何针对目标污染物有目的地选择催化剂的类型还需要更深入的研究。
[1] Legube B,Karpel Vel Leitner N.Catalytic ozonation:A prom ising advanced oxidation technology for water treatment[J].Catal.Today,1999,53(1):61-72.
[2] Faria P C C,órfão J J M,Pereira M F R.Activated carbon catalytic ozonation of oxamic and oxalic acids[J].Appl.Catal.B:Environ.,2008,79(3):237-243.
[3] Beltrán F J,Rivas F J,Fernandez L A,et al.Kinetics of catalytic ozonation of oxalic acid in water w ith activated carbon[J].Ind.Eng.Chem.Res.,2002,41(25):6510-6517.
[4] Sauleda R,Brillas E.M ineralization of aniline and 4-chlorophenol in acidic solution by ozonation catalyzed w ith Fe2+and UVA light[J].Appl.Catal.B:Environ.,2001,29(2):135-145.
[5] Pines D S,Reckhow D A.Effect of dissolved cobalt(Ⅱ) on the ozonation of oxalic acid[J].Environ.Sci.Technol.,2002,36(19):4046-4051.
[6] Jans U,Hoigné J.Activated carbon and carbon black catalyzed transformation of aqueous ozone into OH-radicals[J].Ozone Sci.Eng.,1998,20(1):67-90.
[7] Zhang T,Ma J.Catalytic ozonation of trace nitrobenzene in water w ith synthetic goethite[J].J.Mol.Catal.A:Chem.,2008,279(1):82-89.
[8] Zhao L,Ma J,Sun Z,et al.Mechanism of heterogeneous catalytic ozonation of nitrobenzene in aqueous solution with modified ceramic honeycomb[J].Appl.Catal.B:Environ.,2009,89(3-4):326-334.
[9] Zhao L,Sun Z,Ma J.Novel relationship between hydroxyl radical initiation and surface group of ceramic honeycomb supported metals for the catalytic ozonation of nitrobenzene in aqueous solution[J].Environ.Sci.Technol.,2009,43(11):4157-4163.
[10] Andreozzi R,Insola A,Caprio V,et al.The use of manganese dioxide as a heterogeneous catalyst for oxalic acid ozonation in aqueous solution[J].Appl.Catal.A:Gen.,1996,138(1):75-81.
[11] Tong S,Liu W,Leng W,et al.Characteristics of MnO2catalytic ozonation of sulfosalicylic acid and propionic acid in water[J].Chemosphere,2003,50(10):1359-1364.
[12] Beltrán F J,Rivas F J,Montero-De-Espinosa R.A TiO2/A l2O3catalyst to improve the ozonation of oxalic acid in water[J].Appl.Catal.B:Environ.,2004,47(2):101-109.
[13] Liu Z,Ma J,Cui Y,et al.Effect of ozonation pretreatment on the surface properties and catalytic activity of multi-walled carbon nanotube[J].Appl.Catal.B:Environ.,2009,92(3-4):301-306.
[14] Yamamoto T,Kim S,Chaichanawong J,et al.Removal of aqueous organic pollutants by adsorption-catalytic process using mesoporous carbon beads loaded w ith metal oxides[J].Appl.Catal.B:Environ.,2009,88(3-4):455-461.
[15] Yang Y X,Ma J,Qin Q D,et al.Degradation of nitrobenzene by nano-TiO2catalyzed ozonation[J].J.Mol.Catal.A:Chem.,2007,267(1-2):41-48.
[16] Huang W J,Fang G C,Wang C C.A nanometer-ZnO catalyst to enhance the ozonation of 2,4,6-trichlorophenol in water[J].Colloid Surf.A:Physicochem.Eng.Asp.,2005,260(1-3):45-51.
[17] Liu Z,Ma J,Cui Y.Carbon nanotube supported platinum catalysts for the ozonation of oxalic acid in aqueous solutions[J].Carbon,2008,46(6):890-897.
[18] Ma J,Sui M H,Zhang T,et al.Effect of pH on MnOx/GAC catalyzed ozonation for degradation of nitrobenzene[J].Water Res.,2005,39(5):779-786.
[19] Alvárez P M,Beltrán F J,Masa F J,et al.A comparison between catalytic ozonation and activated carbon adsorption/ozoneregeneration processes for wastewater treatment[J].Appl.Catal.B:Environ.,2009,92(3-4):393-400.
[20] 何志桥,姜哲,姜理英,等.多壁碳纳米管的氨表面改性及其臭氧催化降解草酸[J].化工学报,2012,63(8):2551-2556.
[21] Beltrán F J,Rivas F J,Montero-De-Espinosa R.Catalytic ozonation of oxalic acid in an aqueous TiO2slurry reactor[J].Appl.Catal.B:Environ.,2002,39(3):221-231.
[22] Beltrán F J,Rivas F J,Montero-De-Espinosa R.Iron type catalysts for the ozonation of oxalic acid in water[J].Water Res.,2005,39(15):3553-3564.
[23] Cooper C,Burch R.An investigation of catalytic ozonation for the oxidation of halocarbons in drinking water preparation[J].Water Res.,1999,33(18):3695-3700.
[24] Wongsarivej P,Tongprem P,Swasdisevi T,et al.Adsorption and ozonation kinetic model for phenolic wastewater treatment[J].Chin.J.Chem.Eng.,2011,19(1):76-82.
[25] Beltrán F J,García-Araya J F,Giráldez I.Gallic acid water ozonation using activated carbon[J].Appl.Catal.B:Environ.,2006,63(3-4):249-259.
[26] Beltrán F J,Pocostales P,Alvarez P,et al.Diclofenac removal from water w ith ozone and activated carbon[J].J.Hazard.Mater.,2009,163(2-3):768-776.
[27] Li X,Zhang Q,Tang L,et al.Catalytic ozonation of p-chlorobenzoic acid by activated carbon and nickel supported activated carbon prepared from petroleum coke[J].J.Hazard.Mater.,2009,163(1):115-120.
[28] Sánchez-Polo M,Rivera-Utrilla J.Effect of the ozone–carbon reaction on the catalytic activity of activated carbon during the degradation of 1,3,6-naphthalenetrisulphonic acid w ith ozone[J].Carbon,2003,41(2):303-307.
[29] Pocostales J P,álvarez P,Beltrán F J.Kinetic modeling of granular activated carbon promoted ozonation of a food-processing secondary effluent[J].Chem.Eng.J.,2012,183:395-401.
[30] Lin S H,Lai C L.Kinetic characteristics of textile wastewater ozonation in fluidized and fixed activated carbon beds[J].Water Res.,2000,34(3):763-772.
[31] Faria P C C,órfão J J M,Pereira M F R.M ineralisation of coloured aqueous solutions by ozonation in the presence of activated carbon[J].Water Res.,2005,39(8):1461-1470.
[32] Faria P C C,órfão J J M,Pereira M F R.Activated carbon and ceria catalysts applied to the catalytic ozonation of dyes and textile effluents[J].Appl.Catal.B:Environ.,2009,88(3-4):341-350.
[33] Li B,Xu X,Zhu L,et al.Catalytic ozonation of industrial wastewater containing chloro and nitro aromatics using modified diatomaceous porous filling[J].Desalination,2010,254(1-3):90-98.
[34] Balcıoğlu I A,Tarlan E,Kıvılcımdan C,et al.Merits of ozonation and catalytic ozonation pre-treatment in the algal treatment of pulp and paper m ill effluents[J].J.Environ.Manage.,2007,85(4):918-926.
[35] Fontanier V,Farines V,A lbet J,et al.Study of catalyzed ozonation for advanced treatment of pulp and paper m ill effluents[J].Water Res.,2006,40(2):303-310.
[36] 陆彩霞,白云波,李长东,等.催化氧化耦合高效生化工艺深度处理石化废水[J].工业水处理,2012(5):67-69.
