FimH1-156融合基因的构建及其原核蛋白表达与纯化*
2014-03-04尹仕伟邹丽云张晋宇施维维吴玉章袁发焕张静波
尹仕伟,邹丽云,张 莹,张晋宇,唐 莎,施维维,吴玉章,袁发焕,张静波△
(1.第三军医大学新桥医院肾内科,重庆40037;2.第三军医大学全军免疫研究所,重庆40038)
自身免疫性疾病的发病机制主要是病原体通过分子模拟机制打破机体免疫耐受:即病原体某些抗原表位与宿主组织蛋白的结构相同或相似,导致病原体刺激机体产生的免疫应答直接作用于结构相似的自身组分[1]。Kain等[2]对寡免疫复合物局灶坏死性肾炎(FNGN)的研究发现了分子模拟的直接证据:尿路致病性大肠杆菌(pyelonephritic E.coli,UPEC)Ⅰ型菌毛FimH蛋白表位P72-80与人溶酶体膜蛋白2(lysosome membrane protein 2,LAMP-2)致病表位P41-49具有100%的同源性,机体通过识别细菌FimH抗原的同时,对自身的LAMP-2蛋白也发生了交叉反应。有研究发现,UPEC存在于多种菌毛,包括:P型、S型、Dr家族黏附素和Ⅰ型菌毛等[3]。Ⅰ型菌毛作为重要毒力因子在UPEC中分布广泛,除黏附定殖能力外,FimH位于最顶端,是真正的黏附素能够与含有甘露糖的糖蛋白受体结合,介导细菌与多种宿主细胞黏附[4]。FimH蛋白在免疫方面也起重要作用[2]。然而,感染UPEC的患者与发生自身免疫疾病、甚至FNGN的可能机制有待进一步探讨。本研究通过克隆含有与LAMP-2P41-49完全同源序列的UPECⅠ型菌毛FimH1-156为目的基因的原核载体,表达并纯化其融合蛋白,为建立FNGN实验动物模型提供材料和基础,也为基于LAMP-2靶抗原的多肽疫苗研发奠定基础。
1 材料与方法
1.1 材料 pET-28a(+)质粒由全军免疫研究所邹丽云教师赠送,含FimH1-156基因序列的pPKL241质粒由丹麦Per Klemm教授馈赠,大肠杆菌DH5α由本室保存,感受态菌株BL21(DE3)购自北京中杉公司。BamHⅠ、HindⅢ、KpnⅠ、DNA Marker、T4DNA连接酶均购自大连Takara公司;预染蛋白 Marker(10×103~170×103)购自 MBI公司;质粒提取试剂盒和胶回收试分析试剂盒均购自Omega公司;IPTG购自Merk公司;Ni-NTA树脂购自Qiagen公司;抗6×His抗体购自Abcam公司。引物合成,质粒测序由英潍捷基(上海)公司完成。
1.2 原核表达质粒pET28a(+)-FimH1-156的构建 根据FimH1-156的编码区序列设计特异性引物,上游引物序列为5′-ACG GGA TCC AAA CGT GTT ATT ACC CTG TTT GC-3′(含BamHⅠ酶切位点),下游引物的序列为:5′-CGG AAG CTT TTA GCC GCC AGT AGG CAC CAC CA-3′(含 HindⅢ酶切位点),引物均由英潍捷基(上海)公司合成。以质粒pPKL241为模板进行PCR扩增,反应条件:98℃2min;98℃10s、55℃20s、72℃45s,循环30次;72℃延伸2min。用BamHⅠ、HindⅢ分别酶切PCR产物与pET28a(+)质粒,经琼脂糖凝胶回收,将载体和目的片段用T4连接酶室温连接5 h。将连接的重组质粒pET28a(+)-FimH转化E.coli DH5α,在含有10mg/L卡拉霉素的LB琼脂糖培养基平板中37℃培养过夜。沿平板一直径挑选3个菌落,扩增后提取质粒,并用KpnⅠ与HindⅢ酶切鉴定,并送英潍捷基(上海)公司测序,确认得到正确的重组质粒,重组质粒命名为pET28a-FimH1-156。
1.3 FimH1-156的诱导表达及纯化 将测序正确的重组质粒pET28a-FimH1-156转化E.coli BL21(DE3),在含有10mg/L卡拉霉素的LB培养基中37℃摇菌过夜,后以1∶100转接到20 mL新鲜的含10mg/L卡拉霉素的LB培养基。37℃摇菌2 h,A600nm约为0.6时,加入IPTG至终浓度分别为0.00、0.01、0.10、1.00mmol/L,37℃摇菌诱导4h,6 000r/min 4℃低温离心10min收菌。对上清液和沉淀均进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,判定表达形式。诱导表达的融合蛋白包含有6×His片段,适用Ni-NTA树脂亲和层析法纯化目的蛋白。用10倍体积PBS重悬细菌,分别用10、20、50、100、250、500mmol/L 咪 唑、0.5mol/L 氯 化 钠、10mmol/L Tris-HCl(pH=8.0)溶液洗脱。
1.4 SDS-PAGE及蛋白免疫印迹法(Western blot)检测 将纯化后的FimH1-156蛋白进行SDS-PAGE分析,300mA转至聚偏氟乙烯(PVDF)膜2h,50g/L的脱脂奶粉室温封闭1h,抗6×His(一抗:1∶1 000)室温孵育1h,PBS-Tween20(PBST)洗膜3次,每次10min,羊抗鼠IgG(二抗:1∶5 000)室温孵育1h,PBST洗膜3次,每次10min。加入发光剂后曝光、显影。
2 结 果
2.1 重组质粒pET28a(+)-FimH酶切及鉴定 pPKL241-FimH1-156基因PCR产物、pET-28a(+)经BamHⅠ和HindⅢ酶切后,1%琼脂糖凝胶电泳显示,pET-28a(+)在5 000~6 000有一特异条带,FimH1-156在549bp处有特异条带(图1)。pET-28a(+)与FimH1-156基因PCR扩增产物连接后,转化DH-5α,沿平板一条直径,挑取3个单克隆,KpnⅠ为FimH1-156基因序列上的一个酶切位点,经KpnⅠ和HindⅢ酶切后,可见图2“1、3”为FimH基因连接上载体,而“2”为载体自连接。进一步对重组质粒送至英潍捷基(上海)公司进行DNA测序,结果序列和阅读框均完全正确。

图1 FimH1-156基因PCR产物及pET-28a(+)载体电泳分析
2.2 目的蛋白的纯化 筛选到的阳性pET28a(+)-FimH1-156,将表达菌E.coli BL21(DE3)于37℃振荡培养至A600nm值为0.6时,在诱导温度为37℃、诱导时间为4h、IPTG浓度依次0.00、0.01、0.10、1.00mmol/L,在IPTG浓度为1.00mmol/L时,目的蛋白的表达最高。表达形式主要以包涵体表达(图3)。进一步尝试pET28a(+)-FimH1-156在E.coli BL21(DE3)于16℃低温诱导表达,电泳检测显示无目的蛋白诱导表达。Ni-NTA亲和层析纯化,可见250mmol/L咪唑洗脱液中有少量目的蛋白,但浓度较低(虚线↑),流穿溶液中仍然有较多蛋白(实线↑),表明纯化效果不太好,蛋白挂柱能力差,见图4。

图2 重组原核表达载体pET28a(+)-FimH1-156的酶切分析
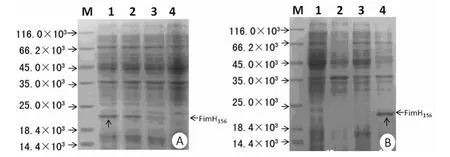
图3 不同浓度IPTG诱导及融合蛋白表达的SDS-PAGE分析

图4 重组质粒pET28a(+)-FimH1-156表达纯化检测
2.3 目的蛋白的鉴定 取未诱导E.coli BL21(DE3)/pET28a(+)-FimH1-156对照菌株;纯化后重组蛋白FimH1-156和超声后上清液及沉淀,进行Western blot鉴定,抗体为抗6×His单克隆抗体(图5),表明FimH融合基因pET28a(+)-FimH1-156在E.coli BL21(DE3)中正确表达,形式为包涵体表达。

图5 FimH1-156融合蛋白的Western blot分析
3 讨 论
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)相关性血管炎(ANCA-associated systemic vasculitis,AASV)是一种典型的自身免疫性疾病,已证实传统的ANCA相关的靶抗原有中性粒细胞髓过氧化物酶(myeloperoxidase,MPO)及蛋白酶3(protease 3,PR3)。van Putten等[5]研究韦格纳肉芽肿与金黄色葡萄球菌感染的关系中,明确了感染与自身抗体的间接证据,但一直未能找到感染与MPO或PR3相关的直接证据。抗LAMP-2抗体是最近才发现的ANCA新亚型,Kain等[6]关于FNGN发病机制的研究提示,UPEC入侵人体后,宿主通过FimH启动针对LAMP-2的自身免疫是LAMP-2-ANCA相关性FNGN发病机制的关键,这提供了分子模拟的直接证据。目前,抗LAMP-2抗体被认为是AASV更为特异而有效的标志,存在于几乎所有的FNGN患者中,与病变的相关性是传统抗MPO及PR3-ANCA的2倍[6];然而,有关抗LAMP-2抗体的临床实际价值仍存在较大的争议,有报道就对抗LAMP-2抗体与疾病的相关性提出质疑,更多标准化的实验有待进一步研究[7-8]。
Kain等[2]的研究证实了人FNGN的LAMP-2靶抗原的致病性的表位,即P41-49(HGTVTYNGS)和P331-341(QGKYSTAQDCS),并成功构建了WKY大鼠FNGN动物模型。明确致病性表位后,特异性诱导针对LAMP-2靶抗原的免疫耐受,这有望成为个性化治疗FNGN的有力手段,也为基于LAMP-2靶抗原的多肽疫苗开发提供了可能。作者利用LAMP-2靶抗原的致病性的表位P41-49多肽联合完全弗氏佐剂(complete freund′s adjuvant,CFA),乳化 后皮下注射 WKY 大鼠建立FNGN模型实验已经完成,3只实验组大鼠24h尿蛋白定量明显增多,但肾病理检查未见明显新月体及小球坏死,这可能与人工合成多肽免疫原性低有关。本研究成功构建了表达质粒pET28a(+)-FimH1-156,采用大肠杆菌表达,获得免疫原性更高的UPECⅠ型菌毛FimH1-156表达蛋白,通过Ni-NTA纯化后,利用标签抗体进一步间接鉴定了该表达蛋白,与文献报道结果类似[9],该蛋白的表达形式也为包涵体,这可能与表达蛋白自身特性有关。随后,作者采用反复冻融、超声、离心和反复洗涤的方法,经SDS-PAGE分析,切胶纯化出较高纯度的FimH1-156融合蛋白,为进一步采用FimH1-156融合蛋白诱导WKY大鼠建立FNGN模型奠定基础。
[1]Rashid T,Ebringer A.Autoimmunity in rheumatic diseases is induced by microbial infections via crossreactivity or molecular mimicry[J].Autoimmune Dis,2012,2012:539282.
[2]Kain R,Exner M,Brandes R,et al.Molecular mimicry in pauci-immune focal necrotizing glomerulonephritis[J].Nat Med,2008,14(10):1088-1096.
[3]Bower JM,Eto DS,Mulvey MA.Covert operations of uropathogenic Escherichia coli within the urinary tract[J].Traffic,2005,6(1):18-31.
[4]Connell I,Agace W,Klemm P,et al.Type 1fimbrial expression enhances Escherichia coli virulence for the urinary tract[J].Proc Natl Acad Sci U S A,1996,93(18):9827-9832.
[5]van Putten JW,van Haren EH,Lammers JW.Association between Wegener′s granulomatosis and Staphylococcus aureus infection[J].Eur Respir J,1996,9(9):1955-1957.
[6]Kain R,Tadema H,McKinney EF,et al.High prevalence of autoantibodies to hLAMP-2in anti-neutrophil cytoplasmic antibody-associated vasculitis[J].J Am Soc Nephrol,2012,23(3):556-566.
[7]Roth AJ,Brown MC,Smith RN,et al.Anti-LAMP-2antibodies are not prevalent in patients with antineutrophil cytoplasmic autoantibody glomerulonephritis[J].J Am Soc Nephrol,2012,23(3):545-555.
[8]Fervenza FC,Specks U.Vasculitis:Will LAMP enlighten us about ANCA-associated vasculitis[J].Nat Rev Nephrol,2012,8(6):318-320.
[9]尹晓琳,石新丽,魏林,等.尿路致病性大肠杆菌I型菌毛fimH和fimC基因原核表达质粒的构建及表达[J].中国人兽共患病学报,2007,23(11):1131-1134.
