外周血中性/淋巴细胞比例对直肠癌患者手术预后的预测价值
2014-03-04李芳飘
李芳飘
(海南省三亚市人民医院肝胆外科 572000)
随着社会环境的改变、饮食结构的变化和基因的影响,结直肠癌发生率逐年升高[1],2008年世界卫生组织报告新发结直肠癌120.0万例,死亡达60.9万例,在全世界男性肿瘤中位居第3位,女性肿瘤中位居第2位。我国近年结直肠癌也呈逐年增长趋势,占恶性肿瘤的10.56%,位居第3位,其中直肠癌占50%左右[2-3]。有研究显示,机体对肿瘤的炎性反应与肿瘤细胞的抑制存在相关性,在肺癌和胃癌患者术前检测外周血中性/淋巴细胞比例(neutrophil-ly mphocyte ratio,NLR)可以有效预测预后。本研究拟在直肠癌患者中检测NLR水平,探索NLR水平与直肠癌术后预后的关系,现报道如下。
1 资料与方法
1.1 一般资料 选择本院2005~2007年住院行直肠癌根治术,且术后经过病理学确诊为Ⅲ期,随访资料完整的68例患者作为研究对象。其中,男41例,女27例,年龄28~72岁,平均(58.4±11.2)岁。
1.2 方法
1.2.1 研究方法 采用受试者工作曲线(ROC)截取最佳NLR,以最佳NLR截点值分为高NLR组和低NLR组,比较两组临床病例特征和术后生存率。
1.2.2 检测方法 所有患者术前采集静脉血3 mL,放置于二乙胺四乙酸二钾抗凝采集管。采用BC-2300全自动血细胞分析仪(上海恒盛医疗生产)检测各项血常规指标,计算NLR。术后病理标本采用10%甲醛固定后行石蜡包埋切片,送医院病理科检查。
1.2.3 术后随访 采取门诊复查与电话相结合的方式对患者进行随访,术后2年内每3个月1次,之后每6个月1次随访患者治疗情况并指导患者定期复查,了解患者的生存状态。随访截止时间为2012年12月31日。
1.3 统计学处理 采用SPSS20.0统计软件进行分析。采用ROC曲线选择NLR最佳截点进行分组。两组生存率比较采用Kaplan-Meier法,组间生存率比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 ROC曲线 以ROC曲线确定NLR最佳截点,本次68例直肠癌患者,外周血NLR平均为(2.7±1.3),以外周血NLR为检验变量,生存状况为状态变量,绘制ROC曲线,当NLR为3.6时,约登指数有最大值0.697。因此取3.6作为NLR最佳截点值,评估直肠癌生存状况的灵敏度为81.3%,特异度为88.5%,见图1。根据NLR最佳截点值,NLR≥3.6为高NLR组(19例),NLR<3.6为低NLR组(49例)。
2.2 临床一般资料状况比较 高NLR组与低NLR组患者性别、年龄、远处转移、分化程度癌胚抗原(CEA)和手术方式比较,差异无统计学意义(P<0.05),见表1。
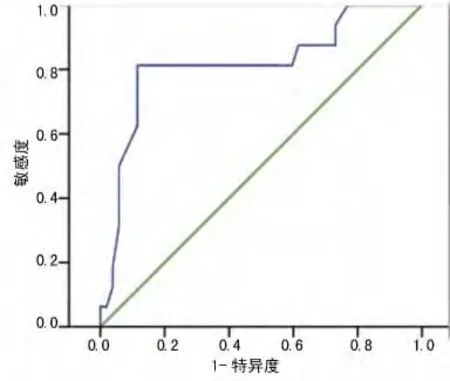
图1 以NLR值3.6为最佳截点值评估患者生存情况的ROC曲线
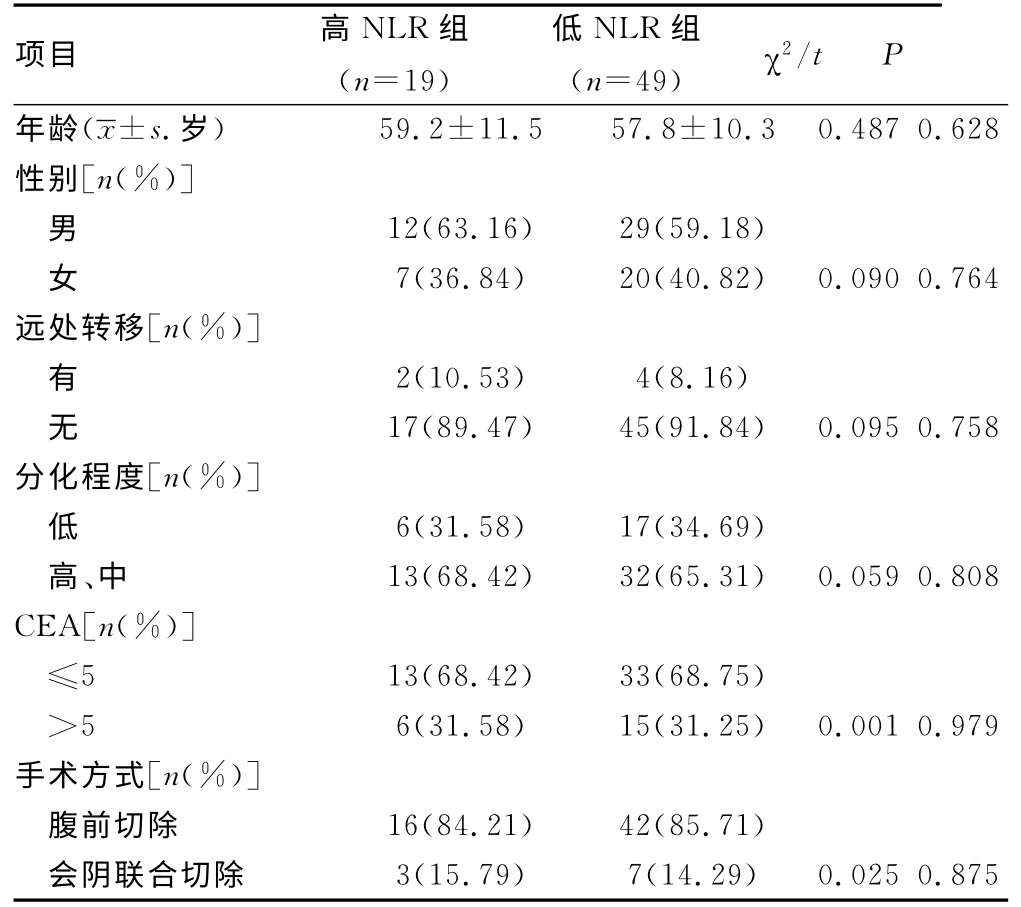
表1 两组临床一般资料比较
2.3 高NLR组与低NLR组生存率比较 术前高NLR组与低NLR组患者的1、3、5年生存率分别为89.5%、57.9%、52.6%和95.9%、79.6%、75.5%,两组生存率比较差异有统计学意义(P<0.05)。见图2。
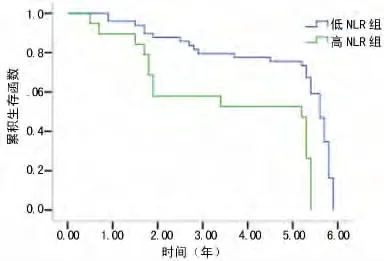
图2 术前高NLR组与低NLR组生存率比较
3 讨 论
近年来,对肿瘤患者机体肿瘤免疫指标NLR值的研究认为,NLR可以作为多种肿瘤性疾病不良预后的预测指标;对结直肠癌患者的肿瘤免疫性指标NLR的研究显示,高NLR值可能预示着机体抗结直肠癌的免疫作用降低,结直肠癌患者常表现为预后不良[4]。
本研究采用ROC曲线法,截取NLR值3.6为最佳截点值进行分组研究,兼顾了测量的灵敏度和特异度,有利于对直肠癌患者研究结果进行检测诊断和推广应用。结果显示,术前高NLR组手术后1、3、5年生存率分别为89.5%、57.9%、52.6%,明显低于低NLR组的95.9%、79.6%、75.5%。高NLR患者往往伴随着淋巴细胞的减少和(或)中性粒细胞的增加。淋巴细胞的减少主要是CD3、CD4细胞降低,导致CD3、CD4淋巴细胞介导的肿瘤免疫功能低下,肿瘤转移和复发的风险增加[5-7]。中性粒细胞的增高导致分泌过多的血管内皮细胞生长因子(VEGF),而VEGF的表达过度为肿瘤细胞的生长和增殖提供了有利的环境,促使肿瘤血管的生成,加快肿瘤的增殖和远处转移。低淋巴细胞的机体环境将促使肿瘤细胞的转移扩散。在本研究中高NLR组患者直肠癌远处转移高于低NLR组,达10.53%,但差异无统计学意义(P>0.05)。以上结果与以往对胃、肝、肾等其他部位肿瘤的研究结果基本一致[8-10]。进一步说明肿瘤免疫可引起肿瘤生物学变化,影响患者的术后生存率。也有研究认为,中性粒细胞增高的同时,通常可以观察到不成熟的或丧失功能的中性粒细胞,往往伴随着肿瘤细胞的抑制,被认为是机体对丧失功能细胞出现的一种代偿[7]。
国外多项研究显示,肿瘤负荷与机体抗肿瘤免疫存在一定的关系,当肿瘤负荷超过了一定程度后,机体抗肿瘤免疫作用不能有效抑制肿瘤细胞的生长,肿瘤细胞抗原的突变和免疫耐受,导致肿瘤细胞抗原无法被提呈识别,肿瘤细胞逃逸了机体免疫系统的侵袭而呈对数期生长和微转移,当手术切除后,使得瘤负荷减少,有利于机体抗肿瘤免疫效应对抗剩余的肿瘤细胞[7]。虽然手术治疗是直肠癌肿瘤治疗的首选方法,通过手术增强机体对抗肿瘤细胞的同时,手术创伤也可能损伤机体的自身免疫,对老年和合并其他严重疾病的患者应进行术前评估,综合考虑各方面因素再决定是否进行手术治疗。
总之,NLR值是一个有效的评估肿瘤患者生存预后的独立预测生化指标,选择具有高灵敏度和特异度的截点值,可以较为方便地对NLR进行预后评估,操作便捷,可以动态观察患者机体的免疫功能变化,通过综合评估患者的预后风险,制定有效的个体化抗肿瘤治疗方案,延长患者的生存寿命。
[1]宫媛,吴本俨,苏斌斌.272例直肠癌患者的预后影响因素分析[J].解放军医学杂志,2008,33(5):608-610.
[2]张雷.结直肠癌新辅助治疗进展[J].重庆医学,2013,42(5):581-583.
[3]黄景山.老年直肠癌患者188例预后因素分析[J].中国老年学杂志,2011,31(17):3260-3262.
[4]李坚,贾英斌,蔡潮农,等.中性/淋巴细胞比例动态变化对结肠癌术后及化疗后患者无复发生存的预测价值[J].中华胃肠外科杂志,2012,15(11):1171-1173.
[5]邱海波,伍小军,周志伟,等.结直肠癌患者外周血T淋巴细胞亚群和NK细胞数目的变化及其临床意义[J].广东医 学,2009,30(3):447-449.
[6]肖秀英,于宝华,颜歌,等.结直肠癌患者外周血T淋巴细胞亚群及NK细胞检测的临床意义[J].中国医药导刊,2009,11(4):547-548,550.
[7]王智,马晋平,林建伟,等.术前中性粒细胞与淋巴细胞比值与结直肠癌患者预后的关系[J].消化肿瘤杂志:电子版,2011,3(4):246-250.
[8]Shimada H,Takiguchi N,Kainuma O,et al.High preoperative neutrophil-lymphocyte ratio predicts poor survival inpatients with gastric Cancer[J].Gastric Cancer,2010,13(3):170-176.
[9]Shimada H,Takiguchi N,Kainuma O,et al.High preoperative neutrophil-lymphcyte ratio predicts poor survival inpatients with gastric Cancer[J].Gastric Cancer,2010,13(3):170-176.
[10]曹策,韩承新,蔡晓军,等.中性粒细胞与淋巴细胞比例与胃癌转移淋巴结坏死的关系[J].武警医学,2013,24(1):33-36.
