Ig A肾病患者尿蛋白和血管内皮生长因子的相关性研究
2014-03-04李佩宏李文奇
李佩宏,李文奇
(新乡医学院:1.外科学总论实验室;2.解剖学实验室,河南新乡453003)
血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种分泌性糖蛋白,作为血管内皮细胞特异性的促有丝分裂原,可促进血管内皮增生,继而加速新生血管生成[1-2]。近年来发现多种肾脏疾病的肾组织VEGF水平异常[3],但对Ig A肾病VEGF的表达水平研究较少,因此本研究从肾组织VEGF表达、血和尿VEGF水平来分析了Ig A肾病的VEGF情况。Ig A肾病是常见的原发性肾小球病之一,可出现蛋白尿等临床表现[4],因此本研究也分析了Ig A肾病尿蛋白与VEGF的相关性,现报道如下。
1 资料与方法
1.1 一般资料 选择新乡医学院第三附属医院2007年6月至2011年6月收治的67例Ig A肾病患者(Ig A肾病组),其中男39例,女28例,年龄22~62岁,平均(45.3±9.7)岁;Lee氏分级:Ⅰ级14例,Ⅱ级18例,Ⅲ级23例,Ⅳ级12例;临床分型:孤立性血尿型9例,孤立性蛋白尿型16例,血尿伴蛋白尿型20例,急性肾炎型9例,肾病综合征型13例;肾小管间质轻度损伤22例,中度损伤29例,重度损伤16例;Kataf uci总积分小于9分13例,9~18分26例,>18分28例。纳入标准:(1)均经肾活检确诊;(2)年龄在65岁以下;(3)排除紫癜性肾炎、慢性肝病、乙型肝炎病毒相关性肾炎和狼疮性肾炎等继发性Ig A肾病。同时选取60例健康体检者(健康对照组)和41例狼疮性肾炎(狼疮性肾炎组)作对比,两组的性别构成、年龄与Ig A肾病组比较,差异无统计学意义(P<0.05),具有可比性。
1.2 方法
1.2.1 检测方法 选取入组病例的肾脏组织并行免疫组织化学技术PV6000二步法检测VEGF的表达情况。患者于入院次日,前臂静脉抽血5 mL,同时留取空腹中段晨尿5.0 mL,离心后均保留上清,采用固相夹心ELISA测定血和尿VEGF水平,严格按照试剂盒说明书进行。
1.2.2 免疫组织化学法步骤[5]及评价方法[6]将肾脏组织蜡块复温后切成5μm厚的切片,依次经二甲苯脱蜡、乙醇水化、柠檬酸缓冲液微波修复抗原、H2O2去离子水灭活内源性过氧化物酶后,加入一抗VEGF(稀释比例1∶50),37℃温箱孵育1 h;滴入通用型Ig G抗体-HRP多聚体,37℃温箱孵育25 min;DAB溶液显色,苏木素复染、分化、脱水、透明、中性树胶封片。采用阳性细胞计数与染色强度相结合的二级计分法评价免疫组织化学法结果。染色强度:阴性为0分,淡黄色为1分,黄或深黄色为2分,褐或棕褐色为3分;阳性细胞计数:0%~10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。
1.2.3 治疗方法 均给予Ig A肾病患者泼尼松口服,起始剂量为每天1 mg/kg(最大剂量为60 mg/d),8~12周后减量,每2周减量5~20 mg/d,以后4周每2周减量2.5 mg/d,其后每4周减2.5 mg/d,直至10 mg/d维持。用药期间不使用其他免疫抑制剂,密切监视患者的血常规、尿常规及生命体征情况。
1.3 评价指标 (1)分析Ig A肾病总体及不同病理参数(Lee氏分级、临床分型、肾小管间质损伤和Kataf uchi总积分)的肾脏VEGF表达、血和尿VEGF水平,并与健康对照组和狼疮性肾炎组比较;(2)分析Ig A肾病不同尿蛋白程度(<1.0 g、1.0~3.0 g、>3.0 g)的肾脏VEGF表达,血和尿VEGF水平及相关性;(3)以3.0 g 24 h尿蛋白和200.0 pg/mL尿VEGF为界值,将患者分为4个组合,即“尿蛋白小于或等于3.0 g,尿VEGF≤200.0 pg/mL”、“尿 蛋 白 小 于 或 等 于3.0 g,尿VEGF>200.0 pg/mL”、“尿蛋白大于3.0 g,尿VEGF≤200.0 pg/mL”和“尿蛋白大于3.0 g,尿VEGF>200.0 pg/mL”,分析组合间的血清清蛋白(s Alb)、Ig A、肌酐(Cr),估算肾小球滤过率(e GFR)、尿β2-微球蛋白(β2-MG)、尿 渗透压 和血尿素氮(BUN)及治疗效果。
1.4 疗效评价标准[7]完全缓解:24 h尿蛋白小于0.3 g,s Alb≥35 g/L,Cr及e GFR恢复正常或稳定;部分缓解:相对于基础值,24 h尿蛋白定量下降幅度超过50%(但大于或等于0.3 g),s Alb≥30 g/L,Cr及e GFR恢复正常或稳定;治疗无效:相对于基础值,24 h尿蛋白定量下降幅度小于50%,其他指标恶化。显效=完全缓解+部分缓解,计算显效率。
1.5 统计学处理 采用SPSS16.0软件进行数据分析,计量资料以±s表示,两组比较采用成组t检验,多组比较采用单因素方差分析,两两比较采用SNK-q法,以尿蛋白水平为因变量行VEGF的直线相关回归分析,治疗效果采用率表示,并行χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 Ig A肾病不同病理参数的VEGF分布情况 Ig A肾病组的尿和血VEGF水平高于健康对照组和狼疮性肾炎组(P<0.01),肾组织VEGF表达高于狼疮性肾炎组(P<0.01);且Ig A肾病的VEGF水平在Lee氏分级、肾小管间质损伤和Kataf uchi总积分方面,差异有统计学意义(P<0.05),且随着病理严重程度的增加而升高,但在临床分型上差异无统计学意义,见表1。肾组织的VEGF免疫组织化学图,见图1。
表1 不同病理参数的VEGF分布情况(±s)

表1 不同病理参数的VEGF分布情况(±s)
a:P<0.01,与健康对照组比较;b:P<0.01,与狼疮性肾炎组比较;c:组间差异有统计学意义;-:表示此项无数据。
组别 n 肾组织VEGF表达(分) 尿VEGF(pg/mL) 血VEGF(pg/mL)健康对照组70 - 22.53±1.05 38.42±2.31狼疮性肾炎组 41 1.24±0.42 41.47±6.42 a 59.76±24.73 a Ig A肾病组 67 7.85±3.25a 314.74±114.38ab 438.77±156.25ab Lee氏分级c Ⅰ级 14 3.05±1.13 67.62±24.35 89.55±32.42 Ⅱ级 18 6.45±2.37 164.38±45.81 218.24±123.73 Ⅲ级 23 9.37±2.62 343.29±107.70 384.69±159.46 Ⅳ级 12 11.72±3.51 429.56±162.46 556.13±242.74临床分型 孤立性血尿型 9 9.46±3.13 362.91±95.58 412.83±132.82 孤立性蛋白尿型 16 10.36±2.74 455.63±214.76 383.72±176.68 血尿伴蛋白尿型 20 10.73±3.62 392.57±192.35 506.27±235.41 急性肾炎型 9 9.62±3.75 427.38±153.62 394.38±182.57 肾病综合征型 13 11.08±4.13 345.82±185.94 473.45±213.56肾小管间质损伤c 轻度 22 4.47±1.38 144.51±64.26 157.37±78.92 中度 29 8.86±2.03 237.83±108.64 376.56±117.64 重度 16 11.29±3.46 365.58±164.22 492.77±185.78 Kataf uchi总积分c <9分 13 3.81±1.62 112.58±56.95 217.56±92.61 9~18分 26 7.59±2.65 238.65±114.37 346.71±158.43 >18分28 10.74±4.83 314.74±127.54 507.39±247.56
2.2 Ig A肾病不同尿蛋白水平的VEGF分布及其相关性 Ig A肾病不同程度尿蛋白患者的肾组织VEGF表达、尿和血VEGF水平之间,差异有统计学意义(P<0.05),且随着尿蛋白水平的增加递增,见表2。Ig A肾病的尿蛋白水平与肾组织VEGF表达、尿和血VEGF呈正相关(r=0.59,P<0.01;r=0.46,P<0.01;r=0.37,P<0.05),见图2。
2.3 Ig A肾病不同尿蛋白和VEGF组合的生化指标 Ig A肾病同一尿蛋白水平不同VEGF水平间的s Alb、血Ig A、Cr、e GFR、β2-MG、尿渗透压和BUN差异有统计学意义(P<0.05);尿VEGF≤200.0 pg/mL的患者中,除β2-MG外,尿蛋白不同水平间,其余指标差异均有统计学意义(P<0.05);尿VEGF>200.0 pg/mL的患者中,除血Ig A和e GFR外,尿蛋白不同水平间,其余指标差异均有统计学意义(P<0.05),见表3。
2.4 Ig A肾病不同尿蛋白和VEGF组合的治疗效果 Ig A肾病同一尿蛋白水平,尿VEGF≤200.0 pg/mL的显效率高于尿VEGF>200.0 pg/mL(P<0.05);同一VEGF水平,不同尿蛋白间的完全缓解和部分缓解例数,差异有统计学意义(P<0.05),但显效率差异无统计学意义(P>0.05),见表4。

图1 肾脏组织的VEGF免疫组织化学图
表2 不同尿蛋白水平的VEGF分布(±s)

表2 不同尿蛋白水平的VEGF分布(±s)
a:P<0.05,与“<1.0 g”比较;b:P<0.05,与“1.0~3.0 g”比较。
24 h尿蛋白(g) n 肾组织VEGF表达(分) 尿VEGF(pg/mL) 血VEGF(pg/mL)<1.0 9 3.52±0.97 117.56±64.38 248.73±87.61 1.0~3.0 37 5.67±2.35 a 204.37±127.51 a 365.28±125.46 a>3.0 21 9.92±3.23 ab 367.29±145.76 ab 518.61±172.69 ab
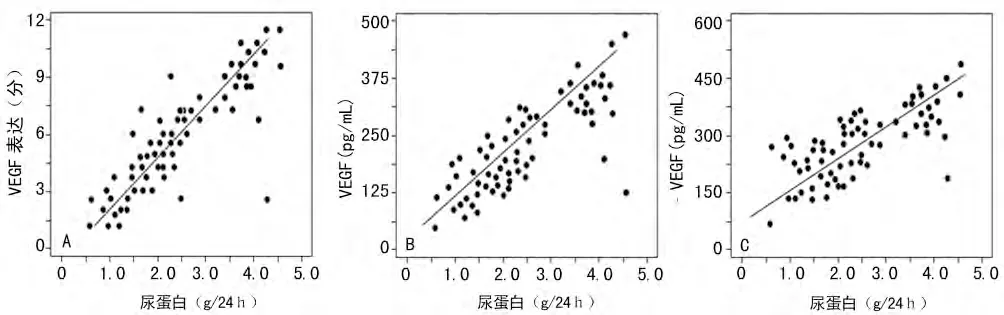
图2 Ig A肾病尿蛋白与VEGF的直线回归分析图
表3 Ig A肾病不同尿蛋白和VEGF组合的生化指标(±s)

表3 Ig A肾病不同尿蛋白和VEGF组合的生化指标(±s)
项目尿蛋白“≤3.0 g”尿VEGF≤200.0(n=27) 尿VEGF>200.0(n=19)尿蛋白“>3.0 g”尿VEGF≤200.0(n=6) 尿VEGF>200.0(n=15)s Alb(g/L) 14.25±3.28 22.56±6.57a 25.77±8.03 b 36.29±12.37 ab血Ig A(g/L) 2.67±0.73 3.38±1.14a 3.14±1.07 b 3.89±1.58a Cr(μmol/L) 56.87±12.32 84.25±17.89 a 73.61±12.85 b 94.54±22.63 ab e GFR 89.13±17.56 67.58±12.35 a 71.36±22.42b 60.27±14.59 a

续表3 Ig A肾病不同尿蛋白和VEGF组合的生化指标

表4 Ig A肾病不同尿蛋白和VEGF组合的治疗效果[n(%)]
3 讨 论
VEGF可促进血管再生,同时亦可促进肾脏缺血性疾病的侧支循环建立,增加代偿机制,改善组织缺血[7-8]。在肾脏的基本结构中,肾小球主要由毛细血管组成,VEGF可在内皮细胞中表达,而Ig A肾病是常见的原发性肾小球病,在肾小球系膜区可见Ig A或Ig A沉积为主的病理改变,导致肾小球结构损伤[9],如间质损伤和系膜增生等,因此推测Ig A肾病的VEGF水平会出现异常。在狼疮性肾炎中发现肾脏组织的VEGF表达升高,认为缺氧、缺血是导致VEGF升高的主要原因[10],而Ig A肾病由于肾脏受损,也存在缺氧、缺血环境,故刺激了Ig A患者VEGF的表达。肾活检是诊断疾病的金标准,也是获取肾脏组织VEGF表达的直接途径,但具有创伤性,很难在基层医院开展。尿和血VEGF水平易检测,易操作,可反复操作,目前常用于多种疾病的诊断和预测[11-12],相比肾脏组织VEGF表达水平的检测优势明显。
本研究发现,Ig A肾病的尿和血VEGF水平高于健康对照组和狼疮性肾炎组,肾组织VEGF表达高于狼疮性肾炎组,以上均表明Ig A肾病的VEGF出现异常表达,可能原因:(1)Ig A肾病的缺氧、缺血环境导致VEGF表达代偿性上调,而肾小球毛细血管基底膜结构的改变导致VEGF分泌和释放量增多[10];(2)Ig A肾病的病理改变导致调节VEGF表达合成的因素变化,间接导致VEGF表达增强。Ig A肾病VEGF不同形式的水平均上调,提示该指标的同质性较好,可用于Ig A肾病的辅助治疗。VEGF不同形式的水平在不同病理参数上的分布有差异,且随着严重程度的加重而上升,提示VEGF水平可用于预测Ig A肾病的严重程度,但在临床分型上没有差异,主要原因是该参数的异质性较高,包含多种其他参数[13]。由以上可看出,血和尿VEGF水平与肾组织VEGF表达的趋势相同,且在病理参数上的分布也一致,推测可用血和尿VEGF水平来替代肾组织VEGF表达的检测。
蛋白尿是Ig A肾病的常见临床表现[4],本研究分析VECF不同形式与尿蛋白的相关性,发现3种形式的VECF水平均随尿蛋白水平升高而增加,同时与尿蛋白的表达呈正相关,表明VEGF水平与Ig A肾病的肾损伤程度有关。本研究的特点是将尿蛋白和VEGF结合起来,分为4个亚组来分析亚组间的生化指标和治疗效果,发现组间在多种常见的生化指标及治疗效果间差异有统计学意义(P<0.05),提示检测Ig A肾病VEGF水平有更好的应用价值,可与尿蛋白共同预测Ig A肾病的严重程度及预后。
综上所述,Ig A肾病患者肾脏组织的VEGF表达增强、血和尿VEGF水平升高,均与尿蛋白呈正相关,且不同尿蛋白和VEGF组合的病理指标和治疗效果差异有统计学意义(P<0.05)。
[1]Amini A,Masoumi Moghaddam S,Morris DL,et al.The critical role of vascular endothelial growth factor in tumor angiogenesis[J].Curr Cancer Drug Targets,2012,12(1):23-43.
[2]Mahdy RA,Nada WM.Evaluation of the role of vascularendothelial growth factor in diabetic retinopathy[J].Ophthalmic Res,2011,45(2):87-91.
[3]王丽华,顾乐怡,梁馨月,等.雷帕霉素对PAN肾病小鼠肾脏病变和VEGF及受体表达的影响[J].上海交通大学学报:医学版,2010,30(4):375-380.
[4]杨富强,董明驹,朱磊.血清胱抑素C在评价Ig A肾病肾小球滤过功能中的应用[J].重庆医学,2011,40(4):349-350.
[5]蒋艳霞,李宏,李玉军.原发性肝细胞癌组织中Connexin43和CD147的表达及意义[J].临床与实验病理学杂志,2012,28(4):374-377.
[6]储节胜,徐建明,张博,等.VEGFR-2、PDGFR-β和c-MET在肝细胞癌中的表达及预后分析[J].临床肿瘤学杂志,2012,17(7):609-615.
[7]施蓓莉,倪兆慧,周敏捷,等.血清白细胞介素-18水平升高可预测Ig A肾病患者的疾病进展[J].上海医学,2012,35(1):48-52.
[8]Ohara S,Kawasaki Y,Abe Y,et al.Role of vascular endothelial growth factor and angiopoietin 1 in renal injury inhemolytic uremic syndrome[J].Am J Nephrol,2012,36(6):516-523.
[9]熊瑜,甘华,钟清.子宫球蛋白基因G38A多态性与Ig A肾病的相关性研究[J].重庆医学,2011,40(9):851-852,855.
[10]邢国兰,孙军伟,葛秀峰.Ig A肾病患者肾组织中血管内皮生长因子与内皮素-1蛋白的表达[J].郑州大学学报:医学版,2011,46(4):590-592.
[11]苏钰,陈长征,李璐,等.增生型糖尿病视网膜病变患者玻璃体血管内皮生长因子及其受体浓度检测[J].中华眼底病杂志,2012,28(3):289-290.
[12]任选义,魏金星,李华强,等.转录因子Spl和血管内皮生长因子在进展期肾癌中的表达及临床意义[J].中华实验外科杂志,2012,29(3):498-499.
[13]韩媛,黄松明,张维真,等.儿童免疫球蛋白A肾病临床与病理分析[J].实用儿科临床杂志,2006,21(5):284-285.
