四川冬菜中苯乳酸高产菌株的分离与鉴定
2014-03-04邓林
邓林
(四川工商职业技术学院酒类与食品工程系,四川都江堰611830)
四川冬菜中苯乳酸高产菌株的分离与鉴定
邓林
(四川工商职业技术学院酒类与食品工程系,四川都江堰611830)
通过双层平板拮抗法和牛津杯琼脂扩散法抑菌试验,从传统发酵食品四川冬菜中分离筛选得到18株乳酸菌。结合反相高效液相色谱法得到1株苯乳酸高产菌株DL-13,其发酵上清液中苯乳酸含量为143mg/L。结合菌落形态、细胞形态、生理生化特性,最终确定菌株DL-13为植物乳杆菌。
四川冬菜;苯乳酸;筛选;鉴定
苯乳酸(phenyllactic acid,PLA)即2-羟基-3-苯基丙酸[1-2],是近年来新发现的一种天然抑菌化合物,在食品生产中可作为新型生物防腐剂使用,具有较好的抑菌谱、溶解性和稳定性[3]。很多微生物如乳酸菌(Lactobacillus)[4]、白地霉(Geotrichum candidum)[2]、红球菌(Rhodococcus)[5]和丙酸霉(Propionic acid mildew)[6]都能产生苯乳酸。乳酸菌是公认为安全(generally recognized as safe,GRAS)的微生物,近年来研究的热点转为通过乳酸菌发酵生产苯乳酸[7-9]。2000年,LAVERMICOCCA P等[1]首次报道从酸面团中分离到的植物乳杆菌(Lactobacillus plantarum)21B,苯乳酸产量达到56.44mg/L。随后研究相继获得多株产苯乳酸的乳酸菌,但菌株间产量差异较大,且苯乳酸产量相对都较低[4,10]。要实现微生物工业化发酵生产苯乳酸,必须要有高产苯乳酸的菌种来源,所以苯乳酸生产菌的筛选具有重要的研究价值和意义。
四川冬菜是一种半干态发酵性腌制品,细嫩味鲜,香气浓郁,是四川人常食用的一种传统发酵食品[11]。本研究选用四川冬菜作为乳酸菌资源,通过双层平板拮抗法和牛津杯琼脂扩散法的初筛试验,再结合反相液相色谱法检测发酵液中苯乳酸含量,分离筛选出1株高产苯乳酸的乳酸菌菌株,并对菌株进行了初步鉴定,以期为进一步的菌种驯化选育及工业化发酵生产苯乳酸奠定理论基础,为其在食品工业中的应用提供菌种来源,也能为四川冬菜中发酵微生物菌群的研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验样品
四川冬菜:四川工商职业技术学院食品生物技术实验室自制。
1.1.2 主要试剂
苯乳酸:美国Sigma公司。其他试剂均为分析纯:成都金山化学试剂有限公司。
1.1.3 培养基
乳酸细菌培养基(MRS):蛋白胨10.0g,牛肉膏10.0g,酵母膏5.0g,柠檬酸氢二铵2.0g,葡萄糖20.0g,吐温-80 1.0mL,乙酸钠5.0g,磷酸氢二钾2.0g,硫酸镁0.58g,硫酸锰0.25g,琼脂18.0g,蒸馏水1 000mL,pH 6.2~6.6。
LB培养基:胰蛋白胨10.0g,酵母膏5.0g,氯化钠10.0g,琼脂15.0g,蒸馏水1 000mL,pH7.0。
初筛培养基:在MRS培养基中添加质量分数为3%的碳酸钙和0.1%山梨酸钾。
发酵培养基:液体MRS培养基。
1.2 仪器与设备
FA 2004型电子分析天平:上海精密仪器有限公司;LRH-250型生化培养箱:上海齐欣科学仪器有限公司;奥林巴斯生物显微镜:日本奥林巴斯公司;Agilent 1100型高效液相色谱仪、Agilent Zorbax SB-C18 USP L1分析柱(4.6mm×150mm,5μm):美国Agilent公司。
1.3 方法
1.3.1 乳酸菌的分离筛选试验设计

1.3.2 乳酸菌的分离
将10g于组织捣碎机中粉碎后的四川冬菜倒入三角瓶中,加200mL蒸馏水,充分振荡。取1mL冬菜处理液分别接种于苯乳酸含量为1mg/mL、2mg/mL、3mg/mL、4mg/mL、5mg/mL、6mg/mL的初筛培养基中,37℃富集培养24h。采用常规平板梯度稀释法进行初筛,挑选有碳酸钙溶解圈的单菌落进行镜检[11-12]。将单菌落平板划线进行纯化培养,反复3次。挑取单菌落转接于斜面MRS培养基上,37℃培养24h后放入冰箱,4℃保存备用。
1.3.3 初筛方法
双层平板拮抗法:指示菌为金黄色葡萄球菌。平板下层为固体MRS培养基,受试菌于下层培养基上划线后,置于恒温培养箱中37℃培养48h。然后倾注10mL半固体LB培养基于平板上层。将金黄色葡萄球菌配成浓度为106CFU/mL的菌悬液,均匀涂布于上层培养基,37℃培养24h,观察抑菌情况[13]。
牛津杯琼脂扩散法抑菌试验:取发酵液于100℃保温20min后,5 000r/min离心15min。取上清液调节pH值至5,进行抑菌试验。
游标卡尺十字交叉法测量抑菌圈直径:以抑菌圈直径(cm)为指标,重复3次,取平均值作为结果。
1.3.4 复筛方法
将菌株以5%接种量接种于发酵培养基中,37℃培养36h。得到的发酵液经过5 000r/min离心15min后取上清液,使用反相高效液相色谱法测定苯乳酸的含量,筛选出苯乳酸高产菌株。
反相高效液相色谱法条件为:流动相A为0.5g/L三氟乙酸溶液,B为乙腈溶液,洗脱程序是:0~20min为10%~100%B,20~23min保持100%B,流速1mL/min。检测波长为210nm,柱温30℃,进样量10μL[14-15]。
1.3.5 苯乳酸标准曲线的绘制
称取0.300 0g苯乳酸标准品,溶于0.1%磷酸缓冲液(pH2.5),定容至10mL。稀释苯乳酸溶液质量浓度分别为60mg/L、90mg/L、120mg/L、150mg/L、180mg/L。用0.45μm膜过滤各质量浓度的标准品溶液后用反相高效液相色谱法测定。
2 结果与分析
2.1 标准曲线回归方程的建立
以峰面积A(y)对苯乳酸标准液质量浓度(x)作标准曲线,得到苯乳酸标准曲线见图1。

图1 苯乳酸的标准曲线Fig.1 Standard curve of phenyllactic acid
2.2 四川冬菜中产苯乳酸菌株的分离筛选
2.2.1 出发菌株对苯乳酸耐受力
出发菌株于液体MRS培养基中培养时对苯乳酸的耐受力结果见表1。

表1 出发菌株对苯乳酸的耐受力Table 1 Tolerance of original strain to phenyl-lactic acid
菌株对产物的耐受力与产物存在没有必然的联系,而与菌株个体特性相关。但在培养基中添加适当浓度的产物,较容易筛选出产量较高且对产物耐受力较强的菌株[16]。由表1可知,当苯乳酸质量浓度由1mg/mL逐渐增加至3mg/mL时,菌株生长良好,当苯乳酸质量浓度为4mg/mL时,出发菌株长势较弱,且当苯乳酸质量浓度高于5mg/mL时菌株不能正常生长。因此以4mg/mL作为苯乳酸高产菌株的初筛浓度。
2.2.2 初筛结果
用四川冬菜处理液进行碳酸钙溶解圈试验,筛选得到菌株128株。双层平板拮抗法筛选结果见图2,可知受试菌株对金黄色葡萄球菌有明显的抑制作用。牛津杯琼脂扩散法抑菌试验结果见图3,抑菌圈直径为28mm,可见发酵液对金黄色葡萄球菌有明显的抑制作用。选择抑菌圈直径≥25mm的菌株进行下一步试验,得到菌株18株。

图2 双层平板拮抗法筛选结果Fig.2 Screening result of antibacterial test by double plate antagonistic method

图3 牛津杯琼脂扩散法抑菌试验筛选结果Fig.2 Screening result of antibacterial test by Oxford cup agar diffusion method
2.2.3 反相高效液相色谱测定结果
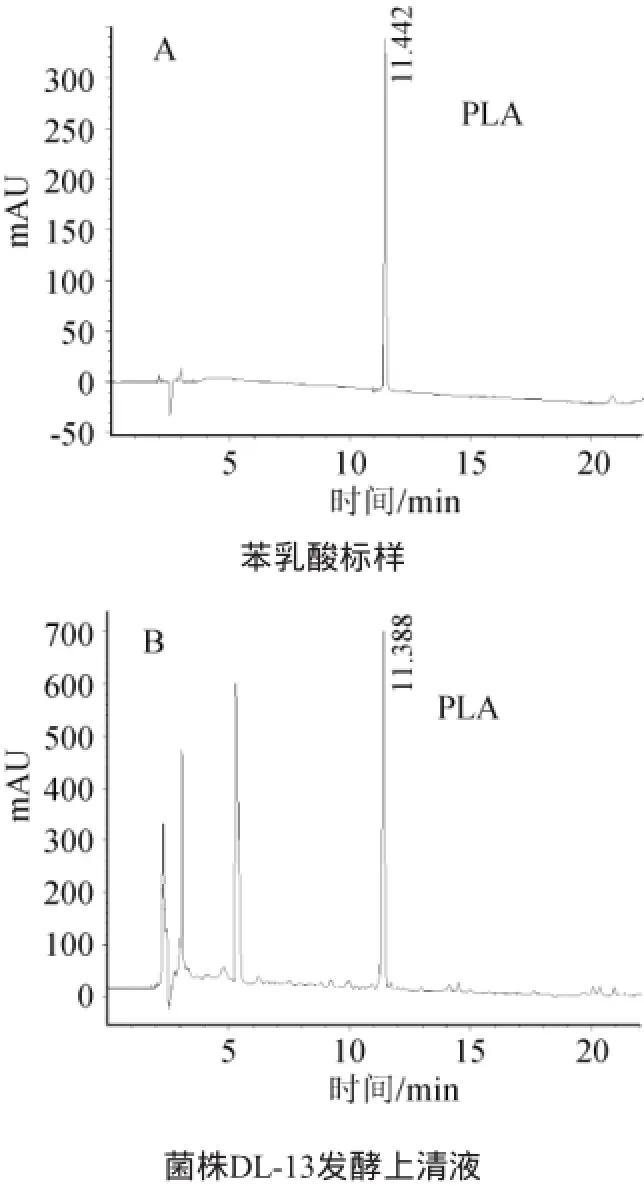
图4 苯乳酸标样(A)及菌株DL-13发酵上清液(B)的HPLC图谱Fig.4 Chromatograms of phenyllactic acid standard(A)and strain DL-13 fermentation supernatant(B)
反相高效液相色谱测定结果显示,18株菌株的发酵上清液都出现了苯乳酸色谱峰,表示其都具有通过自身代谢发酵产苯乳酸的能力,其中有8株菌的发酵产物中苯乳酸含量在80mg/L以上,菌株DL-13发酵液中苯乳酸含量最高,达到143mg/L。苯乳酸标样和菌株DL-13发酵上清液反相高效液相图谱见图4。
2.3 菌株的鉴定
2.3.1 形态学鉴定
将获得的高产菌株DL-13接种于MRS固体培养基上,37℃恒温培养48h,观察菌落形态。挑取单菌落进行革兰氏染色,芽胞染色,鞭毛染色,并在显微镜下观察菌体形态[17]。
菌株DL-13在MRS固体培养基上培养时菌落突起,圆形,边缘整齐,光滑,湿润,灰白色。在含3%碳酸钙的MRS固体培养基上形成明显的透明圈。
菌株DL-13为革兰氏阳性短杆状细胞,单个、成对或形成短链,大小为(0.5~1.0)mm×0.5mm,无芽胞,不具运动性。
2.3.2 生理生化特性鉴定
对菌株DL-13进行硝酸盐还原试验,乙酰基甲醇(Voges-Proskauer,VP)试验,甲基红(methy red,MR)试验,糖发酵试验等,参照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及试验方法》,进行鉴定。生理生化特性结果见表2。

表2 菌株DL-13的生理生化特性Table 2 Biochemical and physiological characteristics of strain DL-13
根据形态学特征、生理生化特性结果,对照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及试验方法》,由表2结果,将DL-13菌株鉴定为植物乳杆菌,并命名为Lactobacillus plantarumDL-13。
3 结论
四川省传统发酵食品冬菜是一种半干态发酵性腌制品,在发酵的过程中涉及到多种微生物的联合协同作用。对四川冬菜中的发酵微生物菌群进行了研究,在菌种初筛时添加一定质量浓度的苯乳酸,通过双层平板拮抗法结合牛津杯琼脂扩散法抑菌试验,分离筛选得到了一株高产苯乳酸的菌株DL-13。对其发酵上清液进行反相液相色谱测定,其苯乳酸含量为143mg/L。
通过形态学、生理生化鉴定分析,初步鉴定分离得到的高产苯乳酸的菌株DL-13为植物乳杆菌,命名为Lactobacillus plantarumDL-13。
[1]LAVERMICOCCA P,VALERIO F,EVIDENTE A,et al.Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarumstrain 21B[J].Appl Environ Microb,2000,66 (9):4084-4090.
[2]DIEULEVEUX V,DER VAN P,CHATAUD J,et al.Purification and characterization of anti-Listeria compounds produced byGeotrichum candidum[J].Appl Environ Microb,1998,64(2):800-803.
[3]DIEULEVEUX V,LEMARINIER S,GUEGUEN M.Antimicrobial spectrum and target site of D-3-pheyllactic acid[J].Int J Food Microb,1998, 40(3):177-183.
[4]MAGNUSSON J,STROM K,ROOS S,et al.Broad and complex antifungal activity among environmental isolates of lactic acid bacteria[J]. FEMS Microbiol Lett,2003,219(1):129-135.
[5]BRUNHUBERNM,THODENJB,BLANCHARDJS,etal.Rhodococcus L-phenylalanine dehydrogenase:kinetics,mechanism,and structural basis forcatalyticspecificity[J].Biochemistry,2000,39(31):9174-9187.
[6]THIERRY A,MAILLARD M B.Production of cheese flavor compounds derived from amino acid catabolism byPropionibaterium freudenreichii [J].Lait,2002,82(1):17-32.
[7]SCHNURER J,MAGNUSSON J.Antifungal lactic acid bacteria as biopreservatives[J].Trends Food Sci Tech,2005,16(1-3):70-78.
[8]沐万孟,周宏敏,刘凤丽,等.苯乳酸的快速检测研究[J].食品与发酵工业,2008,34(11):135-138.
[9]李兴峰,江波,潘蓓蕾.新型生物防腐剂——苯乳酸在食品中的研究与应用[J].食品与发酵工业,2007,33(5):87-91.
[10]STROM K,SJOGREN J,BROBERG A,et al.Lactobacillus plantarum MiLAB 393 produces the antifungal cycle dipeptides cyclo(L-Phe-LPro)and cyclo(L-Phe-trans-4-OH-L-Pro)and 3-phenyllactic acid[J]. Appl Environ Microb,2002,68(9):4322-4327.
[11]邓林,刘延岭,魏明英,等.四川冬菜卤水发酵制取酱油的工艺研究[J].食品与发酵科技,2012,48(3):26-29.
[12]刘晓辉,陈顺,高晓梅,等.酸菜中乳酸菌的分离筛选与鉴定研究[J].中国酿造,2009,28(2):62-63.
[13]张莉力,柴虹宇.产苯乳酸乳酸菌的筛选及鉴定[J].安徽农业科学,2010,38(5):2590-2592.
[14]李世龙.传统发酵食品中高产苯乳酸菌株的筛选及发酵工艺条件优化[D].哈尔滨:黑龙江八一农垦大学硕士论文,2012.
[15]刘长建,刘秋,姜波,等.产苯乳酸乳酸菌的筛选鉴定[J].食品工业科技,2012,33(21):192-195.
[16]马春丽,张兰威.高产酸性能乳酸菌的诱变选育[J].中国乳品工业,2010,38(7):15-16.
[17]卢美欢,马英辉,王银存,等.一株细菌纤维素生产菌的分离鉴定[J].中国酿造,2013,32(7):46-49.
Isolation and identification of phenyl-lactic acid high-yield strains in Sichuan preserved vegetable
DENG Lin
(Department of Alcoholic Drink and Food Engineering,Sichuan Technology and Business College,Dujiangyan 611830,China)
By double plate antagonistic method and Oxford cup agar diffusion method of antibacterial test,18 strains of lactic acid bacteria from Sichuan preserved vegetable which could produce phenyl-lactic acid during fermentation were obtained.Results of reserved phase HPLC showed that mass concentration of phenyl-lactic acid in the culture medium supernatant of strain DL-13 was 143 mg/L.Combining with morphological,biochemistry and physiological test,strain DL-13 was identified asLactobacillus plantarum.
Sichuan preserved vegetable;phenyl-latic acid;isolation;identification
TS 255.54
A
0254-5071(2014)04-0097-04
10.3969/j.issn.0254-5071.2014.04.024
2013-12-17
四川省教育厅课题(13ZB0364)
邓林(1977-),女,副教授,硕士,研究方向为食品生物技术。
