黑木耳多糖的酰基化工艺研究
2014-03-03刘东敏胡俊飞王振宇
张 智,刘东敏,+,胡俊飞,王振宇,于 震
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150090)
黑木耳多糖的酰基化工艺研究
张 智1,刘东敏1,+,胡俊飞1,王振宇2,*,于 震1
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150090)
采用响应面法优化黑木耳多糖酰基化工艺,并考察多糖转化后的体外抗凝血作用。结果表明:采用对羟基苯甲酸作为最佳供体,酰基化的最佳工艺条件是转化温度55℃,底物与供体比例10∶1,多糖浓度0.50mg/mL,并在此条件下所测的转化率为27.26%。转化后的多糖抗凝血性能提高。
黑木耳多糖,酰基化,响应面,抗凝血
多糖的衍生化是指通过物理、化学、生物等方法对多糖分子进行结构改造,期望改变或者产生新的生物学功能。本实验采用化学的方法对多糖进行结构改造,修饰后的多糖抗凝血功能大大提高,一般来讲,修饰后的酰基化的多糖溶解度增加,有利于其活性的发挥[1]。
血栓栓塞性疾病严重威胁着人类健康,目前应用于临床治疗的抗凝血药物主要是肝素和香豆素类药物,有诱发血小板症等副作用,开发具有抗凝血作用的非肝素类药物及保健食品有着重要的意义。黑木耳又称云耳、黑菜,是一种质优的胶质食用菌和药用菌。黑木耳多糖具有抗衰老、抗血栓、预防高血脂、高血压、冠心病等作用[2-4]。因而,探索黑木耳多糖对人体血液系统的影响具有重要的意义[5]。本实验的前期对黑木耳多糖提取、纯化及分级并在此基础上对多糖进行酰基化,获得修饰后的多糖在进行体外抗凝血实验,为把黑木耳多糖及其衍生物进一步开发成为功能性食品添加剂或者药品提供相关的理论依据。
1 材料与方法
1.1 材料与仪器
东北产黑木耳 将其粉碎过40目筛,脱脂烘干后待用;葡萄糖、石油醚、丙酮、乙醚、等试剂 均为国产分析纯;凝血酶时间测定试剂盒、凝血酶原时间测定试剂盒、活化部分凝血活酶时间测定试剂盒 均购自上海太阳生物技术有限公司;动物 新西兰白兔,体重2~3kg。
722型可见分光光度计 上海光谱仪器有限公司制造;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;电子分析天平 北京赛多利斯仪器系统有限公司;DHG-9240电热恒温鼓风干燥箱 上海一恒科技有限公司;TDL-5-W台式低速离心机 湖南星科科学仪器有限公司;FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂。
1.2 黑木耳粗多糖的提取纯化工艺流程
原料预处理→90℃水浴浸提2h(1∶70),复提1次→4000r/min离心10min,取上清液→50℃减压浓缩→除蛋白(Sevage法3次脱蛋白)→95%乙醇醇沉→离心取沉淀→无水乙醇,丙酮,乙醚洗涤沉淀→50℃烘干,得粗多糖(CAAP),复溶→自来水透析24h→蒸馏水透析24h→50℃烘干→精制多糖(AAP)[6]。
1.3 黑木耳粗多糖的得率、纯度计算
按照樊黎生[7]文献中的方法计算多糖得率及多糖纯度:
黑木耳粗多糖得率(%)=(CAAP重(g)/子实体粉粒重(g))×100
精 制 多 糖(AAP)的 纯 度(%)=(AAP 多 糖 含 量(mg)/AAP重(mg))×100
1.4 黑木耳多糖的分级纯化
1.4.1 酸性多糖的制备 按照李公斌[8]文献中的方法制备酸性多糖。
1.4.2 多糖分级 用水复溶酸性多糖,然后加乙醇至终浓度40%沉淀得AAP1,上清液加乙醇至终浓度60%得到沉淀AAP2,再将上清液旋转蒸发烘干得到AAP3。
1.5 木耳多糖的衍生化实验
1.5.1 木耳多糖转化率的测定 将多糖制成溶液,采用NaOH滴定方法,用酚酞做指示剂,根据以下公式计算出转化率:
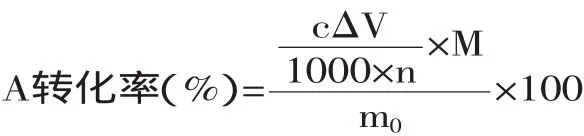
式中,m0—反应初始加入的供体,mg;c—NaOH的浓度,mol/L;ΔV—多糖加入酸后的消耗的与转化后最终滴定消耗的NaOH体积之差,mL;M—供体的分子量;n—供体游离的H+个数。
1.5.2 木耳多糖的衍生化 将浓度为5mg/mL具有较好抗凝血效果的黑木耳多糖样品与供体按照一定的比例混合,室温下振荡20min使其充分溶解,水浴加热一定时间后,NaOH滴定,计算转化率。合成后的产品在透析袋用中流动的水透析3d。最后浓缩、醇沉、并冷冻干燥后得衍生化的木耳多糖[9]。
1.5.3 供体基团的选择 将浓度为5mg/mL黑木耳多糖样品分别与供体L-赖氨酸、L-半胱氨酸、L-苹果酸、丁二酸、丙二酸、对羟基苯甲酸等按照5∶1的比例混合,室温下振荡20min使其充分溶解,50℃水浴6h进行反应,NaOH滴定,计算转化率,选择最佳供体基团。
1.5.4 单因素最佳转化条件的实验 分别以底物与供体比例、转化温度、转化时间、多糖浓度四因素进行单因素实验,按照1.5.2中的操作,以各个因素为横坐标,转化率为纵坐标,绘制曲线。
1.5.4.1 最佳多糖浓度 将浓度分别为0.5、1.0、1.5、2.0、2.5、3.0mg/mL黑木耳多糖样品分别与最佳供体按照5∶1的比例混合,室温下振荡20min使其充分溶解,50℃水浴6h进行反应,NaOH滴定,计算转化率,选择最佳底物浓度。
1.5.4.2 最 佳 底 物 与 供 体 比 例 将 浓 度 分 别 为1.0mg/mL黑木耳多糖样品分别与最佳供体分别按照1∶5、1∶1、5∶1、10∶1、15∶1、20∶1的比例混合,室温下振荡20min使其充分溶解,50℃水浴6h进行反应,NaOH滴定,计算转化率,选择最佳的底物与供体比例。
1.5.4.3 最佳转化温度 将浓度分别为1.0mg/mL黑木耳多糖样品分别与最佳供体按照10∶1的比例混合,室温下振荡20min使其充分溶解,分别在40、45、50、55、60、65℃水浴6h进行反应,NaOH滴定,计算转化率,选择最佳转化温度。
1.5.4.4 最佳转化时间 将浓度分别为1.0mg/mL黑木耳多糖样品分别与最佳供体按照10∶1的比例混合,室温下振荡20min使其充分溶解,55℃分别水浴2、3、4、5、6、7h进行反应,NaOH滴定,计算转化率,选择最佳转化时间。
1.5.5 最佳转化条件实验 根据单因素实验结果为基础,并选取上述多糖浓度、底物与供体比例、转化温度3个因素通过Design-expert 8.05软件利用Box-Benhnken中心组合方法设计三因素三水平的响应面优化实验,并据此建立数学回归模型,做响应面分析。响应面优化因素水平设计表如表1所示。

表1 响应面因素与水平Table 1 The coding table of factor and level
1.5.6 木耳多糖的红外光谱分析 木耳多糖及其化学修饰产物经溴化钾压片后,进行红外光谱分析。
1.6 体外抗凝血
1.6.1 抗凝血实验 新西兰兔正常喂养,从脖子动脉取血:将全血置于含有柠檬酸钠抗凝液(1份抗凝液+9份全血)的塑料管中,轻轻颠倒混匀,3000r/min离心15min,取上清液,即待测血浆。取按照试剂盒说明,采用手工方法测定活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、血浆凝血酶原时间(prothromtin time,PT)、血浆凝血酶时间(thromtin time,TT)[10]。
1.6.2 三种级分的木耳多糖抗凝血对比 将AAP1、AAP2和AAP3配成0.5mg/mL的溶液,按照1.6.1方法进行体外抗凝血实验,并将具有较好的抗凝血效果的级分作为下面微生物转化的原料。
1.6.3 酰基化多糖的抗凝血实验 将未转化的多糖和转化的多糖进行抗凝血实验,观察酰基化后的黑木耳多糖的抗凝血效果。
1.6.4 数 据 分 析 本 实 验 数 据 统 计 采 用SPSS 17.0分析软件对黑木耳多糖抗凝血作用进行ANOVA单因素方差分析及Ducan’s检验。
2 结果与分析
2.1 木耳多糖的提取与纯化
木耳多糖经醇沉烘干后得到粗多糖(CAAP),得率为7.89%,低于文献报道中得率,估计是提取次数太少以及Sevage法3次除蛋白过程中损失的多糖较大。透析完后获得的精制多糖(AAP)纯度为81.3%。
2.2 酸性多糖的制备及分级
将1.0%精制多糖(AAP)分成酸性多糖、中性多糖,两种多糖分别占66.08%、33.93%,本文的数据与李公斌[8]的数据相差较大,主要原因是在获得酸性多糖沉底后,要经过解离和透析,中间过程造成多糖损失较大,因此造成酸性多糖所占比例降低。然后将酸性多糖按照1.4.2进行分级得到AAP1、AAP2、AAP3三种多糖,分别占33.55%、23.48%、42.97%。
2.3 木耳多糖的衍生化实验
2.3.1 供体基团的选择 将具有较好抗凝血效果的AAP3与供体按5∶1的比例混合,50℃反应6h后得到结果见图1。由图1可以看出,加入对羟基苯甲酸获得的转化率最高,多糖转化程度最高,其次是L-半胱氨酸,L-苹果酸、丁二酸、丙二酸转化率在15%以内,结果表明对羟基苯甲酸可以提高多糖的转化率。
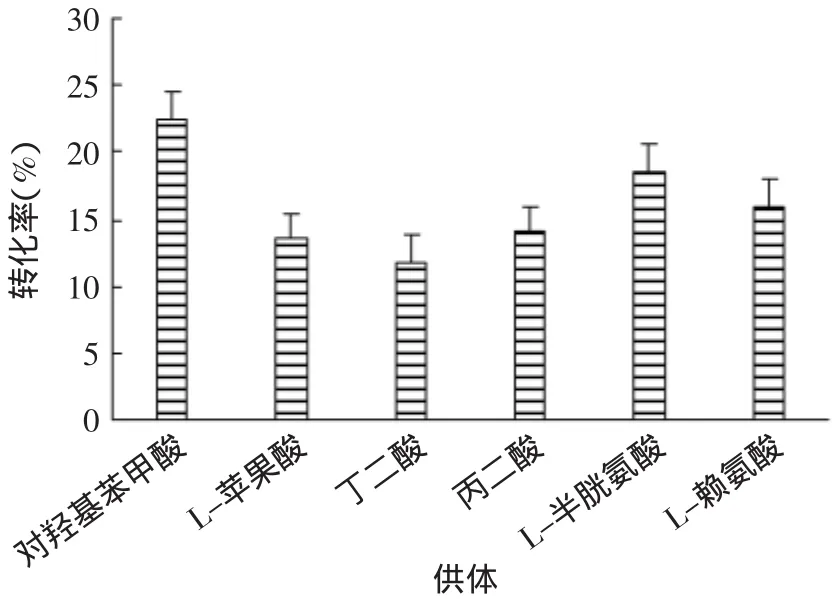
图1 各种酸类的比较Fig.1 Compare with several acid
2.3.2 多糖转化的单因素实验
2.3.2.1 多糖浓度对转化率的影响 图2反映了多糖浓度对转化率的影响情况。随着多糖浓度的增加,转化率在1.0mg/mL之前增加,之后再呈下降趋势,原因可能是木耳粘多糖的粘度增加导致供体酸不能充分接触,转化率降低。
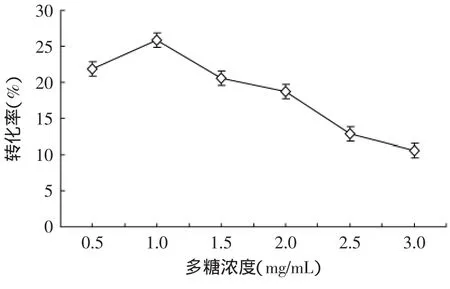
图2 多糖浓度对转化率的影响Fig.2 Effect of polysaccharide concentration on conversion rate
2.3.2.2 底物与供体比例对转化率的影响 图3反映了底物与供体比例对转化率的影响,随着比例的增加在底物与供体比例为10∶1处,转化率先增加后减小。可能是在供体一定的情况下,随着多糖的增加供体能够充分和多糖反应,但多糖的粘度也随之增加,导致当粘度增加到某点时,供体与多糖不能充分接触,导致转化率降低。
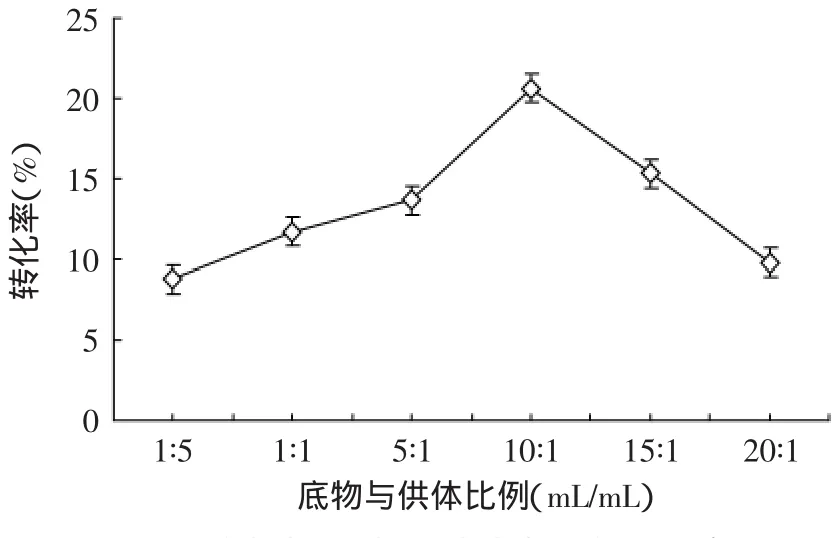
图3 底物与供体比例对转化率的影响Fig.3 Effect of the ratio of polysaccharide to acyl donor on conversion rate
2.3.2.3 转化温度对转化率的影响 图4反映了转化温度对转化率的影响,随着温度的升高转化率先升高后降低,转化温度在55℃时,转化率达到最高值。温度升高可以降低多糖的粘度,转化率升高,但是温度太高会发生副反应,导致转化率降低,故选择最佳转化温度为55℃。

图4 转化温度对转化率的影响Fig.4 Effect of conversion temperature on conversion rate
2.3.2.4 转化时间对转化率的影响 图5显示了转化时间对转化率的影响。随着转化时间的增长转化率一直呈上升趋势,在转化时间为4.0h处转化率增长趋于平缓,这说明到转化时间为4.0h时,转化基本结束,综合经济成本的考虑,选择最佳的转化时间为4.0h。
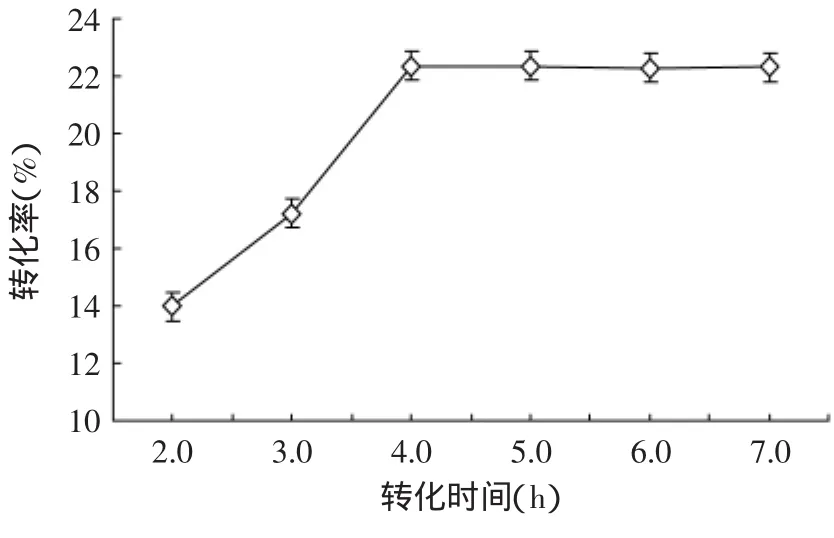
图5 转化时间对转化率的影响Fig.5 Effect of conversion time on conversion rate
2.3.3 响应面法优化最佳转化条件
2.3.3.1 响应面实验方案与结果 依据单因素实验结果利用Box-Benhnken中心组合方法设计响应面实验方案,以转化率为响应值,实验设计如表2所示。根据 Box-Behnken 法 拟 合 出 的 回 归 方 程 :Y=26.90 -0.23A+1.15B-0.84C-3.80A2-8.29B2-0.47C2-0.16AB+0.25AC-0.11BC。

表2 响应面实验方案及结果Table 2 Experiment design and estimated values of response surface
2.3.3.2 响应面实验方差分析 对上述模型方程进行方差分析,各因素的方差分析结果如表3所示。由该表数据可知,此模型是显著的(p<0.0001)。失拟性值其Prob>F值为0.2520(p>0.05),说明该模型的拟合度较好。
底物与供体比例的影响最大,其Prob>F值为小于0.0001,达到了极显著水平;转化温度影响较小,但其Prob>F值为0.0428 (p<0.05),也达到了显著水平。各因素对结果的影响按大小排序依次为B(底物与供体比例)、C(多糖浓度)和A(转化温度)。
由表3可知,各因素之间的交互作用对转化率的影响不大。A2、B2酰基化工艺影响很大,其Prob>F值均小于0.0001,达到了极显著水平,C2也对酰基化工艺影响很大,Prob>F值为0.0075,达到了显著水平。
图6~图8直观地反映了各因素之间的交互作用及其对响应值的影响。按照回归模型预测的多糖衍生化的最佳工艺条件为:转化温度54.69℃,底物与供体比例10.38∶1,多糖浓度0.54mg/mL,在此条件下,多糖衍生化转化率理论上可达到27.33%。根据实践操作的可行性考虑,校正最佳工艺条件为:转化温度55℃,底物与供体比例10∶1,多糖浓度0.50mg/mL。
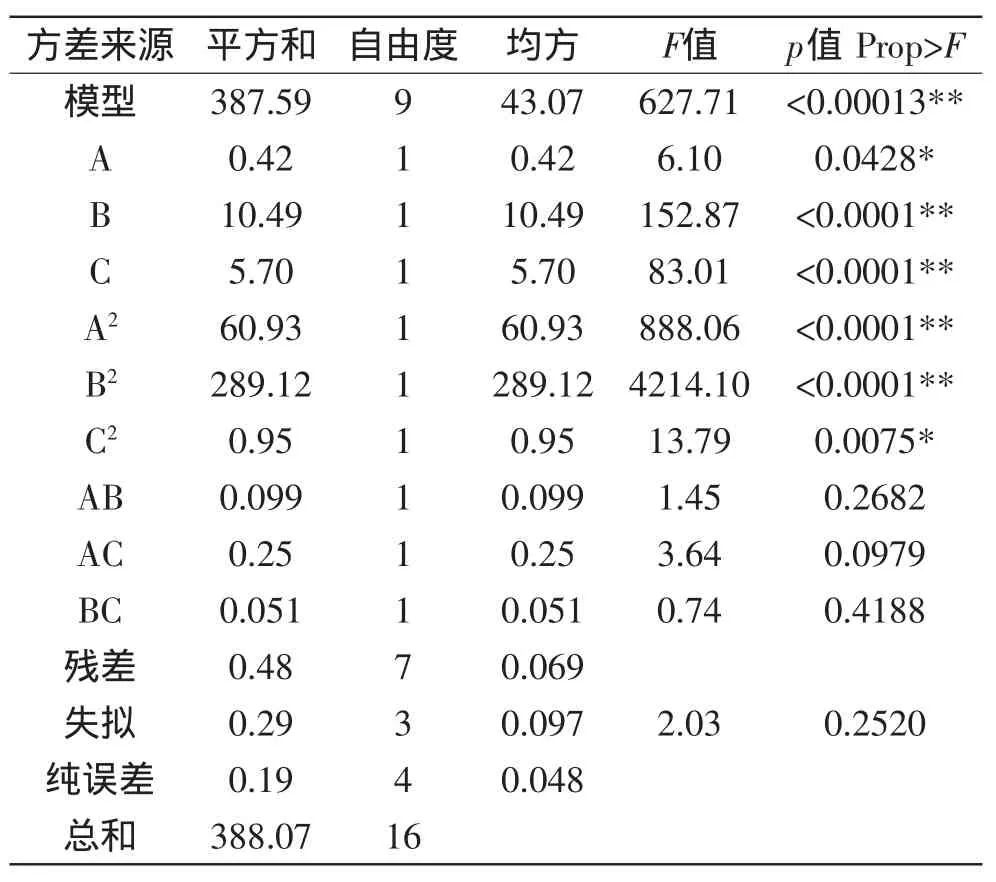
表3 方差分析Table 3 Variance analysis of factors of response surface

图6 转化温度和底物与供体比例对转化率影响的响应面图Fig.6 Response surface graph of conversion temperature and the ratio of polysaccharide to acyl donor to the conversion rate

图7 转化温度和多糖浓度对转化率工艺影响的响应面图Fig.7 Response surface graph of conversion temperature and polysaccharide concentration to the conversion rate
2.3.3.3 验 证 实 验 根 据 上 述 优 化 结 果 ,转 化 温度55℃,底物与供体比例10∶1,多糖浓度0.50mg/mL,转化时间4h的优化工艺条件下,重复实验3次,测得多糖转化率分别为27.29%、27.26%、27.24%,平均值为27.26%。验证结果与响应面实验预测的结果27.27%没有显著性差异,说明预测方程与实际情况拟合很好,充分验证了所建模型的正确性。

图8 多糖浓度和底物与供体比例对转化率影响的响应面图Fig.8 Response surface graph of the ratio of Polysaccharide to acyl donor and polysaccharide concentration to the conversion rate
2.3.4 酰基化木耳多糖的红外光谱 将酰化的产物与未酰化的多糖样品在分辨率为4cm-1的Avatar型红外谱仪上进行红外检测,波数400~4000cm-1,扫描32次。谱图如图9及图10所示。

图9 未酰基化多糖的红外扫描图谱Fig.9 IR analysis of polysaccharide without the derivatization
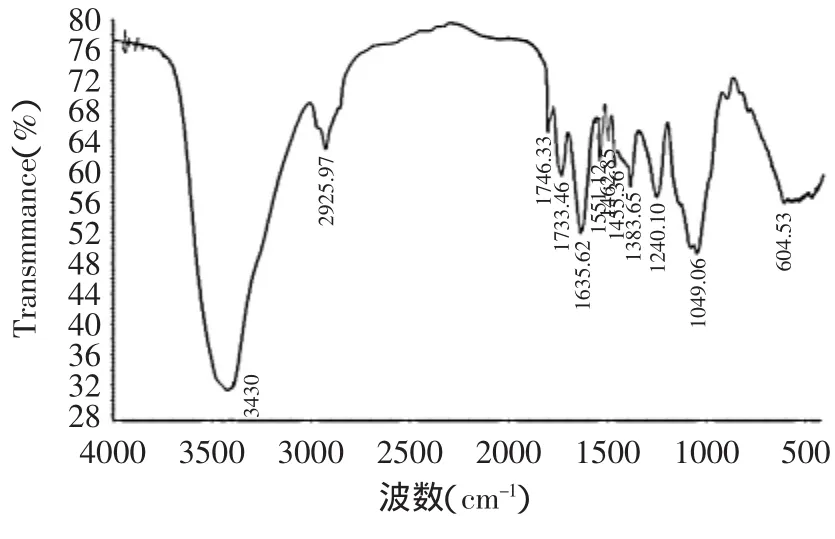
图10 酰基化多糖的红外扫描图谱Fig.10 IR analysis of polysaccharide by the derivatization
图9和图10图谱中均在3400cm-1附近出现强的-O-H键的伸缩振动吸收特征峰,说明多糖链上的羟基未完全被酰基所取代,同时可以看出酰基化多糖在3430.27cm-1处的羟基吸收峰有所降低,表明部分羟基已被酰基化。另外,在2900cm-1附近的峰为多糖单 元 上-CH2-不 对 称 振 动 吸 收 。 图10中1551.12、1462.45、1455.36cm-1可能是芳烃骨架C=C键伸缩振动吸收峰,而图9中未出现,说明未酰化的多糖已经连接上了对羟基苯甲酸,同时在1746.33cm-1处有一吸收峰为多糖酰基化后C=O键的吸收峰,以上充分说明多糖酰基化成功。
2.4 体外抗凝血实验
2.4.1 分级多糖(AAP1、AAP2、AAP3)体外抗凝血功能对比 将多糖配成0.5mg/mL浓度的溶液,按照试剂盒说明书操作,对多糖进行PT、APTT和TT实验,如表4所示。从表4中数据可看出多糖级分AAP1、AAP2、AAP3抗凝血作用逐渐增加,所以选择具有抗凝血作用较好的AAP3作为多糖衍生的原料。
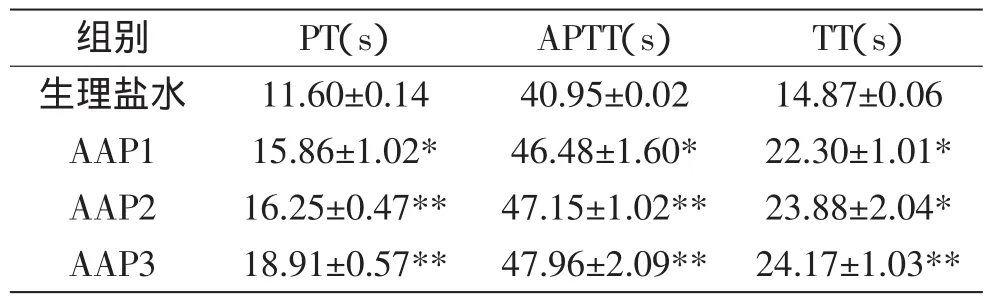
表4 多糖AAP1、AAP2、AAP3对PT、APTT和TT的影响Table 4 Effect of polysaccharide AAP1,AAP2 and AAP3 on PT,APTT and TT
2.4.2 衍生化多糖与未衍生化多糖体外抗凝血功能对比 从表5中的数据可观察到衍生后的多糖对体外抗凝血效果大大增加,可能因为转化后多糖的溶解度增加,粘度减低,从而使多糖活性增强[11]。

表5 转化的多糖(AAP3-I)对PT、APTT和TT的影响Table 5 Effect of conversion polysaccharide on PT,APTT and TT
3 结论
木耳多糖能延长血浆凝固时间,并且经过酰基化修饰后,能明显提高其抗凝血效果,具有被开发成功能食品或者药品的潜在价值。采用具有较好抗凝血作用的级分AAP3加入对羟基苯甲酸制备木耳多糖衍生物,并通过响应面优化实验研究,得到酰基化合成修饰的最优工艺条件为:转化温度55℃,底物与供体比例10∶1,多糖浓度0.50mg/mL。根据最优工艺条件制备得到的木耳多糖酰基化后的多糖衍生物的转化率约为27.26%,符合药理性研究要求,该方法操作简单,反应条件相对简单、产物回收方便,是一种较理想的衍生化方法。
[1]赖萍,林跃鑫.天然多糖分子修饰研究进展[J].生命的化学,2003,23(3):183.
[2]Zhang Hua,Wang Zhen yu.In vitro antioxidant activities of sulfated derivatives of polysaccharides extracted from Auricularia auricular[J].International Journal of Molecular Sciences,2011,12(5):3288-3302.
[3]叶挺梅,钱令波,崔洁,等.黑木耳多糖对抗离体心脏缺血再灌注损伤的研 究[J]. 中 国应 用生理学 杂志,2010,26(2):154-158.
[4]Li Ling,Ding Jun-nan,Luo Li,et al.Preliminary studies on the early quality identification of Auricularia auricular[J].Journal of Forestry Research,2005,16(1):61-64.
[5]陈和生,孙振亚.黑木耳多糖的研究进展[J].时珍国医国药,2003,14(5):300-301.
[6]欧阳天贽,谢九皋.碱溶性黑木耳多糖分离、纯化和表征[J].华中农业大学学报,1999,18(1):46-48.
[7]樊黎生.黑木耳多糖AAP-IIa级分的制备及其生物活性的研究[D].武汉:华中农业大学,2006.
[8]李公斌. 黑木耳多 糖分子修饰 及功能与应用研究[D].哈尔滨:东北林业大学,2006.
[9]宋逍,张丽华,赵鹏,等.响应面法优选款冬花多糖的乙酰化工艺研究[J].中成药,2013,35(9):3030-2033.
[10]李敬,魏玉西,杜桂彩.鼠尾藻多酚的抗凝血活性研究[J].中药新药与临床药理,2007,18(3):191-194.
[11]梁进,张剑韵,崔莹莹.茶多糖的化学修饰及体外抗凝血作用研究[J].茶叶科学,2008,28(3):166-171.
Study on derivatization technology of polysaccharide from Auricularia auricular
ZHANG Zhi1,LIU Dong-min1,+,HU Jun-fei1,WANG Zhen-yu2,*,YU Zhen1
(1.Department of Forestry,Northeast Forestry University,Harbin 150040,China;2.Department of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090,China)
Derivatization technology of polysaccharide from Auricularia auricular was optimized by using Response Surface Methodology,and examining the effect of anticoagulant in vitro after polysaccharide transforming as well.The results showed that selecting p-hydroxybenzoic acid as acyl donor,the best process condition of derivatization of conversion temperature of 55℃,the ratio of polysaccharide to acyl donor of 10∶1,polysaccharide concentration of 0.50mg/mL,that was the most effective condition.The optimal conversion rate was 27.26% under this condition.Conversion polysaccharide could improve the effect of anticoagulant in vitro.
Auricularia auricular polysaccharide;derivatization;response surface methodology;anticoagulant
TS201.1
B
1002-0306(2014)20-0263-06
10.13386/j.issn1002-0306.2014.20.049
2014-01-15 +为并列第一作者
张智(1964-),女,博士,博士生导师,教授,研究方向:天然产物生物转化。刘东敏(1988-),女,在读硕士研究生,研究方向:食品科学。
* 通讯作者:王振宇(1957-),男,博士,教授,研究方向:天然产物分离与功能性食品开发。
