响应面法优化胃蛋白酶制备花椒籽蛋白抗菌肽的研究
2014-03-03姜太玲吴红洋张志清
姜太玲,吴红洋,王 微,张志清
(四川农业大学食品学院,四川雅安 625014)
响应面法优化胃蛋白酶制备花椒籽蛋白抗菌肽的研究
姜太玲,吴红洋,王 微,张志清*
(四川农业大学食品学院,四川雅安 625014)
以花椒籽蛋白为原料,采用胃蛋白酶水解制备抗菌肽。在单因素实验结果的基础上,应用Box-Behnken中心组合 方 法 进 行 四 因 素 三 水 平 的 实 验 设 计 ,以 大 肠 杆 菌(Escherichia coli)抑 菌 率 为 响 应 值 建 立 数 学 模 型 ,确 定 底 物 浓 度4.9%、酶与底物比(g/g)0.9∶100、pH2.0、酶解温度32℃、酶解时间3h为最佳酶解条件。此条件下酶解产生的抗菌肽复合物的抑菌率可以达到60.96%。
花椒籽蛋白,胃蛋白酶,抗菌肽,响应面分析法
花椒籽,学名椒目,是花椒果皮生产中的主要副产物,其蛋白质含量丰富,脱脂后的花椒籽种仁中蛋白质含量可以高达60.34%[1]。从氨基酸组成上看,花椒籽中有17种氨基酸,总量为9.43%,其中必需氨基酸(EAA)占4.03%,种仁粗蛋白中的EAA有谷氨酸、精氨酸、天冬氨酸、赖氨酸及组氨酸[1-2]。经评定,花椒籽蛋白质中的氨基酸得分为58,是一种优质的蛋白质[3]。
抗菌肽(Antibacterial peptide),被认为是最有可能替代抗生素用于治疗疾病的新型抗菌药物,具有物质分子量小、活性稳定、水溶性好,还具有抗菌力强、抗菌谱广、无污染、不易产生耐药性等特点[4-5]。目前对于抗菌肽的研究主要以动物为主,对植物蛋白来源的抗菌肽研究还相对较少。有学者用化学法从中果咖啡、黑种草水稻、稗草、萝卜等植物种子中分离得到了具有抗菌活性的多肽[6-9];周世成、龚吉军、Xiao等[10-12]分别用蛋白酶从小麦蛋白和油茶粕蛋白、麻疯树粕蛋白中分离得到具有抗菌活性的抗菌肽,这些发现为学者们从植物蛋白中获取抗菌肽提供了重要的依据。花椒籽蛋白中含有较多的氨基酸,这给从花椒籽蛋白中分离出具有抗菌活性的多肽提供了可能,这对提高花椒籽的深加工水平,开发出高附加值的产品,对促进经济发展具有重要的作用。
本研究以花椒籽蛋白抗菌肽复合物为研究对象,选取大肠杆菌为实验菌株,旨在通过采用单因素实验、响应面回归分析对酶解条件进行优化,以得到产生抗菌肽的最佳酶解条件,也为分离纯化其中的抗菌肽组分提供了实验依据。
1 材料与方法
1.1 材料与仪器
花椒籽蛋白 经碱处理制得(含量为259.70mg/g);大肠杆菌(ATCC 25922) 四川农业大学食品学院微生物实验室提供;氢氧化钠、琼脂粉、氯化钠 成都科龙化工试剂厂;蛋白胨、牛肉膏 北京奥博星生物科技有限责任公司;胃蛋白酶1∶3000(活力1∶3000~1∶3500) 如吉生物科技有限公司;胰蛋白酶1∶250(活力≥250N.F.U/mg)、中性蛋白酶(活力>60000U/g)、酸性蛋白酶(活力≥50U/mg) 北京华迈科生物技术有限责任公司;碱性蛋白酶(活力≥50U/mg) 上海源叶生物科技有限公司;LB液体培养基 蛋白胨10g、牛肉膏3g、氯化钠5g,蒸馏水1000mL,调pH至7.4,121℃高压蒸汽灭菌15min。
CP225D型电子天平 德国赛多利斯股份公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ型洁净工作台 苏州安泰空气技术有限公司;HZQ-A型恒温振荡培养箱 上海一恒科学仪器有限公司;真空冷冻干燥机 宁波新芝生物科技股份有限公司;Thermo ST16R冷冻离心机 美国赛默飞有限公司。
1.2 实验方法
1.2.1 花椒籽蛋白抗菌肽的制备工艺 制备工艺参考薛培宇等的方法,并作一定的修改[13]。称取适量花椒籽蛋白溶于一定量的去离子水中,在恒温水浴锅中预热,达到反应温度后调节溶液的pH,然后加入一定量的蛋白酶进行反应,在反应过程中不断滴加HCl或NaOH以维持溶液的pH。反应结束后,取出放入90℃水浴灭酶15min,冷却,然后4℃、8000r/min离心10min,取上清液,真空冷冻干燥,冻干粉保存备用。
1.2.2 抑菌活性的测定 称取0.250g冻干粉溶于2mL去离子水中,调节样液的pH至近中性,4℃、12000r/min离心5min,然后用0.22μm的滤膜过滤除菌后进行抑菌实验。
抑菌率的测定参考文献[14]。以大肠杆菌为受试菌,接种于LB液体培养基中,37℃恒温培养24h。取过滤除菌后的样液100μL,加LB培养基30μL和菌悬液70μL(菌悬液浓度为103~104CFU/mL)并混匀,37℃、150r/min摇床孵育1h,取100μL倾注于LB平板,37℃培养过夜,计算菌落数。以去离子水为对照组。计算抑菌率。实验重复3次,结果取平均值。
抑菌率(%)=(对照组菌落数-实验组菌落数)/对照组菌落数×100
1.2.3 单因素实验设计 本研究以花椒籽蛋白对大肠杆菌的抑菌率为对照,考察胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶、酸性蛋白酶这5种酶分别在底物浓度2.5%、酶与底物比1∶100、酶解3h时提取出的酶解产物对大肠杆菌抑菌率大小,从中优选最佳酶进行后续的条件优化,其厂家提供的较优参考酶解条件如表1所示。
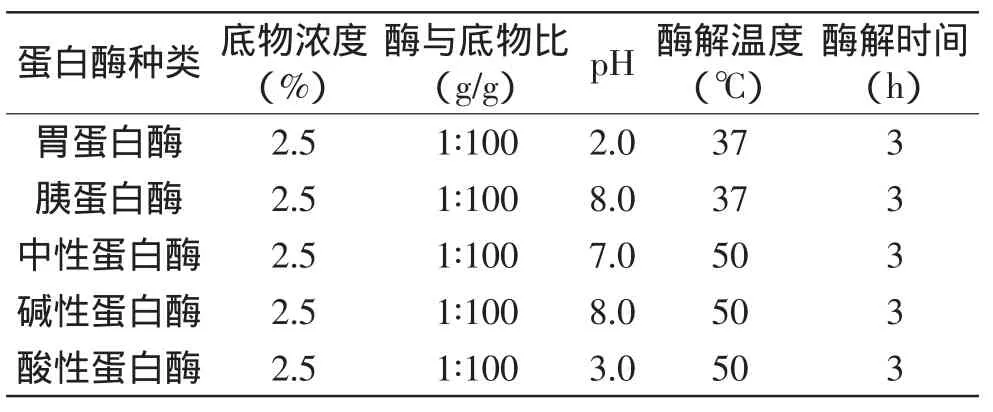
表1 不同蛋白酶的水解条件Table 1 Hydrolysis conditions of 5 proteases
对所选酶的酶解条件,主要考察底物浓度、酶与底物比、pH、酶解温度及酶解时间对花椒籽蛋白酶解液抑菌效果的影响。
1.2.3.1 底物浓度对抑菌活性的影响 底物浓度分别为1%、2%、3%、4%、5%,在酶与底物比1∶100、pH 2.0、酶解温度37℃时,酶解3h时后的产物按照1.2.2的方法测定抑菌活性。
1.2.3.2 酶与底物比对抑菌活性的影响 酶与底物比分别为1∶200、1∶100、3∶200、2∶100、5∶200,在底物浓度4%、pH2.0、酶解温度37℃时,酶解3h时后的产物按照1.2.2的方法测定抑菌活性。
1.2.3.3 pH对抑菌活性的影响 pH分别为1.0、1.5、2.0、2.5、3.0,在底物浓度4%、酶与底物比1∶100、酶解温度37℃时,酶解3h时后的产物按照1.2.2的方法测定抑菌活性。
1.2.3.4 酶解温度对抑菌活性的影响 酶解温度分别为27、32、37、42、47℃,在底物浓度4%、酶与底物比1∶100、pH1.5时,酶解3h时后的产物按照1.2.2的方法测定抑菌活性。
1.2.3.5 酶解时间对抑菌活性的影响 酶解时间分别为2、3、4、5h,在底物浓度4%、酶与底物比1∶100、pH1.5、酶解温度37℃时,产物按照1.2.2的方法测定抑菌活性。
1.2.4 响应面法实验设计 根据单因素实验结果,在酶解时间为3h的条件下,对底物浓度、酶与底物比、酶解pH和酶解温度4个影响酶解产物抑菌活性的主要因素进行优化实验。应用Box-Behnken中心组合进行四因素三水平的实验设计,以抑菌率为响应值,采用Desigh-Expert7.0.0软件进行统计分析。实验因素及水平设计见表2。

表2 响应面分析因素水平表Table 2 Analytical factors and levels for RSM
1.3 数据处理
响应面分析以外的其他数据采用Excel进行显著性分析,p<0.05为差异显著,p<0.01为差异极显著。
2 结果与分析
2.1 蛋白酶的筛选
花椒籽蛋白及5种蛋白酶酶解花椒籽蛋白所得的酶解液对大肠杆菌的抑菌活性见图1。由图1可知,花椒籽蛋白对大肠杆菌的抑菌活性较弱,而5种蛋白酶的酶解产物对大肠杆菌表现出的抑菌活性都较蛋白质高。其中胃蛋白酶酶解产物的抑菌率最高,达到54.35%,不同的蛋白酶酶解时肽段位点具有一定的氨基酸序列特异性,胃蛋白酶倾向于剪切羧基端或氨基端为芳香族氨基酸或亮氨酸的肽键,从而暴露出了具有抑菌活性的小分子肽段。因此,本研究选取胃蛋白酶制备抗菌肽。
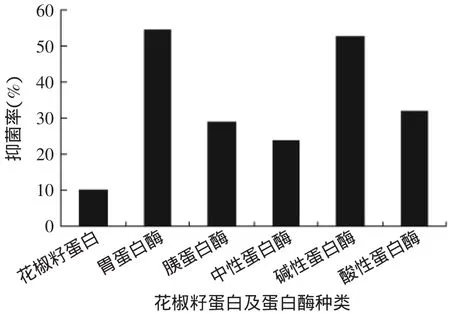
图1 花椒籽蛋白及酶的种类对抑菌活性的影响Fig.1 Effect of prickly ash seed protein enzyme type on antibacterial activity
2.2 胃蛋白酶酶解花椒籽蛋白制备抗菌肽主要影响因素分析
2.2.1 底物浓度对抑菌活性的影响 不同底物浓度对酶解液抑菌效果的影响结果见图2。由图2可知,随着底物浓度的增加,酶解液的抑菌效果也逐渐增加,在底物浓度为4%时酶解液的抑菌效果达到最大,随着底物浓度的升高,抑菌效果出现下降的趋势,底物浓度增大导致酶解不完全,其中的抑菌组分的对应比例下降,导致抑菌效果降低。因此,最佳底物浓度为4%,优化实验底物浓度选择范围为3%~5%。

图2 底物浓度对抑菌活性的影响Fig.2 Effect of substrate concentration on antibacterial activity
2.2.2 酶与底物比对抑菌活性的影响 不同酶与底物比对酶解液抑菌效果的影响结果见图3。由图3可知,随着酶添加量的增加,酶解产物的抑菌活性呈现先增加后降低的趋势。在酶与底物比为1∶100时,酶解液的抑菌效果是最高的。当酶浓度过高时,底物浓度相对较低,酶与底物没有完全结合,当酶用量足够高时,过量的酶会加快多肽水解成更小的分子片段,导致抑菌活性降低。因此,最佳酶与底物比为1∶100,优化实验酶与底物比选择范围为1∶200~3∶200。
2.2.3 pH对抑菌活性的影响 不同pH对酶解液抑菌效果的影响结果见图4。由图4可知,随着pH的增大,花椒籽蛋白酶解液对大肠杆菌的抑制作用呈现先增大后减小的趋势。pH在1.5时,酶解液的抑菌活性达到最大。pH低于或高于1.5都可能对胃蛋白酶的结构造成影响,导致酶的活性降低,从而使酶解液的抑菌活性受到影响。因此,最佳pH为1.5,优化实验pH选择范围用1.0~2.0。
2.2.4 酶解温度对抑菌活性的影响 不同温度对酶解液抑菌效果的影响结果见图5。由图5可知,随着酶解温度的升高,酶解液对大肠杆菌的抑制作用是先增大后减小的,在温度为37℃时酶解液的抑菌效果达到最高。如果反应温度过低,会降低酶与底物的碰撞几率;但温度过高时,就会导致蛋白酶丧失或部分丧失催化活性,不利于酶解反应进行,导致酶解液的抑菌效果下降。因此,最佳酶解温度为37℃,优化实验酶解温度选择范围32~42℃。
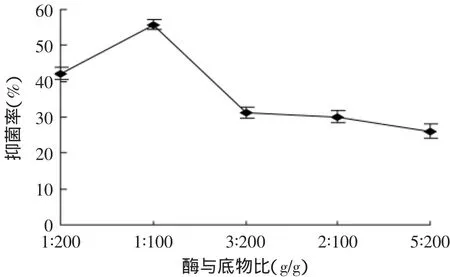
图3 酶与底物比对抑菌活性的影响Fig.3 Effect of enzyme/substrate ratio on antibacterial activity

图4 pH对抑菌活性的影响Fig.4 Effect of pH on antibacterial activity
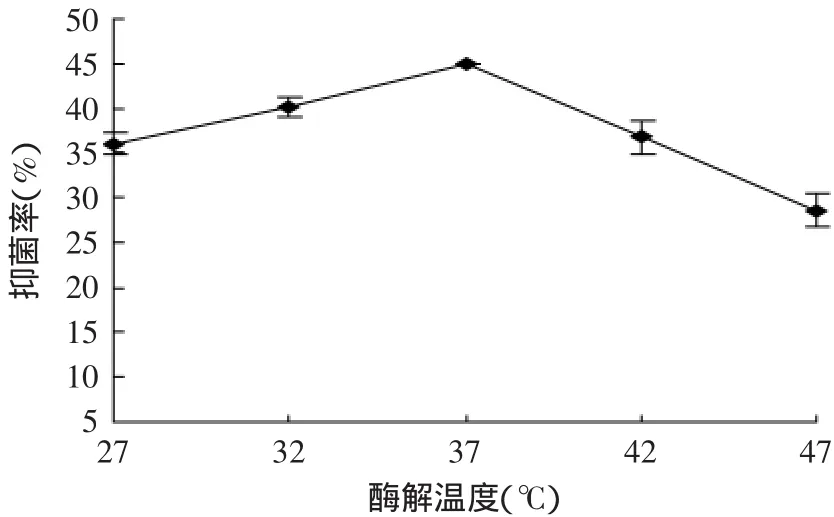
图5 酶解温度对抑菌活性的影响Fig.5 Effect of hydrolysis temperature on antibacterial activity
2.2.5 酶解时间对抑菌活性的影响 不同酶解时间对酶解液抑菌效果的影响结果见图6。由图6可知,花椒籽蛋白酶解液对大肠杆菌的抑菌效果随着酶解时间的延长呈现先增加后减小的趋势,在酶解时间为3h时达到最大。酶解时间太短时,具有抑菌活性的残基不能暴露出来,显示不出抑菌活性,而反应时间延长,则会导致肽的结构受损,趋向于将肽段酶解为小分子的短肽,使抑菌活性会有所降低,但变化不大;同时随酶解时间增加,底物产量增加也会抑制酶解反应的进行。因此,最佳酶解时间为3h,优化实验中的酶解时间定为3h。
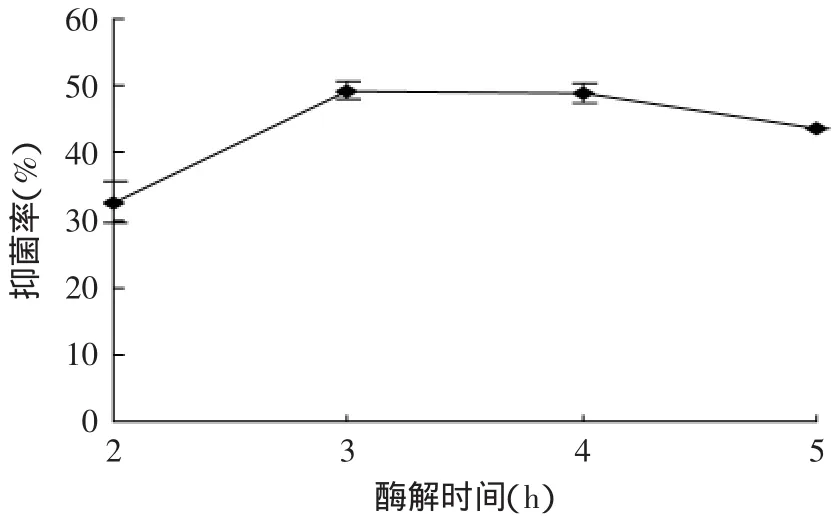
图6 酶解时间对抑菌活性的影响Fig.6 Effect of hydrolysis time on antibacterial activity
通过上述单因素实验结果分析,底物浓度、酶与底物比、pH、酶解温度和酶解时间这5个因素对花椒籽蛋白抗菌肽的抑菌活性影响均显著。单因素实验所确定的胃蛋白酶制备花椒籽蛋白抗菌肽的合适条件为:底物浓度4%,酶与底物比1∶100,pH1.5,酶解温度37℃,酶解时间3h,此实验结果为设定响应面实验因素水平的零点提供参考。
2.3 响应面法优化胃蛋白酶酶解花椒籽蛋白制备抗菌肽
2.3.1 响应面法实验设计及制备的抗菌肽抑菌效果
响应面分析方案及实验结果和方差分析见表3和表4。
由表4可以看出,回归模型是显著的(p<0.0001)。模型的R2=98.72%,表明有98.72%的抑菌率变化可由该模型解释。模型失拟项的p检验值为0.7925(p>0.05),这说明使用该模型可以充分解释响应中的变异,模型的拟合效果良好,实验误差小,因此,该回归模型可以用来对花椒籽蛋白抗菌肽的抑菌活性进行分析和预测。
在该模型中,回归系数显著性检验显示,一次项X1、X2、X3,平方项X12、X22、X42,交互项X1X2、X1X4、X2X3、X2X4的影响均达到极显著水平;平方项X32,交互项X3X4的影响达到显著水平。由方差分析可知,研究范围内的4个因素对花椒籽蛋白抗菌肽的抑菌率大小顺序为:底物浓度>酶与底物比>pH>酶解温度。
综合上述分析结果,剔除模型中不显著的项,得到花椒籽蛋白抗菌肽的抑菌率预测的二次多元回归模型为:


表3 响应面分析实验设计及结果Table 3 Experimental design and results for MSR
2.3.2 因素间的交互作用 用Desigh-Expert软件对4因素间的交互作用进行全面的模型分析,并对交互作用影响显著的两因素绘制响应面曲线图。

图7 底物浓度和酶与底物比对花椒籽蛋白多肽抑制大肠杆菌效果的响应曲面图Fig.7 3-D surface plot for effect of substrate concentration vs. enzyme/substrate ratio on inhibitory rate to E.coli
由图7可见,随着底物浓度和酶与底物比的增加,酶解液的抑菌活性都呈现先增大后降低的趋势。当酶与底物比过大时,较少的底物能与蛋白酶完全结合,随着底物浓度的增大,酶解液的抑菌活性增强;当底物浓度过大时,酶在反应体系中的浓度相对较低,蛋白酶更易解离为单体,常比多聚体更易失活[15],从而使酶解液的抑菌活性降低。
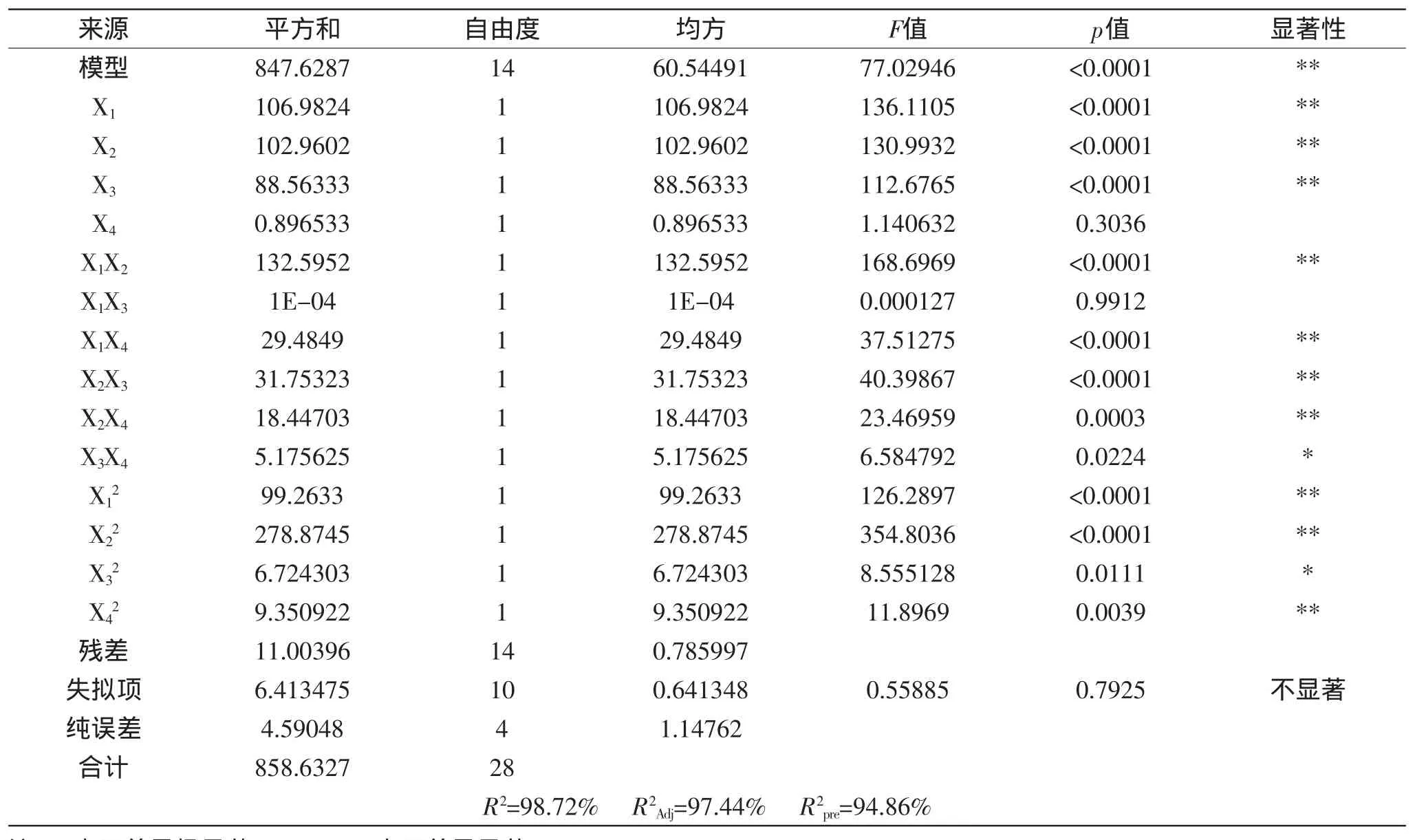
表4 方差分析结果Table 4 Results of analysis of variance
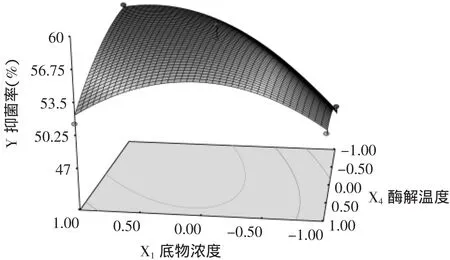
图8 底物浓度和酶解温度对花椒籽蛋白多肽抑制大肠杆菌效果的响应曲面图Fig.8 3-D surface plot for effect of substrate concentration vs. hydrolysis temperature on inhibitory rate to E.coli
由图8可见,当酶解温度一定时,随着底物浓度的增加,酶解液的抑菌活性呈现先增大后减小的趋势。当底物浓度处于低水平时,酶解物的抑菌活性随着温度的升高而增大,后趋于平缓;当底物浓度处于高水平时,酶解物的抑菌活性随着酶解温度的升高而逐渐降低。

图9 酶与底物比和pH值对花椒籽蛋白多肽抑制大肠杆菌效果的响应曲面图Fig.9 3-D surface plot for effect of enzyme/substrate ratio vs. pH value on inhibitory rate to E.coli
由图9可知,无论pH处于何种水平,随着酶与底物比的增大,酶解液的抑菌活性呈现先增大后降低的趋势。在酶与底物比低水平时,酶解液的抑菌活性随pH的变化较小;在酶与底物比高水平时,酶解液的抑菌活性随着pH的增加而逐渐增大。
由图10可见,无论酶解温度处于何种水平,酶解物的抑菌活性随着酶与底物比的增大呈现先增加后降低的趋势。当酶与底物比处于低水平时,酶解物的抑菌活性随着酶解温度的升高呈现缓慢的上升趋势;当酶与底物比处于高水平时,酶解物的抑菌活性随酶解温度的升高而缓慢降低,在0水平值以后,抑菌活性降低速度加快,这可能是温度升高,造成蛋白酶的构象变化,蛋白酶出现部分失活或变性,导致酶解液对大肠杆菌的抑菌活性降低。
由图11可见,无论酶解温度处于何种水平,随着pH的增加,酶解液的抑菌活性明显增加。当pH处于低水平时,酶解液的抑菌活性随着温度的升高呈现先增大后降低的趋势;当pH处于高水平时,随着酶解温度的升高,酶解液的抑菌活性变化不明显,在温度为0水平值左右时,抑菌活性出现明显的下降趋势。2.3.3 拟合优化的验证 通过响应面的数字最优组合分析可得到胃蛋白酶水解花椒籽蛋白的最佳酶解条件为:底物浓度4.91%、酶与底物比0.88∶100、pH2.00、酶解温度32.00℃、酶解时间3h,在此优化条件下,酶解产物对大肠杆菌抑菌率的理论值为61.83%。结合实际条件,最终选择实验条件为底物浓度4.9%、酶与底物比0.9∶100、pH2.0、酶解温度32℃、酶解时间3h,实际测得酶解产物的抑菌率达到60.96%,与理论值61.83%相比,相对误差为1.40%,说明采用响应面法优化胃蛋白酶制备花椒籽蛋白抗菌肽的酶解工艺参数准确可靠,本实验建立的模型在实际应用中是可行的。
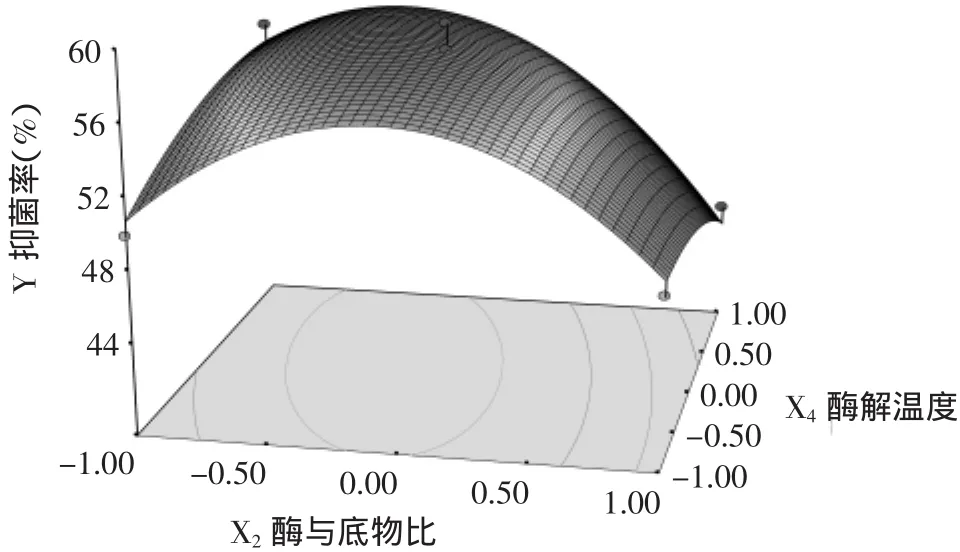
图10 酶与底物比和酶解温度对花椒籽蛋白多肽抑制大肠杆菌效果的响应曲面图Fig.10 3-D surface plot for effect of enzyme/substrate ratio vs. hydrolysis temperature on inhibitory rate to E.coli

图11 pH和酶解温度对花椒籽蛋白多肽抑制大肠杆菌效果的响应曲面图Fig.11 3-D surface plot for effect of pH value vs. hydrolysis temperature on inhibitory rate to E.coli
3 结论
本研究结果以大肠杆菌为指示菌,采用Box-Behnken响应面的设计原理得到了胃蛋白酶制备花椒籽蛋白抗菌肽的最佳工艺条件为:底物浓度4.9%、酶与底物比0.9∶100、pH2.0、酶解温度32℃、酶解时间3h,在此条件下获得的酶解产物对大肠杆菌的抑菌率为60.96%。验证结果表明,该模型准确可靠,具有很好的预测能力。
在本研究中,用胃蛋白酶制备花椒籽蛋白所得抗菌肽复合物对大肠杆菌的抑菌率不是很高,后续工作应对酶解产物进行进一步地分离纯化,在能提高抗菌肽抑菌活性的同时,也为花椒籽蛋白抗菌肽应用到食品、医药等领域提供一定参考。同时胃蛋白酶制备的花椒籽蛋白抗菌肽对大肠杆菌有抑菌活性,但其抑菌机理尚未清楚,还有待进一步研究。
[1]杨令叶.韩城大红袍花椒籽种仁蛋白质分离提取和性能的研究[D]. 西安:陕西师范大学,2008.
[2]姚林杰,叶元土,许凡,等.葡萄籽和花椒籽营养成分分析[J].饲料研究,2011(12):28-29.
[3]寇明钰. 花椒籽蛋白分离提取及功能性质的研究[D]. 重庆:西南大学,2006.
[4]谢咸升,董建臻,李静,等.抗菌肽控制植物病害研究进展及展望[J]. 河北农业大学学报,2011,15(2):46-49.
[5]于文媛,王世峰,谢珍玉,等.合浦珠母贝抗菌肽粗提液制备方法的优化[J].热带生物学报,2011,2(1):14-20.
[6]Umberto Zottich,Maura Da Cunha,André O Carvalho,et al. Purification,biochemical characterization and antifungal activity of a new lipid transfer protein(LTP) from Coffea canephora seeds with α -amylase inhibitor properties[J].Biochimica et Biophysica Acta,2011,1810(4):375-383.
[7]Eugene A Rogozhin, Yulia I Oshchepkova, Tatyiana I Odintsova,et al.Novel antifungal defensins from Nigella sativa L.seeds[J].Plant Physiology and Biochemistry,2011,49(2):131-137.
[8]E A Rogozhin,D Y Ryazantsev,E V Grishin,et al.Defense peptides from barnyard grass(Echinochloa crusgalli L.) seeds[J]. Peptides,2012,38(1):33-40.
[9]Megan Garvey,Sarah Meehan,Sally L Gras,et al.A radish seed antifungal peptide with a high amyloid fibril-forming propensity[J].Biochimica et Biophysica Acta,2013 ,1834(8):1615-1623.
[10]周世成.小麦蛋白抗菌肽的制备及其特性研究[D].郑州:河南工业大学,2011.
[11]龚吉军,李振华,李忠海,等.响应曲面法优化油茶粕抗菌肽制备条件[J]. 中国食品学报,2012,12(9):137-143.
[12]Xiao J H,Zhang H.An escherichia coli cell membrane chromatography-offline LC-TOF-MS method for screening and identifying antimicrobial peptides from Jatropha curcas meal protein isolate hydrolysates[J].Journal of biomolecular screening,2012,17(6):752-760.
[13]薛培宇,代永刚,南喜平,等.响应面法优化酪蛋白抗菌肽的制备工艺[J].食品科技,2011,36(1):5-8.
[14]王战勇,李宁,苏婷婷.中国林蛙皮抗菌肽的提取纯化及抑菌活性检测[J]. 食品科学,2010,31(3):132-135.
[15]曹 健 ,师 俊 玲. 食 品 酶 学[M]. 郑 州 :郑 州 大 学 出 版 社 ,2011:56.
Optimization of antibacterial peptides preparation using pepsin from prickly ash seed protein by response surface methodology
JIANG Tai-ling,WU Hong-yang,WANG Wei,ZHANG Zhi-qing*
(College of Food Science,Sichuan Agricultural University,Ya’an 625014)
Prickly ash seed protein was hydrolyzed by pepsin for antibacterial peptides preparation.Onefactor-at-a-time method and response surface analysis based on Box-Behnken design,using four factors and three levels of response surface methodology to analyzed each factor.The inhibitory rate on Escherichia coli in response to the value of establishing mathematical model and the optimal hydrolysis condition was substrate concentration 4.9% ,enzyme/substrate ratio (g/g ) 0.9 ∶100 ,pH2.0 ,hydrolysis temperature 32℃ and hydrolysis time 3h.Under these conditions , the obtained hydrolysate showed an inhibitory rate as high as 60.96%.
prickly ash seed protein;pepsin;antibacterial peptide;response surface analysis
TS201.2
A
1002-0306(2014)20-0226-06
10.13386/j.issn1002-0306.2014.20.041
2014-02-12
姜太玲(1989-),女,硕士研究生,研究方向:功能性食品。
* 通讯作者:张志清(1976-),男,博士,教授,研究方向:粮油副产物开发利用。
