红松树皮多酚对衰老小鼠抗氧化能力的影响
2014-03-03徐红艳包怡红
王 硕,徐红艳,王 凯,武 军,包怡红,*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.延边大学农学院,吉林延吉 133000)
红松树皮多酚对衰老小鼠抗氧化能力的影响
王 硕1,徐红艳2,王 凯1,武 军1,包怡红1,*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.延边大学农学院,吉林延吉 133000)
研究了红松树皮多酚(Pinus koraiensis bark polyphenols,PKBP)对D-半乳糖衰老小鼠抗氧化能力的影响。采用D-半乳糖建衰老模型,以VE为阳性对照组,PKBP低、中、高剂量组分别灌胃50、100、200mg/(kg·d),同时设模型对照组,灌胃生理盐水。4周后测定血清、肝、脑组织中T-AOC、CAT、T-SOD、GSH-Px、MDA和PC含量,并计算脾和胸腺指数。与正常对照组比较,模型对照组小鼠血清、肝、脑组织T-AOC、CAT、T-SOD、GSH-Px含量显著降低,MDA、PC含量显著升高,脾、胸腺指数显著降低;与模型对照组比较,100、200mg/(kg bw·d)PKBP可显著提高衰老小鼠血清、肝、脑组织中T-AOC、CAT、T-SOD、GSH-Px含量,显著降低MDA及PC含量,提高脾、胸腺指数。PKBP能显著提高亚急性衰老小鼠的抗氧化能力,缓解衰老导致的免疫功能低下,具有量效关系。
红松树皮,D-半乳糖,小鼠,抗氧化
红 松(Pinus koraiensis Sieb.et Zucc.)又 名 海 松 、果松、新罗松等,是我国珍稀用材树。常与红皮云杉等组成混交林,是我国东北长白山至小兴安岭一带林区天然林中主要的森林组成树种,也是目前东北各地分布较广的主要造林绿化树种之一。红松树皮中富含多种生物活性成分,包括酚酸类、黄酮类,生物 碱 、多 糖 等[1],具 有 较 强 的 抗 氧 化[2]、抗 衰 老 、抗 肿瘤、抗疲劳、抗抑郁、抗辐射[3]等多种生物学功能。其中植物活性成分多酚,具有的多元酚结构能与蛋白质、生物碱、多糖结构发生反应,也能与多种金属离子发生络合或静电作用[4]。另外,还具有还原性和捕捉自由基的活性以及具有两亲结构和诸多衍生化反应活性等,这些性质在防病保健等方面所体现的抗氧化、抗肿瘤等生理功效也越来越多的受到人们的关注与认同[5]。本实验以东北红松树皮为原料分离纯化得到红松树皮多酚,研究其对D-半乳糖致衰老小鼠的抗氧化和免疫功能的影响,为小兴安岭地区红松的综合开发应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
红松树皮 黑龙江省伊春地区林业局提供;总抗氧化能力(T-AOC)测定试剂盒、总超氧化物歧化酶(T-SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒、丙二醛(MDA)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、蛋白质羰基(PC)含量检测试剂盒、蛋白定量测定试剂盒 均购买于南京建成生物工程研究所;D-半乳糖 美国Amresco公司;水溶性VE天津市科密欧化学试剂有限公司;冰醋酸、乙酸乙酯、无水乙醇 分析纯;昆明种小鼠 72只,体质量(20±3)g,雌雄各半,购于黑龙江省哈尔滨江北养殖场。
旋转蒸发器 上海亚荣生化仪器厂;722型可见分光光度计 上海光谱仪器有限公司;5804R型离心机 德国Eppendorf公司;DK-8D型电热恒温水槽 上海一恒科技有限公司;G560E型旋涡混合器 美国Scientific industries公司。
1.2 实验方法
1.2.1 红松树皮多酚的制备 红松树皮自然晾干,粉碎过60目筛。准确称取一定量的红松树皮干粉,在超声温度60℃,超声时间80min,超声功率250W条件下提取总多酚,并按前期优化的分离纯化条件进行纯化:采用AB-8树脂、上样浓度2.5mg/mL、上样体积0.53BV、吸附4h、用50%乙醇洗脱、洗脱流速0.2BV/min,纯化液再进行旋蒸浓缩,低温冷冻干燥,获得红松树皮多酚纯化物干粉,纯度为60%,贮存在4℃冰箱待用。
1.2.2 动物分组与喂养 小鼠自由饮食,在实验环境下适应性喂养一周后,随机分为6组,每组12只,雌雄各半,分别为:正常对照组,模型对照组,红松树皮多酚(Pinus koraiensis bark polyphenols,PKBP)低、中、高剂量组,水溶性VE组。除正常对照组外,其余各组均每日颈背部皮下注射D-半乳糖100mg/(kg·d),正常对照组每日颈背部皮下注射等量的生理盐水。同时低、中、高剂量组分别灌胃50、100、200mg/(kg·d)的PKBP;水溶性VE组灌胃VE100mg/(kg·d);正常对照组与模型对照组灌胃等量的生理盐水。连续给药4周。每4d称体重,并调整给药量和灌胃量。
1.2.3 指标测定 实验终日禁食16h后,称体重,眼球取血,分离血清;颈椎脱臼法处死小鼠,立即取肝、脑组织及脾、胸腺并精密称重,肝和脑制成10%组织匀浆液。分别按试剂盒说明书测定血清中T-AOC、TSOD、CAT和MDA含量,肝组织匀浆中T-AOC、T-SOD、CAT、GSH-Px、MDA和PC含量以及脑组织匀浆中TAOC、T-SOD、CAT、GSH-Px、MDA含量并计算脾、胸腺的脏器指数(脏器指数(%)=脏器重量/体重×100)。
2 结果与分析
表1 PKBP对小鼠血清中T-AOC、T-SOD、CAT和MDA含量的影响(±SD,n=6)Table 1 Effect of PKBP on the contents of T-AOC,T-SOD,CAT and MDA in serum of aged mice(±SD,n=6)
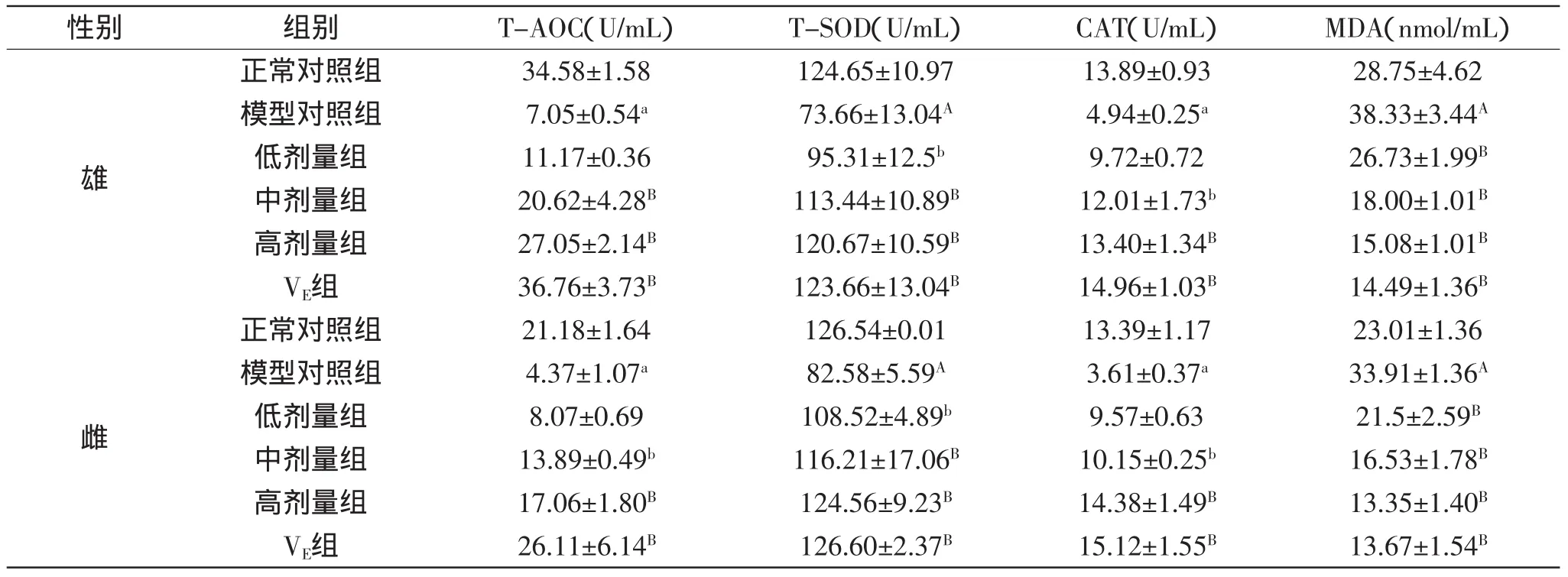
表1 PKBP对小鼠血清中T-AOC、T-SOD、CAT和MDA含量的影响(±SD,n=6)Table 1 Effect of PKBP on the contents of T-AOC,T-SOD,CAT and MDA in serum of aged mice(±SD,n=6)
注:a.与正常对照组相比,差异显著(p<0.05);A.与正常对照组相比,差异极显著(p<0.01);b.与模型对照组相比,差异显著(p< 0.05);B.与模型对照组相比,差异极显著(p<0.01);表2~表4同。
性别 组别 T-AOC(U/mL) T-SOD(U/mL) CAT(U/mL) MDA(nmol/mL)雄正常对照组 34.58±1.58 124.65±10.97 13.89±0.93 28.75±4.62模型对照组 7.05±0.54a 73.66±13.04A 4.94±0.25a 38.33±3.44A低剂量组 11.17±0.36 95.31±12.5b 9.72±0.72 26.73±1.99B中剂量组 20.62±4.28B 113.44±10.89B 12.01±1.73b 18.00±1.01B高剂量组 27.05±2.14B 120.67±10.59B 13.40±1.34B 15.08±1.01BVE组 36.76±3.73B 123.66±13.04B 14.96±1.03B 14.49±1.36B雌正常对照组 21.18±1.64 126.54±0.01 13.39±1.17 23.01±1.36模型对照组 4.37±1.07a 82.58±5.59A 3.61±0.37a 33.91±1.36A低剂量组 8.07±0.69 108.52±4.89b 9.57±0.63 21.5±2.59B中剂量组 13.89±0.49b 116.21±17.06B 10.15±0.25b 16.53±1.78B高剂量组 17.06±1.80B 124.56±9.23B 14.38±1.49B 13.35±1.40BVE组 26.11±6.14B 126.60±2.37B 15.12±1.55B 13.67±1.54B
2.1 PKBP对小鼠血清中总抗氧化能力、抗氧化酶类活性和丙二醛含量的影响
小鼠血清中总抗氧化能力、抗氧化酶类活性和丙二醛含量如表1所示。
由表1可知,由于D-半乳糖的作用,模型对照组与正常对照组相比,雄鼠血清中的T-SOD活性呈极显著降低(p<0.01),T-AOC水平、CAT活性呈显著降低(p<0.05),MDA含量呈极显著升高(p<0.01),结果表明,已成功建立小鼠衰老模型。灌胃PKBP后,血清中T-AOC水平、T-SOD、CAT活性升高,MDA含量降低。与模型对照组相比,高剂量组的T-AOC水平、TSOD、CAT活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01);中剂量组T-AOC水平、T-SOD活性呈极显著升高(p<0.01),CAT活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01);低剂量组的T-SOD活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01)。VE组血清中T-AOC水平、TSOD、CAT活性和MDA含量较模型对照组差异极显著(p<0.01)。
模型对照组与正常对照组相比,雌鼠血清中的T-SOD活性呈极显著降低(p<0.01),T-AOC水平、CAT活性呈显著降低(p<0.05),MDA含量呈极显著升高(p<0.01),结果表明,已成功建立小鼠衰老模型。灌胃PKBP后,血清中T-AOC水平、T-SOD、CAT活性升高,MDA含量降低。与模型对照组相比,高剂量组的T-AOC水平、T-SOD、CAT活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01);中剂量组TSOD活性呈极显著升高(p<0.01),T-AOC水平、CAT活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01);低剂量组的T-SOD活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01)。VE组血清中T-AOC水平、T-SOD、CAT活性和MDA含量较模型对照组差异极显著(p<0.01)。
结果表明,PKBP可有效改善衰老小鼠血清中TAOC水平、T-SOD、CAT活性和MDA含量,提高小鼠的抗氧化能力,同时,高剂量对衰老小鼠机体的抗氧化效果最佳。
2.2 PKBP对小鼠肝脏组织中总抗氧化能力、抗氧化酶类活性、丙二醛含量及蛋白质羰基含量的影响
小鼠肝脏组织中总抗氧化能力、抗氧化酶类活性、丙二醛含量及蛋白质羰基含量如表2所示。
由表2可知,由于D-半乳糖的作用,模型对照组与正常对照组相比,雄鼠肝脏组织中T-SOD、CAT活性呈极显著降低(p<0.01),MDA和PC含量呈极显著升高(p<0.01),T-AOC水平和GSH-Px活性降低,表明衰老小鼠模型建立成功。与模型对照组相比,灌胃PKBP后,高剂量组T-AOC水平、T-SOD、CAT活性呈极显著升高(p<0.01),MDA和PC含量呈极显著降低(p<0.01);中剂量组T-AOC水平、T-SOD、CAT活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01),PC含量呈显著降低(p<0.05);低剂量组CAT活性呈极显著升高(p<0.01),T-AOC水平、T-SOD活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01),PC含量呈显著降低(p<0.05)。VE组与模型对照组比较,T-AOC水平、T-SOD、GSH-Px活性呈极显著升高(p<0.01),MDA和PC含量呈极显著降低(p<0.01)。
模型对照组与正常对照组相比,雌鼠肝脏组织中T-SOD呈显著降低(p<0.05),CAT活性呈极显著降低(p<0.01),MDA和PC含量呈极显著升高(p<0.01),T-AOC水平和GSH-Px活性降低,表明衰老小鼠模型建立成功。与模型对照组相比,灌胃PKBP后,高剂量组T-SOD、CAT、GSH-Px活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01),PC含量呈显著降低(p<0.05);中剂量组CAT活性呈极显著升高(p<0.01),T-SOD、GSH-Px活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01),PC含量呈显著降低(p<0.05);低剂量组CAT活性呈极显著升高(p<0.01)。VE组与模型对照组比较,CAT、GSH-Px活性呈极显著升高(p<0.01),T-AOC水平、T-SOD活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01),PC含量呈显著降低(p<0.05)。
说明PKBP可有效延缓由D-半乳糖致衰老小鼠肝脏组织的脂质氧化,有效清除肝脏组织自由基,增强肝脏组织的抗氧化机能,同时,PKBP高剂量对衰老小鼠肝脏组织的抗氧化效果最佳。
2.3 PKBP对小鼠脑组织中总抗氧化能力、抗氧化酶类活性和丙二醛含量的影响
小鼠脑组织中总抗氧化能力、抗氧化酶类活性和丙二醛含量如表3所示。
表2 PKBP对小鼠肝脏组织中T-AOC、T-SOD、CAT、GSH-Px、MDA和PC含量的影响(±SD,n=6)Table 2 Effect of PKBP on the contents of T-AOC,T-SOD,CAT,GSH-Px,MDA and PC in liver of aged mice(±SD,n=6)
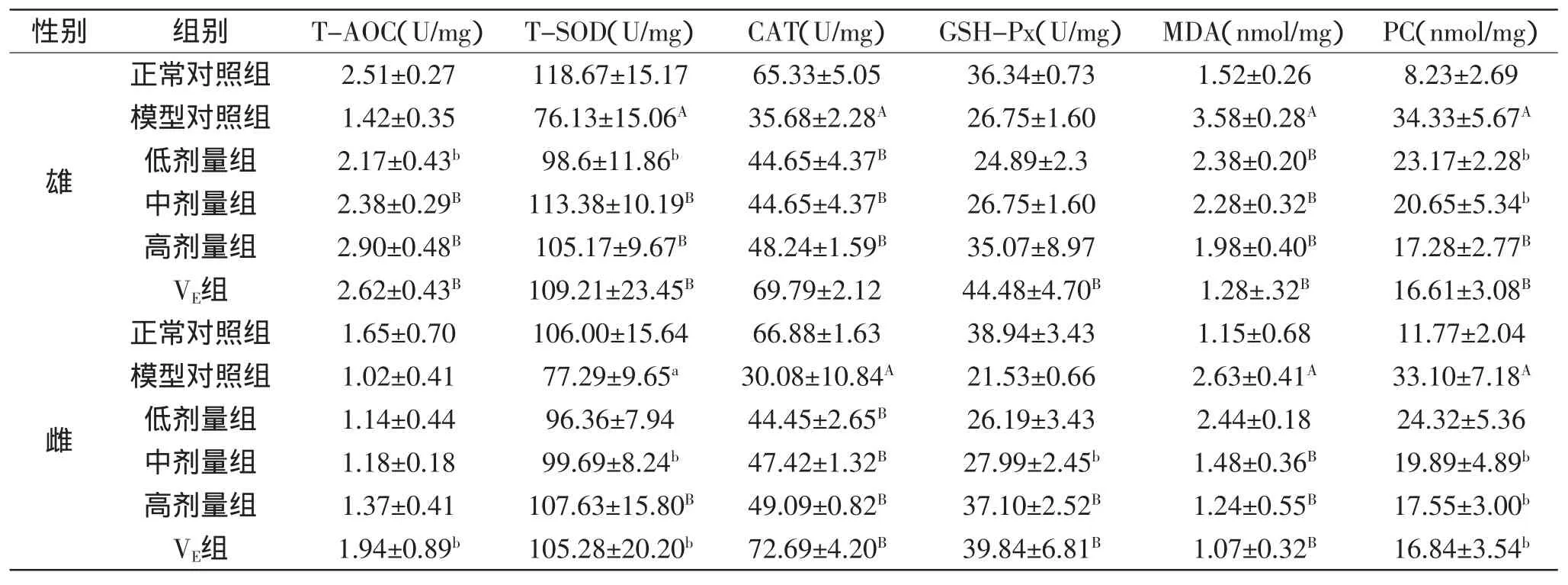
表2 PKBP对小鼠肝脏组织中T-AOC、T-SOD、CAT、GSH-Px、MDA和PC含量的影响(±SD,n=6)Table 2 Effect of PKBP on the contents of T-AOC,T-SOD,CAT,GSH-Px,MDA and PC in liver of aged mice(±SD,n=6)
性别 组别 T-AOC(U/mg) T-SOD(U/mg) CAT(U/mg) GSH-Px(U/mg) MDA(nmol/mg) PC(nmol/mg)雄正常对照组 2.51±0.27 118.67±15.17 65.33±5.05 36.34±0.73 1.52±0.26 8.23±2.69模型对照组 1.42±0.35 76.13±15.06A 35.68±2.28A 26.75±1.60 3.58±0.28A 34.33±5.67A低剂量组 2.17±0.43b 98.6±11.86b 44.65±4.37B 24.89±2.3 2.38±0.20B 23.17±2.28b中剂量组 2.38±0.29B 113.38±10.19B 44.65±4.37B 26.75±1.60 2.28±0.32B 20.65±5.34b高剂量组 2.90±0.48B 105.17±9.67B 48.24±1.59B 35.07±8.97 1.98±0.40B 17.28±2.77BVE组 2.62±0.43B 109.21±23.45B 69.79±2.12 44.48±4.70B 1.28±.32B 16.61±3.08B雌正常对照组 1.65±0.70 106.00±15.64 66.88±1.63 38.94±3.43 1.15±0.68 11.77±2.04模型对照组 1.02±0.41 77.29±9.65a 30.08±10.84A 21.53±0.66 2.63±0.41A 33.10±7.18A低剂量组 1.14±0.44 96.36±7.94 44.45±2.65B 26.19±3.43 2.44±0.18 24.32±5.36中剂量组 1.18±0.18 99.69±8.24b 47.42±1.32B 27.99±2.45b 1.48±0.36B 19.89±4.89b高剂量组 1.37±0.41 107.63±15.80B 49.09±0.82B 37.10±2.52B 1.24±0.55B 17.55±3.00bVE组 1.94±0.89b 105.28±20.20b 72.69±4.20B 39.84±6.81B 1.07±0.32B 16.84±3.54b
由表3可知,由于D-半乳糖的作用,模型对照组与正常对照组相比,雄鼠脑组织中T-AOC水平、T-SOD、CAT、GSH-Px活性呈极显著降低(p<0.01),MDA含量呈极显著升高(p<0.01),表明衰老小鼠模型建立成功。与模型对照组相比,灌胃PKBP后,高剂量组T-AOC水平、CAT、GSH-Px活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01);中剂量组的TAOC水平、GSH-Px活性呈极显著升高(p<0.01),CAT活性呈显著升高(p<0.05),MDA含量呈极显著降低(p<0.01);低剂量组T-AOC水平、GSH-Px活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01)。VE组与模型对照组比较,T-AOC水平、CAT、GSH-Px活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01)。
表3 PKBP对小鼠脑组织中T-AOC、T-SOD、CAT、GSH-Px和MDA含量的影响(±SD,n=6)Table 3 Effect of PKBP on the contents of T-AOC,T-SOD,CAT,GSH-Px and MDA in brain of aged mice(±SD,n=6)
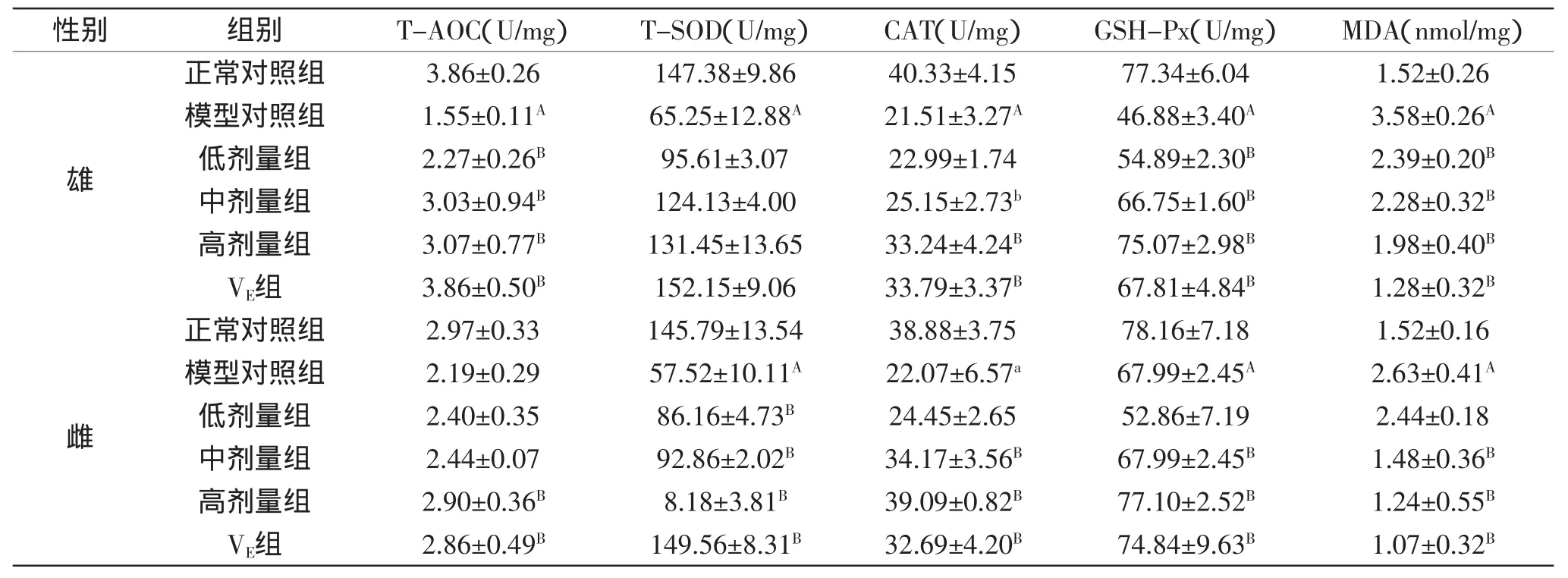
表3 PKBP对小鼠脑组织中T-AOC、T-SOD、CAT、GSH-Px和MDA含量的影响(±SD,n=6)Table 3 Effect of PKBP on the contents of T-AOC,T-SOD,CAT,GSH-Px and MDA in brain of aged mice(±SD,n=6)
性别 组别 T-AOC(U/mg) T-SOD(U/mg) CAT(U/mg) GSH-Px(U/mg) MDA(nmol/mg)雄正常对照组 3.86±0.26 147.38±9.86 40.33±4.15 77.34±6.04 1.52±0.26模型对照组 1.55±0.11A 65.25±12.88A 21.51±3.27A 46.88±3.40A 3.58±0.26A低剂量组 2.27±0.26B 95.61±3.07 22.99±1.74 54.89±2.30B 2.39±0.20B中剂量组 3.03±0.94B 124.13±4.00 25.15±2.73b 66.75±1.60B 2.28±0.32B高剂量组 3.07±0.77B 131.45±13.65 33.24±4.24B 75.07±2.98B 1.98±0.40BVE组 3.86±0.50B 152.15±9.06 33.79±3.37B 67.81±4.84B 1.28±0.32B雌正常对照组 2.97±0.33 145.79±13.54 38.88±3.75 78.16±7.18 1.52±0.16模型对照组 2.19±0.29 57.52±10.11A 22.07±6.57a 67.99±2.45A 2.63±0.41A低剂量组 2.40±0.35 86.16±4.73B 24.45±2.65 52.86±7.19 2.44±0.18中剂量组 2.44±0.07 92.86±2.02B 34.17±3.56B 67.99±2.45B 1.48±0.36B高剂量组 2.90±0.36B 8.18±3.81B 39.09±0.82B 77.10±2.52B 1.24±0.55BVE组 2.86±0.49B 149.56±8.31B 32.69±4.20B 74.84±9.63B 1.07±0.32B
模型对照组与正常对照组相比,雌鼠脑组织中T-SOD、GSH-Px活性呈极显著降低(p<0.01),CAT活性呈显著升高(p<0.05),MDA含量呈极显著升高(p<0.01),表明衰老小鼠模型建立成功。与模型对照组相比,灌胃PKBP后,高剂量组T-AOC水平、T-SOD、CAT、GSH-Px活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01);中剂量组的T-SOD、CAT、GSH-Px活性呈极显著升高(p<0.01),MDA含量呈极显著降低(p<0.01);低剂量组T-SOD活性呈极显著升高(p<0.01)。VE组与模型对照组比较,T-AOC水平、T-SOD、CAT、GSH-Px活性和MDA含量呈极显著差异(p<0.01)。
说明高剂量的PKBP可延缓D-半乳糖衰老小鼠脑组织的脂质氧化,清除脑组织自由基,增强脑组织的抗氧化能力,并且高剂量PKBP对衰老小鼠脑组织的抗氧化效果最佳。
2.4 PKBP对小鼠脾、胸腺指数的影响
小鼠脾、胸腺指数如表4所示。由表4可知,由于D-半乳糖的作用,模型对照组与正常对照组相比,雄鼠胸腺指数显著降低(p<0.05),脾指数极显著降低(p<0.01);灌胃PKBP后,脾、胸腺指数升高。与模型对照组相比,高剂量组的脾指数显著升高(p<0.05),VE组脾指数极显著升高(p<0.01)。模型对照组与正常对照组相比,雌鼠脾、胸腺指数极显著降低(p<0.01);灌胃PKBP后,脾、胸腺指数升高。与模型对照组相比,VE组脾指数极显著升高(p<0.01),胸腺指数显著升高(p<0.05)。
结果说明,对小鼠进行D-半乳糖长期作用,可导致小鼠机体发生亚急性的衰老变化,模型对照组与正常对照组相比,主要的生理差异是脾、胸腺指数降低,而通过灌胃PKBP可以抑制D-半乳糖引起的脾、胸腺指数降低现象,说明PKBP具有提高免疫功能的作用[6-7]。
表4 PKBP对小鼠脾、胸腺指数的影响(±SD,n=6)Table 4 Effect of PKBP on the index of spleen and thymus in aged mice(±SD,n=6)

表4 PKBP对小鼠脾、胸腺指数的影响(±SD,n=6)Table 4 Effect of PKBP on the index of spleen and thymus in aged mice(±SD,n=6)
性别 组别 脾指数(mg/g) 胸腺指数(mg/g)雄正常对照组 6.67±2.51 4.39±0.71模型对照组 3.00±0.41A 2.82±1.21a低剂量组 4.40±2.34 3.17±0.37中剂量组 5.60±2.28 3.58±1.00高剂量组 5.77±2.03b 3.66±0.99 VE组 6.42±0.99B 3.78±0.73雌正常对照组 9.19±0.58 2.66±0.42模型对照组 5.62±1.86A 1.77±0.21A低剂量组 5.99±0.97 1.80±0.67中剂量组 6.54±0.85 2.12±0.25高剂量组 7.67±1.42 2.33±0.19 VE组 8.86±1.93B 2.64±0.69b
3 结论与讨论
衰老是与自由基、氧化密切相关的生理现象。机体内活性氧自由基的高度活化,能够破坏脂类、蛋白、酶类、DNA以及RNA等生物分子,所以当这些活性氧自由基过量产生而又不能被及时清除时,就会对机体造成极大的损害,引发机体生理性(衰老)甚至病理性(肿瘤、炎症、动脉粥样硬化)的改变[8-10]。
大量研究表明,注射D-半乳糖是常用的亚急性衰老模型造模法,具有耗时少、易成模、重复性好的优点,已被广泛应用和研究[11-12]。注射D-半乳糖后,机体内抗氧化酶类活性降低,MDA含量升高[13-14],脾、胸腺指数降低[15-16]。本实验中,小鼠注射D-半乳糖后,与正常对照组相比,T-AOC水平和抗氧化酶类活性显著降低,MDA和PC含量显著升高及脾、胸腺指数降低,表明D-半乳糖衰老模型造模成功。
T-AOC用于总体评价机体的抗氧化能力,抗氧化酶系可清除O2-·等自由基,防御机体过氧化,其活性可较全面反映机体的抗氧化能力,而MDA是一种脂质过氧化物,可反映机体内的脂质过氧化程度,其含 量 反 映 了 机 体 细 胞 受 自 由 基 攻 击 的 严 重 程 度[17]。蛋白质的羰基化被广泛用于评价各种生物有机体的氧化程度[18],PC含量是蛋白质氧化损伤的敏感指标,在一些年老或与年老相关疾病的动物组织中其含量升高[19]。研究表明,植物来源的多酚类物质可改善机体受自由基攻击而发生的氧化程度,使机体内抗氧化酶类活性得到提高,MDA含量明显下降,通过直接清除过量的自由基以及抑制脂质过氧化而发挥抗氧化作用[7,20]。
本研究中,小鼠灌胃PKBP后,与模型对照组相比,高剂量可显著提高血清中T-AOC水平、T-SOD、CAT活性,显著降低MDA含量;在肝脏中,中、高剂量可提高机体抗氧化能力,T-AOC水平、T-SOD、CAT和GSH-Px活性显著提高,MDA、PC含量显著下降;在脑组织中,中、高剂量可提高机体抗氧化能力,TAOC水平、T-SOD、CAT和GSH-Px活性显著提高,MDA含量显著下降。而低剂量组也具有一定的提高血清中的T-SOD活性,肝中的CAT活性、雄鼠T-AOC水平和T-SOD活性,脑组织中的雄鼠T-AOC水平、GSH-Px活性及雌鼠T-SOD活性;降低血清中的MDA含量,肝中的雄鼠MDA、PC含量,脑组织中的雄鼠MDA含量。结果表明,PKBP在显著提高机体抗氧化酶类活性的同时,对机体脂质过氧化终产物的产生具有显著抑制作用,并能显著降低蛋白质的氧化损伤,本研究与多酚等抗氧化剂可提高机体抗氧化水平的论断相一致[20]。
本研究表明,红松树皮多酚可显著提高衰老小鼠机体T-AOC水平,抗氧化酶T-SOD、CAT和GSH-Px的活性,显著降低MDA和PC含量,有效清除机体内产生的过量自由基,同时还有效抑制由D-半乳糖引起的脾、胸腺指数降低现象发生,具有明显抗氧化和增强免疫功能的作用,作用与VE相当。
[1]王吉昌,王振宇,文攀,等.半制备液相-高效液相色谱技术测定红松树皮中多酚物质的研究[J]. 食品工业科技,2012,33(2):73-76.
[2]苏晓雨,王振宇.红松种子壳多酚物质的提取及抗氧化特性[J]. 农业工程学报,2009,25(S1):198-203.
[3]苏晓雨.红松种壳组成及多酚提取分离与抗氧化抗肿瘤功能研究[D]. 哈尔滨:哈尔滨工业大学,2010.
[4]宋立江,狄莹,石碧.植物多酚研究与利用的意义及发展趋势[J]. 化学进展,2000,12(2):161-170.
[5]刘运荣,胡健华. 植物多酚的研究进展[J]. 武汉工业学院学报,2005,24(4):63-66.
[6]李培兵,金宏,仲济学,等.网纹甜瓜瓜汁对D-半乳糖衰老小鼠免疫功能的影响[J]. 营养学报,2010,32(2):153-156.
[7]吴正平.金花葵花总黄酮对衰老模型小鼠抗氧化和免疫功能的影响[J]. 中国老年学杂志,2011,31(5):1800-1802.
[8]Gibson S Nyanhongo,Christoph Sygmund,et al.An antioxidant regenerating system for continuous quenching of free radicals in chronic wounds[J].European Journal of Pharmaceutics and Biopharmaceutics,2013,83(3):396-404.
[9]Vijayakumar Mayakrishnan ,Selvi Veluswamy,et al.Free radical scavenging potential of Lagenaria siceraria(Molina)Standl fruits extract[J].Asian Pacific Journal of Tropical Medicine,2013,6(1):20-26.
[10]Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidantsin normalphysiologicalfunctionsand human disease[J].Int J Biochem Cell Biol,2007,39(1):44-84.
[11]雷鸣,朱祖建.D-半乳糖致衰老的研究进展[J]. 解剖科学展.2011,17(1):83-85.
[12]梁华,孙燕佩,朱明雪,等.D-半乳糖所致衰老模型鼠的免疫功能变化[J]. 中国临床保健杂志,2012,15(3):322-323.
[13]雷霞,迟瑛娇,赵冬梅,等.降心丹对衰老模型小鼠抗氧化作用的实验研究[J]. 中医药信息,2011,28(4):74-75.
[14]林春榕,左绍远,熊伟,等.地参多糖对D-半乳糖所致衰老小鼠的抗氧化作用研究.安徽农业科学[J].2012,40(18):9646-9647.
[15]王雪侠,张向前.巴戟天醇提物对D-半乳糖衰老大鼠免疫功能的影响[J]. 中国医药导报,2013,10(4):17-19.
[16]雷红,孙汉巨,姜绍通.菜籽饼粕多糖对D-半乳糖衰老小鼠的抗氧化及免疫调节的作用[J]. 食品科学,2010,31(13):283-286.
[17]Mulabagal V,Lang G A,De Witt D L,et al.Anthocyan in content lipid peroxidation and cyclooxygenase enzyme inhibitory activities of sweet and sour cherries[J].Agric Food Chem,2009,57(4):1239-1246.
[18]Cederberg J,Basu S,Eriksson U J.Increased rate of lipid peroxidation and protein carbonylation in experimental diabetic pregnancy[J].Diabetologia,2001,44:766-774.
[19]Kasprzak K S.Oxidative DNA and protein damage in metal-induced toxicity and carcinogenesis[J].Free Radical Bio Med,2002,32:958-967.
[20]曹志超,顾翔,苏佩清.黄酮类化合物抗氧化及其作用机制的研究进展[J]. 实用临床医药杂志,2009,13(7):110-112.
Effect of Pinus koraiensis bark polyphenols on antioxidant abilities in aging mice
WANG Shuo1,XU Hong-yan2,WANG Kai1,WU Jun1,BAO Yi-hong1,*
(1.Forestry College,Northeast Forestry University,Harbin 150040,China;2.College of Agricultural,Yanbian University,Yanji 133000,China)
To investigate the influence of Pinus koraiensis bark polyphenols(PKBP) on antioxidant abilities in aged mice,a subacute aging mice model was built by neck back subcutaneous injection of D-galactose for 4 consecutive weeks.Using VEas positive control,PKBP was given to mice by gavage at three different doses of 50,100mg/(kg·d) and 200mg/(kg·d).The model control groups were given normal saline by gavage during that time.Total antioxidant capacity (T-AOC),catalase (CAT) ,total superoxide dismutase (T-SOD),glutathione peroxidase (GSH-Px) ,malondialdehyde (MDA) and protein carbonyl(PC) in the serum,liver and brain of mice were determined at the end of the last administration.The results showed that the content of T-AOC,T-SOD,CAT and GSH-Px in the aged model group significantly declined (p<0.05 ) ,but the content of PC and MDA significantly increased,spleen and thymus index significantly decreased as compared to the normal control group(p<0.05).For the aged mice treated with 100 and 200mg/(kg·d) of PKBP,the activities of T-SOD,CAT,GSH-Px and the content of T-AOC significantly increased (p<0.05) ,the content of MDA and PC significantly declined (p<0.05 ) , and spleen and thymus index increased as compared to aged control mice.These data indicated that PKBP could significantly improve the antioxidant capacity of subacute aging mice ,and ease descent of immune function caused by aging with dose-effect relationship.
Pinus koraiensis bark polyphenols;D-galactose;mice;antioxidant
TS201.1
A
1002-0306(2014)20-0142-05
10.13386/j.issn1002-0306.2014.20.022
2013-05-27
王硕(1989-),女,在读硕士研究生,研究方向:植物活性成分的分离与开发。
* 通讯作者:包怡红(1970-),女,博士,研究方向:食品生物技术与功能性食品研究。
国家自然科学基金(31170510)。
