一种天然材料复合体系固定化酒用双功能酶的研究
2014-03-01查小红杨广明田亚平江南大学工业生物技术教育部重点实验室江苏无锡214122
查小红,杨广明,田亚平(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
一种天然材料复合体系固定化酒用双功能酶的研究
查小红,杨广明,田亚平*
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
运用吸附包埋交联的复合方法固定化普罗威登斯菌Providencia sp.JNB815所产的具有降解尿素和氨基甲酸乙酯活性的双功能酶。以尿素降解酶活性为指标,单因素优化固定化条件为:壳聚糖和明胶浓度分别为4.0%、2.0%,京尼平浓度0.4%,30℃恒温水浴振荡6h进行交联,交联后的微球固定化酶的时间为8h。固定化酶催化氨基甲酸乙酯(EC)和尿素反应时,最适pH分别为4.5和4.0,最适温度分别为60、40℃。固定化EC降解酶酶活在温度20~60℃,pH5.0~6.5之间相对稳定;固定化脲酶酶活在温度20~50℃,pH4.0~6.5之间相对稳定。固定化酶重复使用10次后,对尿素和EC的酶活残留率分别为80%和30%。在32℃,摇床转速100r/min的条件下,固定化尿素降解酶加酶量为0.04U/mL黄酒时,固定化酶处理黄酒20h后,尿素去除率可达93.03%;同样条件下,黄酒中固定化EC降解酶加酶量为0.17U/mL时,处理黄酒20h后,EC去除率可达56.60%。GC-MS结果显示固定化酶处理后的黄酒风味物质变化不大。
固定化,双功能酶,黄酒,氨基甲酸乙酯
氨基甲酸乙酯(EC),是2A类致癌性的物质,微量存在于大部分发酵食品和酒精饮料中[1-2]。研究发现黄酒中90%氨基甲酸乙酯主要由尿素和乙醇经化学反应生成的[3],因此利用脲酶将饮料酒中的尿素及时除去对于控制酒中氨基甲酸乙酯的生成具有重要意义。采用酒用酸性脲酶处理煎酒前的黄酒,可除去黄酒中大部分尿素,减少生成EC的可能性[4-5],而EC降解酶则能直接有效的分解成品黄酒中已经产生的EC[6-7]。
已有研究报道肠杆菌Enterobacter sp.R-SYB082能产生一种酸性脲酶具有双重作用,可实现同时去除黄酒中底物尿素及产物EC[8]。本实验室筛选出一株Providencia sp.JNB815,这株菌所产酶也具有同时降解尿素和EC的活性。粗酶液经过纯化后,初步证实降解EC和尿素活性的酶为同一种双功能酶。将这一种双功能酶进行固定化,可应用在黄酒中同时去除尿素和EC,且可以分离回收再利用。壳聚糖作为固定化载体具有蛋白质亲和性高;分子中反应基团多,可被用来进行化学改性;生物相容性好,安全无毒,廉价易得等优点[9]。京尼平替代传统的交联剂戊二醛,由于它是从栀子苷中提取,具有天然无毒的特点,是一种良好的明胶壳聚糖交联剂[10-12]。本文以壳聚糖明胶为载体,京尼平为交联剂,用吸附-包埋-交联的复合固定化方法对该酶进行固定化研究,并分别考察两种底物条件下固定化双功能酶的特性表征。在此基础上,考察了固定化酶的不同应用形式在黄酒中的应用效果。
1 材料与方法
1.1 材料与仪器
Providenciasp.JNB815 本实验室筛选,并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:CGMCC No.8326;壳聚糖 山东奥康生物科技有限公司;京尼平 江西抚川临川之信生物科技有限公司;二乙酰一肟、硫代氨基脲、明胶 上海化学试剂厂;其他试剂 均为国产分析纯。
722E型可见分光光度计 上海光谱仪器有限公司;HH-系列数显恒温水浴锅、85-2A型数显测速恒温磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;电子天平 上海菁海仪器有限公司;超声波细胞破碎机 宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 游离双功能酶的提取 将菌种从甘油管接种至种子培养基中,37℃、200r/min振荡培养10h,再按2%的接种量接入发酵培养基中,37℃、200r/min振荡培养24h。发酵液经8000r/min离心5min,收集菌体,经柠檬酸缓冲液洗涤数次后,离心获得全细胞。用柠檬酸缓冲液稀释细胞至原发酵液体积的1/10,搅匀,并进行超声波破碎,条件为300W、15min(破碎时间3s、间隔时间3s),破碎液在4℃,10000r/min离心15min,收集上清液,即为粗酶液。
1.2.2 固定化双功能酶的制备 称取一定质量的壳聚糖和明胶溶于100mL 1%的乙酸中,磁力搅拌使其充分溶解。用注射器将壳聚糖明胶溶液滴入凝结液中(20%的NaOH溶液和无水乙醇,体积比4∶1),制成微球,凝结一段时间后用去离子水洗至中性,并与一定浓度的京尼平溶液交联。洗涤除去微球表面的交联剂后,按一定比例向载体中加入双功能酶溶液,冰箱中静置一段时间进行固定。最后,洗涤微球至表面无游离酶为止。沥干,4℃冷藏备用。
1.2.3 游离酶酶活测定 采用靛酚蓝反应比色法[13]。
酶活力定义:在常压,37℃,pH4.5条件下,每分钟分解尿素或氨基甲酸乙酯产生1滋mol氨为一个酶活力单位。尿素降解酶和EC降解酶活力的测定分别采用尿素和EC为底物。
1.2.4 固定化酶酶活测定 取一定质量的壳聚糖微球加入一定体积柠檬酸缓冲液配制的尿素或氨基甲酸乙酯溶液中,在恒温水浴箱中保温20min后,过滤取其滤液,以下操作与游离酶活力测定相同,固定化酶活力定义同游离酶。
1.2.5 固定化率的测定 即酶活回收率,EC酶固定化率(%)=固定化EC酶总酶活/固定化时所加游离EC酶总酶活×100,脲酶固定化率(%)=固定化脲酶总酶活/固定化时所加游离脲酶总酶活×100。
1.2.6 固定化酶的条件优化
1.2.6.1 壳聚糖和明胶质量浓度的确定 将壳聚糖和一定质量明胶溶入1%乙酸溶液中,形成1%、2%、3%、4%和5%的壳聚糖溶液,再将混合溶液滴入凝结液中制备壳聚糖微球,测定不同壳聚糖浓度下所得的固定化酶活。明胶浓度的确定方法同上。
1.2.6.2 交联剂浓度和固定化时间的确定 壳聚糖明胶载体分别用0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%、1.6%、1.8%、2.0%的京尼平交联,确定固定化尿素降解酶酶活最高时的交联剂浓度。交联后的载体与酶固定时,固定化时间为2、4、6、8、10h,确定酶活最高时的固定化时间。
1.2.6.3 加酶量的确定 固定化酶的加酶量分别为0.5、1.0、1.5、2.0、2.5、3.0mL/g载体,确定酶活最高时的加酶量。
1.2.7 固定化酶的性质
1.2.7.1 最适温度和温度稳定性 最适温度:在20、30、40、50、60、70℃的条件下,分别测定固定化酶和游离酶活力,以两者的最高酶活力为100%,计算相对酶活力;温度稳定性:在20~80℃范围内,固定化酶和游离酶每隔10℃分别保温1h后,用pH4.5柠檬酸缓冲液清洗干净,冰浴,在37℃条件下测定酶活,以同组实验中最高的酶活力为100%,计算相对酶活力。
1.2.7.2 最适pH和pH稳定性 最适pH:用50mmol/L的柠檬酸和柠檬酸三钠,配制成pH3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的柠檬酸缓冲液;用50mmol/L磷酸氢二钠和磷酸二氢钠,配制成pH6.0、6.5、7.0、7.5、8.0的PBS缓冲液。用上述各种缓冲液分别配制成EC和尿素的底物溶液,37℃条件下测定酶活,以最高酶活力为100%,计算相对酶活力;pH稳定性:将游离酶和固定化酶置于上述不同pH的各种缓冲液中,37℃下放置1h后,取样将pH调至最适反应pH,37℃条件下测定以EC和尿素为底物的酶活,以最高酶活力为100%,计算相对酶活力。
1.2.7.3 重复使用性 固定化酶测定一次酶活后,用pH4.5的柠檬酸缓冲溶液清洗干净,再次测定酶活,重复测定15次。
1.2.7.4 动力学特征参数 在游离酶和固定化酶的最佳酶活测定条件下,测定尿素浓度为10、20、30、40、50、60mmol/L时游离酶和固定化酶的酶活。并测定EC浓度为80、100、120、160、200、240mmol/L时游离酶和固定化酶的酶活。按照Lineweaver-Burk作图法取双倒数分别作两种底物条件下的1/v-1/s曲线,计算游离酶和固定化酶的米氏常数Km和最大反应速率Vm。
1.2.8 尿素去除率测定方法 采用二乙酰一肟法[14]。
1.2.9 氨基甲酸乙酯去除率的测定 吸取酒样8mL置于20mL的顶空瓶中,逐渐加入氯化钠至饱和,旋紧瓶盖,插入萃取头,在70℃下,250r/min恒温搅拌萃取45min。样品萃取及进样由德国Gerstel多功能进样系统自动完成。上述顶空固相微萃取技术富集黄酒中的EC,再用气相色谱-质谱联用进行定性定量分析[15-16]。
1.2.10 黄酒中风味物质的测定 采用顶空-固相微萃取-气质联用技术[17]
2 结果与讨论
2.1 固定化酶的制备条件
2.1.1 壳聚糖和明胶质量浓度对固定化尿素降解酶活性的影响 图1结果表明,壳聚糖浓度为4%时,固定化酶活达到最大值。过大的壳聚糖浓度,使得微胶囊表面的聚电解质膜更加致密,造成底物扩散困难,固定化酶活反而降低[18]。
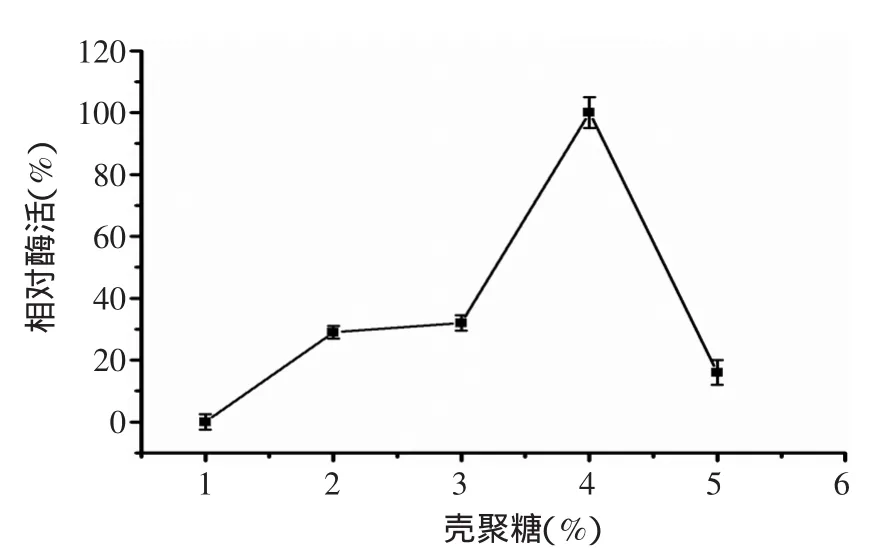
图1 壳聚糖浓度对固定化尿素降解酶活性的影响Fig.1 The effect of chitosan concentration on immobilized acid urease activity

表1 明胶浓度对固定化酸性脲酶酶活的影响Table 1 The effect of gelatin concentration on immobilized acid urease activity
明胶在壳聚糖微球中的作用主要是增大微球的韧性与硬度,由表1可知,随着明胶浓度的提高,虽然微球强度有所提高,但是固定化酶酶活却相应降低。可能是由于明胶浓度增大时,颗粒机械强度变大、孔径减小、不利于载体与酶充分接触[19],从而降低了固定化酶的活力。综合这两种因素,选取明胶浓度为2%。
2.1.2 交联剂浓度和固定化时间对固定化尿素降解酶活性的影响 选择京尼平(细胞毒性为常用交联剂戊二醛的1/10000[20-21])交联壳聚糖和明胶。图2结果表明,京尼平交联的最适浓度为0.4%,当京尼平浓度从0%增加到0.4%时,固定化酶的酶活显著提高;但是,继续提高其浓度时,酶活呈现降低趋势。
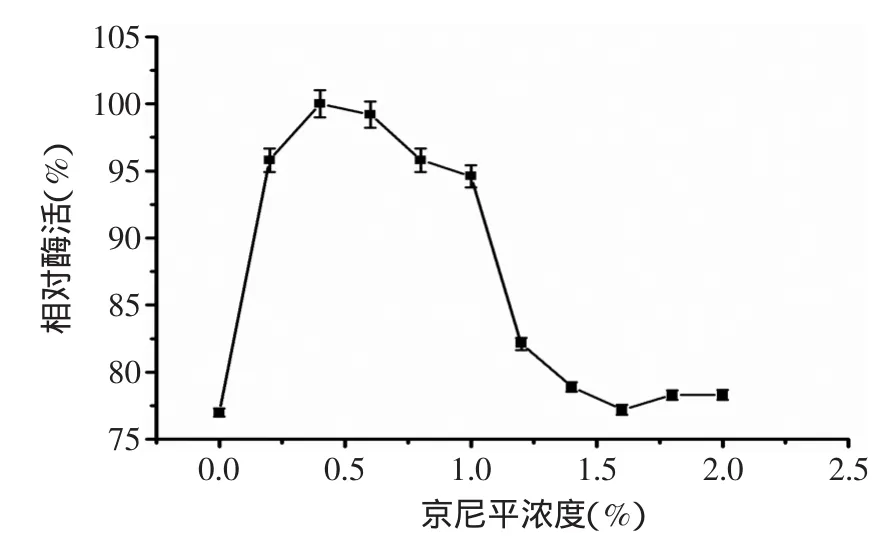
图2 京尼平浓度对固定化尿素降解酶活性的影响Fig.2 The effect of genipin concentration on immobilized acid urease activity
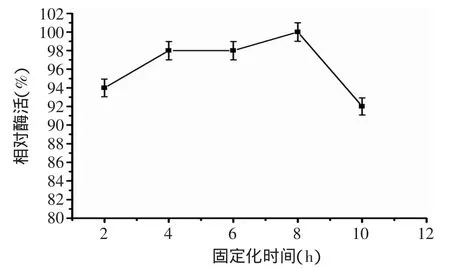
图3 固定化时间对固定化尿素降解酶活性的影响Fig.3 The effect of immobilization time on immobilized acid urease activity

表2 加酶量对固定化尿素降解酶活性和回收率的影响Table 2 The effect of enzyme concentration on immobilized enzyme activity and activity recovery
由图3可知,随着固定化时间的延长,所吸附的脲酶量有所提高。固定化时间为8h时,固定化酶活达到最高值,继续延长时间,固定化酶活力开始下降。可能是因为延长固定化时间有利于酶分子与壳聚糖微球充分接触,从而与微球上的活性基团发生共价偶联,而当微球吸附酶量逐渐增大,微球网格上的酶分子之间较为拥挤,载体孔径相应变细,底物不易与酶充分接触,酶整体的活力有所下降。
2.1.3 加酶量对固定化尿素降解酶活性和回收率的影响 由表2可知,固定化酶的酶活随着加酶量的增大而提高,载体中加酶量为2.5mL/g时,尿素降解酶活性达到最大值,酶活回收率在80%以上。继续增大加酶量,酶活会有所降低。其原因在于载体表面与酶结合的位点是有限的,过多的游离酶会使结合位点全部被占据,另外,过多的酶分子键合到载体上时,酶分子之间的距离变小,静电斥力增加,使酶分子的活性部位受到一定的影响,酶活有所下降。
2.2 固定化双功能酶的特性表征
2.2.1 温度对固定化酶和游离酶活性的影响 由图4(a)可知,固定化双功能酶催化尿素和EC反应的最适温度分别为40℃和60℃,游离酶催化这两种底物反应的最适温度分别为35℃和40℃。由图4(b)可知,固定化酶催化尿素的酶活在20~50℃之间有较强的稳定性,50℃保温1h,其酶活仍能达到原始酶活的80%。固定化酶催化EC的酶活在20~60℃之间具有良好的稳定性,60℃保温1h,其酶活仍能达到原始酶活的95.2%。而游离酶对尿素和EC的酶活在50℃以上时,呈急剧下降的趋势。说明游离酶经固定化后热稳定性得到明显提高。
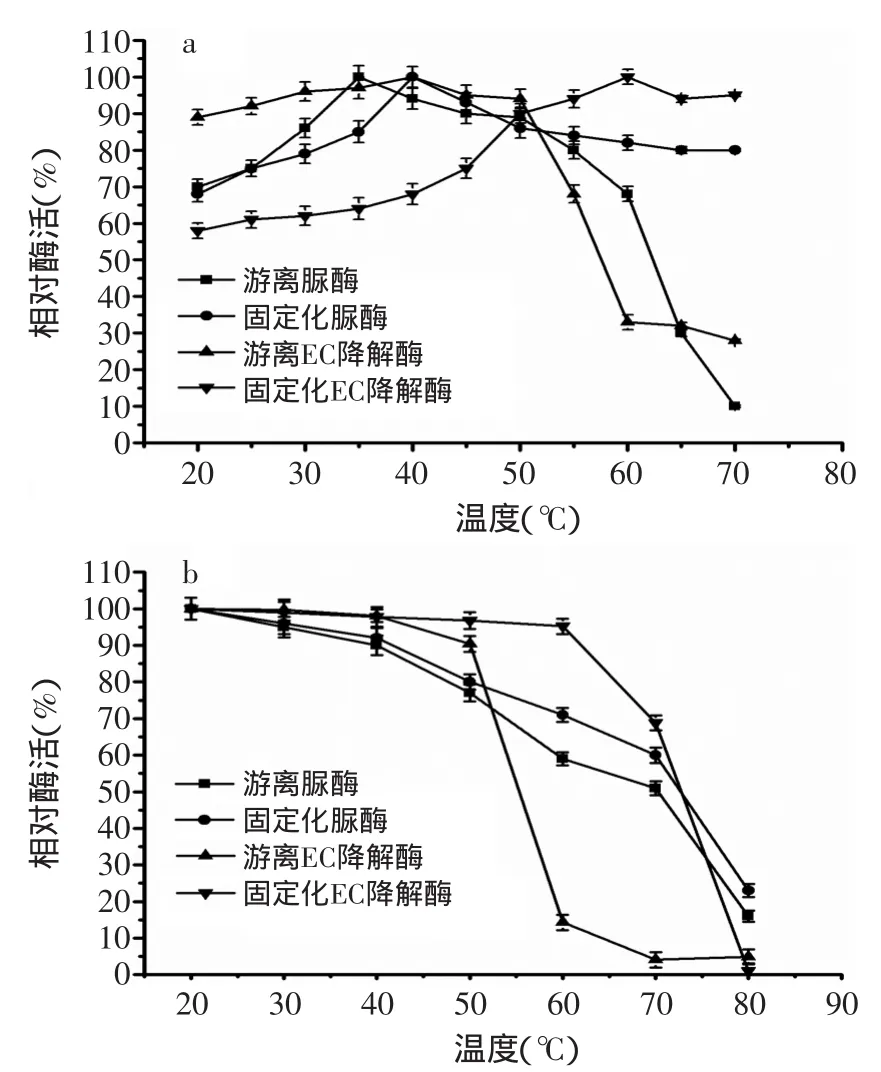
图4 温度对固定化酶和游离酶活性的影响Fig.4 The effect of temperature on the acyivity of immobilized and free enzymes
2.2.2 pH对固定化酶和游离酶活性的影响 由图5(a、b)可知,以EC为底物时,固定化酶的最适pH为4.5,游离酶的最适pH为5.0;以尿素为底物时,固定化酶和游离酶的最适pH分别为为4.0和4.5。相对于游离酶,固定化酶的最适pH向酸性范围移动。由于黄酒的pH范围为3.5~4.5[22],与游离酶相比,固定化酶更适于在黄酒中应用。
由图5(c、d)可知,固定化双功能酶催化EC反应的pH稳定范围为5.0~6.5,在这个pH范围内保温1h,酶活残留率均为83%以上;固定化双功能酶催化尿素反应的酶活在pH4.0~6.5之间有较强的稳定性,在这个pH范围内保温1h,酶活残留率均为88%以上。并且在同一种pH范围内,固定化酶的稳定性比游离酶强。
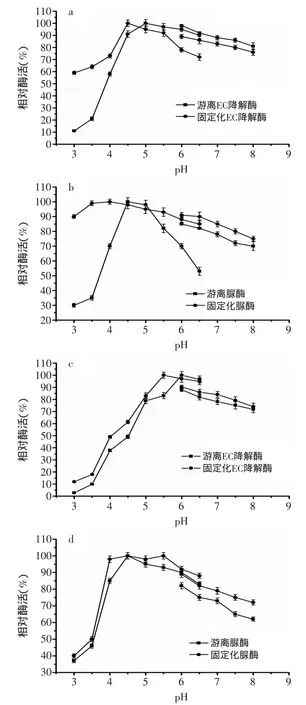
图5 pH对固定化酶和游离酶活性的影响Fig.5 The effect of pH on the acyivity of immobilized and free enzymes
2.2.3 固定化酶的重复使用性 如图6所示,重复使用10次后,固定化酶降解EC和尿素的酶活分别保留原来的30%和80%。EC降解酶酶活和尿素降解酶酶活分别在使用8次和15次后衰减为原来的50%,说明固定化酶重复使用性较好。
2.2.4 固定化酶的动力学参数 按照1.2.7.4的方法分别配制不同浓度的EC和尿素底物,测定不同底物浓度下的酶反应的初速度,以双倒数作图法作图,Lineweaver-Burk曲线如图7所示。
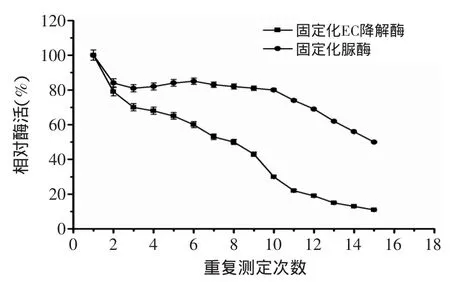
图6 固定化酶的重复使用性Fig.6 The reusability of the immobilized enzymes
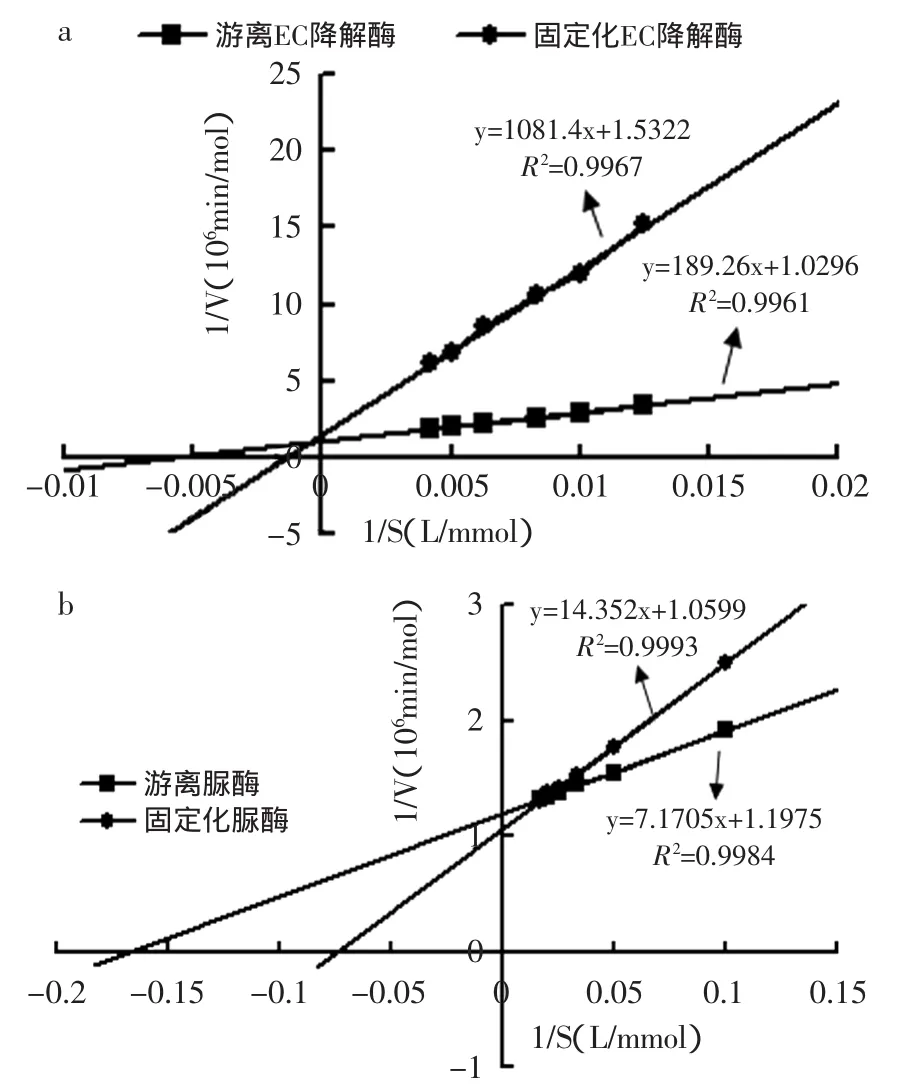
图7 固定化酶和游离酶的Lineweaver-Burk曲线Fig.7 Lineweaver-Burk plot of immobilized enzyme andfree enzyme
由图7计算出,固定化酶和游离酶催化EC的Km分别为705.7825、183.8190mmol/L,Vm为0.6527、0.9713滋mol/min。催化尿素的Km分别为13.5409、5.9879mmol/L,Vm为0.9434、0.8351滋mol/min,而固定化酶的Km值增大,即固定化酶与底物的亲和力变小。通常由于载体基质的空间位阻,阻挡了底物尤其是大分子底物向酶活性中心靠拢,致使底物在酶活性中心的浓度降低,从而减小了酶对底物的亲和性[23]。
2.3 固定化酶的应用
2.3.1 固定化酶在反应器中的应用 在内径3cm,长12cm的柱子中,黄酒的固定化酶加量为37.5U/L,调节流速1mL/min,使400mL的酒样流过反应器,循环处理4次,测定每次过柱后的样品尿素去除率。
如表3所示,黄酒中的初始尿素浓度为74.94mg/L,固定化酶首次可去除酒样中50.8%的尿素,同一黄酒样品循环过柱4次后,尿素去除率达96.92%。
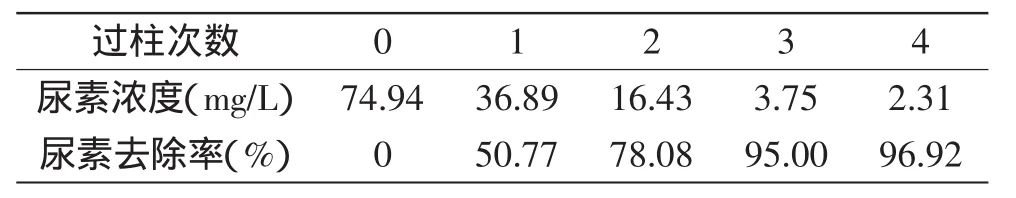
表3 层析柱中固定化酶对黄酒的尿素去除率Table 3 Urea removal rate of the Chinese wine with immobilized enzyme packed in colume
2.3.2 固定化酶的尿素去除率和EC去除率 市售黄酒中加入25mg/L的尿素配制成黄酒样品,每15mL样品中加入不同酶量处理,在32℃摇床转速100r/min的条件下反应20h,二乙酰一肟法测定尿素含量。由表4可知,黄酒样品中游离尿素降解酶加量为0.05U/mL和0.10U/mL时,尿素去除率分别为49.99%和73.30%;样品中固定化尿素降解酶的加量为0.03U/mL和0.04U/mL时,尿素去除率分别为74.16%和93.03%。由2号样品的测定结果可知,其中固定化载体对尿素具有一定的吸附作用。
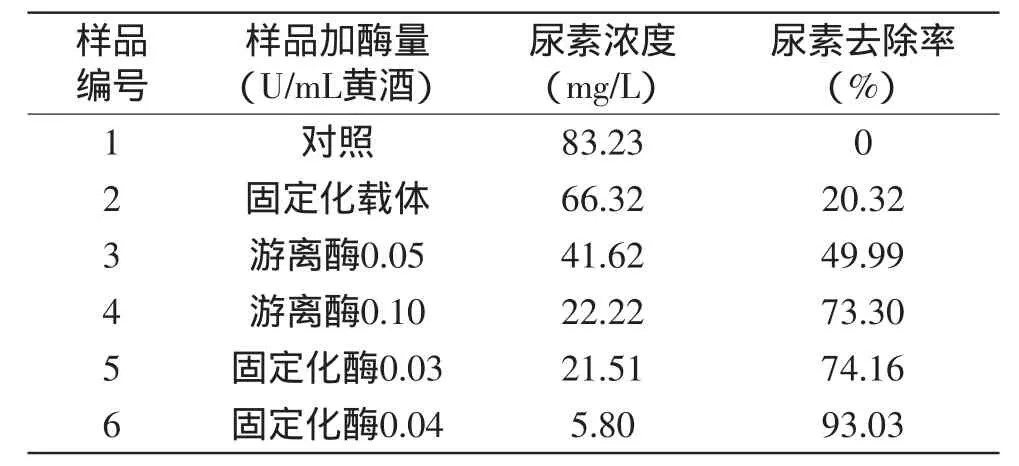
表4 游离酶和固定化酶对黄酒样品的尿素去除率Table 4 Urea removal rate of the free and immobilized enzyme in Chinese wine
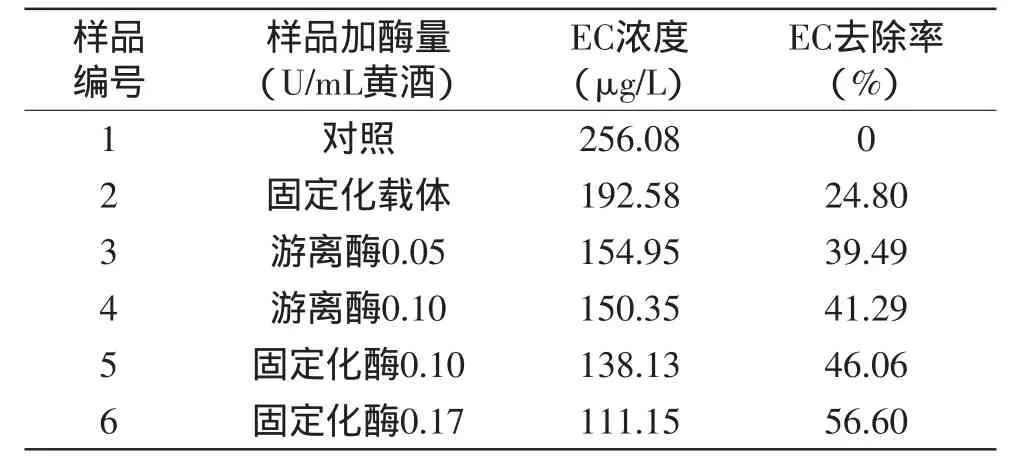
表5 游离酶和固定化酶对黄酒样品的EC去除率Table 5 EC removal rate of the free and immobilized enzyme in Chinese rice wine
市售黄酒中加入100滋g/L EC配制成黄酒样品,每15mL样品加入不同量酶处理,在32℃摇床转速100r/min的条件下反应20h,采用GC-MS法测定黄酒样品的EC含量。由表5可知,黄酒样品中游离EC降解酶加量为0.05U/mL和0.10U/mL时,EC去除率分别为39.49%和41.29%;样品中固定化EC降解酶的加酶量为0.10U/mL和0.17U/mL时,EC去除率分别为46.06%和56.60%。由2号样品的测定结果可知,其中固定化载体对EC也具有一定的吸附作用。
2.3.3 固定化酶处理后的黄酒风味分析 上述固定化酶处理过的黄酒采用顶空-固相微萃取-气质联用技术测定样品中的挥发性风味物质。由图8的结果查数据库可知,固定化处理前的黄酒含有47种挥发性风味物质,处理后的黄酒含有45种挥发性风味物质。用固定化酶处理后减少了2种醇类和1种醛类,分别是:丙醇、丁醇和龙葵醛二甲醇缩醛;增加了1种酯类,为棕榈酸乙酯;变化的几种物质均含量极少,且不是影响黄酒风味的主要物质。由此可知,固定化酶处理之后,对黄酒的挥发性风味物质没有太大影响,因而不影响黄酒的风味。
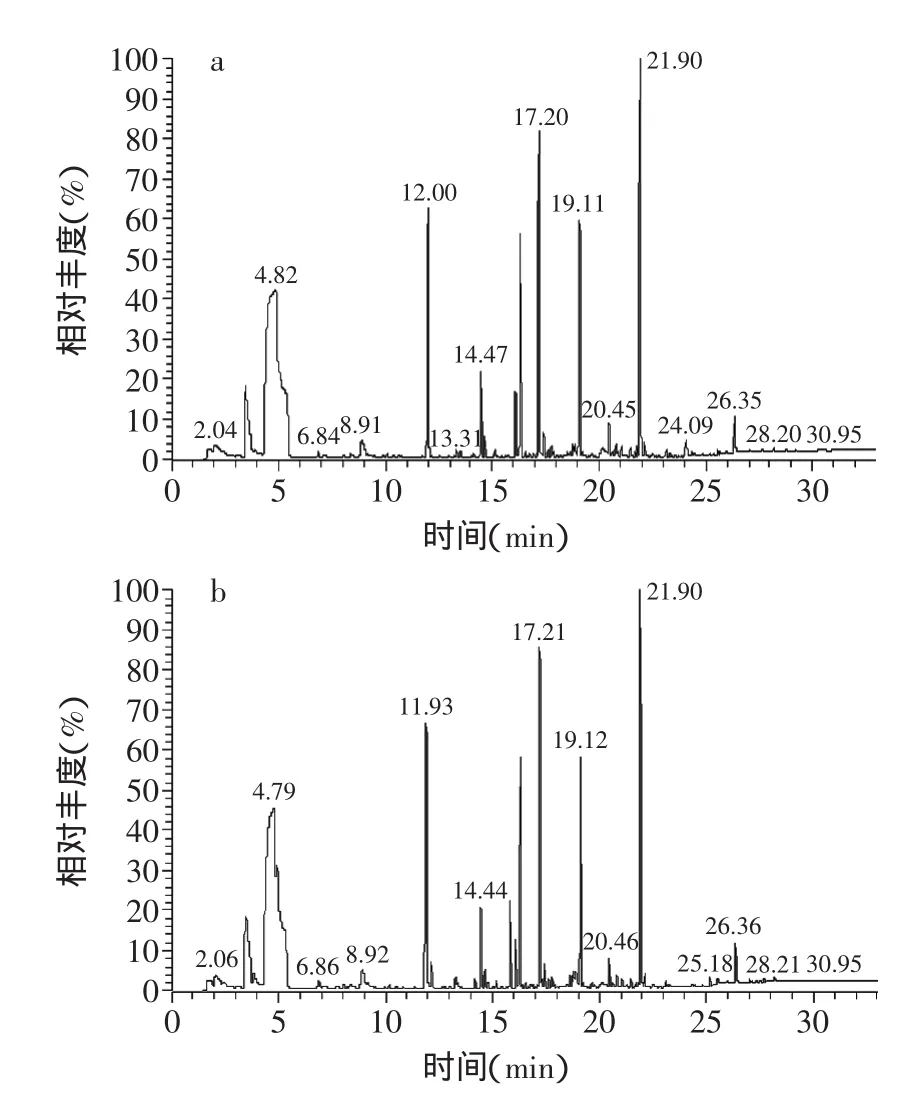
图8 黄酒的挥发性风味物质图谱Fig.8 Map of volatile flavor substances in wine
3 结论
本文采用壳聚糖微球在一定优化的最适条件下对Providenciasp.JNB815所产的具有脲酶和EC降解酶活性的双功能酶进行固定化。固定化酶对温度、pH的耐受性均有所提高。固定化酶应用于黄酒中时,可去除其中的微量尿素和EC,且不影响黄酒的风味,对黄酒中微量有害物质的控制有着良好的效果。另外,本文使用壳聚糖-明胶-京尼平的无毒体系固定化酶,与传统的戊二醛交联法相比,此方法在食品工业中更具有应用前景。进一步研究提高载体的强度以及固定化酶的反应器形式,可为固定化酶的工业化创造良好的基础。
[1]高年发,宝菊花.氨基甲酸乙酯的研究进展[J].中国酿造,2006(9):1-4.
[2]周景文,堵国成,陈坚.发酵食品有害氨(胺)类代谢物:形成机制和消除策略[J].中国食品学报,2011,11(9):8-25.
[3]王玉美,田亚平,赵光鳌,等.肠杆菌酸性脲酶的提取及基本特性[J].食品工业科技,2007,28(4):178-180.
[4]Kobashi K,Takabe S,Sakai T.Removal of urea from alcoholic beverages with an acid urease[J].Journal of Applied Toxicology,1988,8(1):73-74.
[5]Yang L,Wang S,Tian Y.Purification,properties,and application of a novel acid urease from Enterobacter sp.[J]. Applied Biochemistry and Biotechnology,2010,160(2):303-313.
[6]Mohapatra B R,Bapuji M.Characterization of urethanase from Micrococcus species associated with the marine sponge(Spirasfrella species)[J].Letters in Applied Microbiology,1997,25(6):393-396.
[7]Gu X,Tian Y.Isolation and characterization of urethanase from Penicillium variabile and its application to reduce ethyl carbamate contamination in Chinese rice wine[J].Applied Biochemistry and Biotechnology,2013,170(3):718-728.
[8]刘俊.中国黄酒中氨基甲酸乙酯控制策略及机制的研究[D].无锡:江南大学,2012.
[9]蒋樱华.微生物脲酶的固定化研究[D].南京:南京理工大学,2006.
[10]Karnchanajindanun J,Srisa-ard M,Srihanam P,et al. Preparation and characterization ofgenipin-cross-linked chitosan microparticlesby water-in-oilemulsion solvent diffusion method[J].Natural Science,2010,2(10):1061-1065.
[11]Fernandes S C,de Oliveira Santos D M P,Vieira I C. Genipin-cross-linked chitosan as a support for laccase biosensor [J].Electroanalysis,2013,25(2):557-566.
[12]金勋杰,杨显生,姬烨,等.蛋白胶联剂京尼平与戊二醛的生物学特性比较[J].中国临床康复,2006,10(25):60-62.
[13]Weatherburn M W.Phenol-hypochloritereaction for determination of ammonia[J].Analytical Chemistry,1967,39(8):971-974.
[14]Yoshizawa K,Takahashi K.Utilization of urease for decomposition of urea in sake[J].Brew Soc Japan,1988,83(2):142-144.
[15]de Melo Abreu S,Alves A,Oliveira B,et al.Determination of ethyl carbamate in alcoholic beverages:an interlaboratory studytocompareHPLC-FLD withGC-MSmethods[J]. Analytical and Bioanalytical Chemistry,2005,382(2):498-503.
[16]Liu J,Xu Y,Zhao G.Rapid determination of ethyl carbamate in Chinese rice wine using headspace solid-phase microextraction and gas chromatography-mass spectrometry[J].Journal of the Institute of Brewing,2012,118(2):217-222.
[17]Luo T,W Fan,Y Xu.Characterization of volatile and semivolatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatography-mass spectrometry[J].Journal of the Institute of Brewing,2008,114(2):172-179.
[18]张佳宁,宋云花,王珗,等.海藻酸钠-壳聚糖固定化磷脂酶A2的研究[J].食品工业科技,2012,33(21):201-205.
[19]高启禹,徐光翠,李永佳,等.明胶载体固定化木聚糖酶技术的研究[J].食品工业科技,2013,34(6):223-226.
[20]Akao T,Kobashi K,Aburada M.Enzymic studies on the animal and intestinal bacterial metabolism of geniposide[J]. Biological&Pharmaceutical Bulletin,1994,17(12):1573-1576.
[21]Sung H W,Huang D M,Chang W H,et al.Evaluation of gelatin hydrogel crosslinked with various crosslinking agents as bioadhesives:in vitro study[J].Journal of Biomedical Materials Research,1999,46(4):520-530.
[22]俞关松.黄酒pH指标范围的探讨及超标的预防控制[J].酿酒,2002,29(4):50-51.
[23]朱琰.魔芋葡甘聚糖改性与固定化脲酶应用研究[D].南京:南京理工大学,2008.
Study on an immobilized bifunctional enzyme applied in rice wine with natural materials
ZHA Xiao-hong,YANG Guang-ming,TIAN Ya-ping*
(Key Laboratory of Industrial Biotechnology,Ministry of Education Jiangnan University,Wuxi 214122,China)
By using a compound method of adsorption,embedment and crosslink,a bifunctional enzyme produced by Providencia sp.JNB815 with both urease and urethanase activity was immobilized.With urea degrading activity as an indicator,the optimum immobilization conditions through single factor experiments were as follows:chitosan 4.0%,gelatin 2.0%,0.4%of genipin and the crosslink was conducted at 30℃ with concussion for 6h.Then the crosslinked microspheres were used to immobilize the enzyme for 8h.The optimum pH was 4.5 and 4.0,and the optimum temperature was 60℃ and 40℃,respectly when immobilized enzyme catalyzed urethane and urea.The immobilized enzyme activity to EC maintained stability when the temperature was in the range of 20~60℃ and pH 5.0 to 6.5.The immobilized enzyme activity to urea maintained stability when the temperature was in the range of 20~50℃and pH 4.0 to 6.5.It retained 80%and 30%of the original catalytic avtivity to urea and EC,respectively after being used 10 times.Under the condition of 32℃ and 100r/min,0.04U urease was added to per mL rice wine.After being processed for 20h,the removing rate of urea in wine reached 93.03%.Under the same condition,the removing rate of EC in wine was 56.60%after 20h,when the amount of urethanase added was 0.17U per mL wine.In addition,the treatment with immobilized enzyme showed neglectable effect on the detected flavor substances in the wine.
immobilization;bifunctional enzyme;wine;urethane
TS201.2
A
1002-0306(2014)14-0186-07
10.13386/j.issn1002-0306.2014.14.033
2013-10-24 *通讯联系人
查小红(1988-),女,硕士研究生,研究方向:工业微生物学与酶工程。
国家973计划项目(2012CB720802)。
