人工湿地去除三唑磷的生物学机制初步研究
2014-02-28冯玉琴伍亮吴娟钟非代嫣然成水平
冯玉琴,伍亮,吴娟,钟非,代嫣然,成水平
同济大学污染控制与资源化研究国家重点实验室,上海200092
人工湿地去除三唑磷的生物学机制初步研究
冯玉琴,伍亮,吴娟,钟非,代嫣然,成水平*
同济大学污染控制与资源化研究国家重点实验室,上海200092
构建了以陶粒为基质、种植美人蕉(Canna indica)的水平潜流人工湿地小试系统,研究了该人工湿地系统对水体中三唑磷(triazophos, TAP)的去除效果,通过测定基质酶脲酶和碱性磷酸活性、微生物种群特征及植物根系超氧化物歧化酶和过氧化物酶活性,初步探讨了该人工湿地系统去除水体TAP的生物学机制。实验结果表明,在进水TAP浓度分别为0 mg·L-1(对照CW1)、0.1 mg·L-1(低浓度CW2)、1 mg·L-1(中浓度CW3)和5 mg·L-1(高浓度CW4)的条件下,人工湿地对水体中三唑磷具有良好的去除效果,去除率分别是96.4%、96.8%和53.7%。在进水TAP浓度越高的人工湿地系统中,进水端基质脲酶和碱性磷酸酶活性越高。中、高TAP浓度进水的系统中脲酶活性分别高于对照系统21.8%和29.2%。高TAP浓度进水的系统中碱性磷酸酶活性分别高于对照和低浓度进水系统51.7%和36.3%(p<0.05)。比较进水端而言,各系统出水端的酶活性显著降低(p<0.05)。相关性分析结果显示系统TAP的去除与基质中碱性磷酸酶活性呈显著正相关(p<0.05),表明基质中脲酶、碱性磷酸酶在人工湿地去除TAP过程中发挥重要作用。对各人工湿地系统基质中微生物进行分离纯化,并通过16S rDNA基因测序,结果表明,进水含TAP系统的进水端基质中均存在能够促进植物对氮磷营养元素的吸收以及与有机物降解密切相关的菌种,尤其在高TAP浓度进水的系统中发现一株含脱氨酶基因(acds)的菌株,能够促进有机磷降解中间产物—有机胺类的降解转化。此外,美人蕉根系超氧化物歧化酶和过氧化物酶活性在进水TAP浓度升高的情况下,呈现显著增强态势(p<0.05),并正常生长,说明美人蕉对TAP具有较好的抵抗能力。
人工湿地;三唑磷;美人蕉;微生物;酶活性
自二十世纪九十年代开始,有机磷农药逐渐开始替代有机氯农药广泛应用于农业生产中,然而其中许多高毒性有机磷,如甲基对硫磷、对硫磷等因对环境具有严重的危害作用先后被禁用。三唑磷(Triazophos,TAP)作为一种中等毒性、广谱有机磷杀虫剂,以其低毒、杀虫效果好、生产工艺简单等优点,仍被大量应用于防治粮食、果树以及蔬菜类农作物上的螟虫、红蜘蛛等害虫等农业生产(Tang和You,2012)。但三唑磷同样具有半衰期较长,且容易通过土壤渗透、地表径流等途径进入自然水体(Wang等,2005),造成的农药面源污染等特性,因此亟需有效途径对其污染加以控制。
人工湿地是一种利用基质、植物和微生物去除污染物的生态处理方法,具有能耗低、运行管理方便、污染物去除率高等优点,在处理农业面源污染方面发挥着巨大的作用(Kovacic等,2000; Ortega-Clemente等,2013)。通过充分优化水力停留时间、水生植物种植密度等,人工湿地可有效减弱农业灌溉尾水中拟除虫菊酯对环境的危害(Budd等,2009)。人工湿地中基质粒径、水生植物种类、菌群丰富度等因素会影响到有机磷降解效果(Agudelo等,2011),选择适合的水生植物、控制基质种类和粒径范围、有效调控水利条件等可将有机磷的去除率提高至80%以上。
当前研究多偏重于运行工况对有机磷去除效果的影响研究,而对湿地系统内基质、植物及微生物对有机磷去除机理的研究甚少,从而不能为工程的实际应用提供具体的理论依据。且目前对人工湿地去除有机磷污染的研究对象多为氧乐果、甲基对硫磷等高毒性有机磷((Karpuzcu等,2013)),而随着三唑磷等中等毒性农药的广泛使用,如何利用人工湿地等生态工程削减其面源污染的研究也急需
展开。有研究报道了水培条件下的美人蕉可积极响应三唑磷的胁迫(Cheng等,2007),进一步研究也表明美人蕉可促进根系微生物的生长及群落结构的形成,从而实现三唑磷的有效去除(Xiao等,2010),但并未将美人蕉应用于实际的人工湿地系统中对其去除效果和生理响应做深入研究。本研究旨在探讨种植美人蕉的水平潜流人工湿地去除水体中三唑磷的生物学作用机制,重点研究植物与微生物在吸收、降解三唑磷过程中的生理学响应及种群变化。通过测定基质微生物的脲酶和碱性磷酸酶(ALP)(Michela等,2012),细菌分离纯化法鉴定基质微生物优势种群并进行16S rDNA基因序列测定,初步解析人工湿地去除三唑磷的微生物学机制(Wang等,2012);同时测定美人蕉(Canna indica)根系抗氧化酶活性,了解人工湿地中美人蕉对三唑磷的响应及抗性。
1 材料与方法
1.1 人工湿地小试系统与运行方式
实验系统为四组水平潜流人工湿地,长×宽×高:1200×400×800 mm;湿地主体填充粒径1~3 mm的人工陶粒,进水腔填充粒径3~8 mm的石英砂(图1)。湿地植物为美人蕉(Canna indica),种植密度为20株·m-2。湿地进水采用人工配水,且为连续进水,其中进水化学需氧量(COD)为41~82 mg·L-1,总磷(TP)浓度为0.14-0.71 mg·L-1,总氮(TN)浓度为2.05-3.51 mg·L-1;进水三唑磷浓度分别设置为0,0.1,1,5 mg·L-1,对应湿地系统编号为CW1、CW2、CW3、CW4,水力负荷为200 mm·d-1。三唑磷纯品由强生(上海)化学试剂有限公司提供。人工湿地稳定运行半年后,于2013年4、5、6月进行了各项测试。
1.2 三唑磷净化效果测定
进行了测定利用固相萃取-高效液相色谱联用法(SPE-HPLC)分别测定湿地系统进水端和出水中三唑磷浓度。检测条件为流动相,甲醇:超纯水=80:20(V:V);流量1.0 mL·min-1;柱温30 ℃;检测波长246 nm;进样量10 µL;保留时间5.7 min。三唑磷浓度采用峰面积法计算。三唑磷去除率计算公式如下:
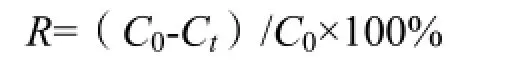
式中,R为去除率,C0为进水浓度,Ct为停留48 h后出水浓度。
1.3 基质酶活性测定
分别从湿地进水端10~15 cm处和出水端10~15 cm处取适量植物根区基质(深0~10 cm),测定其脲酶和碱性磷酸酶(ALP)活性。测定方法分别为奈氏比色法(Kandeler和Gerber,1988)和磷酸苯二钠比色法(陈永华等,2009)。即将所取样品充分混合,从中称取5 g,手动去除植物根系等杂物,然后经前处理后在37 ℃条件下培养24 h和2 h,再经过滤、显色,由标准曲线求得脲酶和ALP活性(Ge等,2011)。
1.4 基质微生物种群特征分析
取湿地进水端10~15 cm处和出水端10~15 cm处取适量表层根区基质(深0~10 cm),采用细菌分离纯化法对微生物优势种群进行鉴定,对分离菌株进行16S rDNA基因序列测定(Joseph和David,2012)。具体方法:将适量基质置于无菌生理盐水中经震荡、稀释得到悬液;分别取悬液100 µL 在伊红美兰培养基、营养琼脂培养基、水解酪蛋白、WS四种培养基上进行涂布,28 ℃条件下培养过夜;挑取单菌落,接种到营养肉汤中并在28 ℃、200 r·min-1振荡条件下过夜培养,清除杂菌;最后将纯培养的细菌离心管送至上海杰李公司测序。细菌测序使用通用引物1492 R和27 F进行正反测序,测序结果通过软件拼接而成。
1.5 湿地植物根系抗氧化酶活性测定
分别从四组人工湿地表层(0~5 cm)根系取美人蕉新生根根尖样品,取样点分别为样点1-5(图1)。超氧化物歧化酶(SOD)和过氧化物酶(POD)测定预处理方法:取适量根系样品(平行样n=3)加入预冷酶提取液(0.05 mol/L pH 7.8的磷酸缓冲液PBS),冰浴研磨至匀浆,在4 ℃、10000 r·min-1条件下低温离心15 min,上清液即为粗酶液。SOD的测定采用氮蓝四唑(NBT)光化还原法(Beauchamp和Fridovich,1971),以抑制NBT光化还原的50 %为一个酶活性单位表示。POD的测定采用愈创木酚方法(Hammerschmidt等,1982),取适量酶液与底物愈创木酚和H2O2发生反应,以1 min内吸光度(OD)增加0.01所需的酶量为一个酶活单位,紫外分光光度计测定POD的活性。
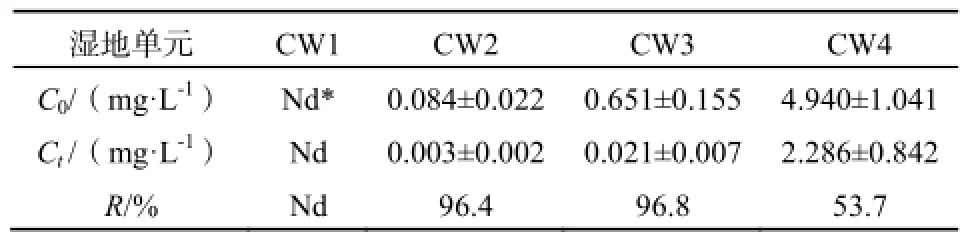
表1 湿地系统进出水TAP浓度及去除率Table 1 Concentrations and removal rates of TAP in the four constructed wetlands
1.6 数据分析
运用SPSS17.0对各测定变量进行单因素方差分析(One-way ANONA),不同处理组两两差异比较通过Duncan和LSD检验。三唑磷的去除与基质酶活性的关系采用皮尔森(Pearson)相关性分析。基质微生物测序所得代表序列在国家生物技术信息中心(National centre of biotechnology information, NCBI)上BLAST(Basic Local Alignment Search Tool)进行相似性序列比较。并将序列提交至NCBI数据库,获得相应的GenBank序列号。
2 结果与分析
2.1 湿地系统进出水TAP浓度
人工湿地实际进出水三唑磷浓度见表1。经过湿地系统中陶粒吸附、微生物降解以及植物的吸收降解作用,低浓度系统CW2和CW3出水三唑磷含量明显低于进水中三唑磷含量,去除率分别为96.4%、96.8%(表1)。而高浓度进水的CW4系统中三唑磷去除率仅为53.7%,显著低于CW2和CW3系统(p<0.05)。
2.2 基质脲酶和碱性磷酸酶活性
如图2(1)显示,随着进水三唑磷浓度的增加,四组人工湿地的进水端微生物脲酶活性呈依次上升趋势,CW2、CW3、CW4系统进水端脲酶活性分别高出CW1系统19.7%、21.8%和29.2%。其中,CW3和CW4与对照系统差异显著(p<0.05),表明三唑磷的加入对脲酶分泌产生了显著影响。另外方差分析结果还显示,添加三唑磷的三组系统进水端脲酶活性与相应出水端以及对照组进水端的脲酶活性都存在显著性差异(P<0.05)。而在出水端,CW2、CW4脲酶活性显著高于CW1、CW3(p<0.05)。
从图2(2)可以看出,同脲酶规律类似,随着进水三唑磷浓度的增加,四组人工湿地系统的进水端微生物ALP活性同样呈上升趋势,CW2、CW3、CW4系统进水端ALP活性分别高出对照系统11.3%、23.0%和51.7%。其中,高浓度系统CW4显著高于系统CW1、CW2(p<0.05)。此外,四组系统出水端的ALP活性相对于进水端,分别降低了25.9%、28.8%、41.6%、53.1%。其中,三组添加三唑磷的湿地系统中,出水端ALP活性均与其进水端差异显著(p<0.05),但四组系统之间差异不显著。且三唑磷的去除与湿地系统中ALP活性呈显著正相关(Pearson指数=0.995)。
2.3 微生物种群特征分析
16s DNA测序共得到23条有效序列,均属于假单胞菌属。对所得结果进一步分析发现,在添加三唑磷系统的进水端均出现了能够促进植物对磷的吸收以及与有机磷降解可能相关的菌株。其中,从CW2中分离得到的042402WS-1(KF803181)与Pseudomonas sp. SF4c的相似性较高(99%)。Fischer等人(Fischer等,2006;2010)发现此菌株能以1-氨基环丙烷-1 -羧酸为单一氮源,分泌铁载体-吲哚乙酸底物,以此促进磷酸盐在土壤中的水溶性,有助于植物的对氮磷营养元素的吸收;从CW3进水端分离得到的042407NA-1(KF803178)则与荧光假单胞菌Pseudomonas fluorescens Pf0–1的同源性较高(99%),该菌种在无机磷缺乏的条件下能够分泌碱性磷酸酯酶,从而使有机态磷易于转化为无机态,便于自身或其它共生生物的吸收(Monds等,2006);而CW4进水端分离得到的042406SL-1(KF803180)菌株与Pseudomonas veronii gene strain: nBP2、Pseudomonas veronii gene strain: nBP5和Pseudomonas veronii gene strain: MT4具有99%的相似性。Pseudomonas veronii属于荧光假单胞细菌属,目前研究表明Pseudomonas veronii能够净化被污染的土壤,对芳香族有机污染物具有一定的降解作用;与CW4进水端另外分离得到的042405WS-1菌株相似度较高的菌种有Pseudomonas sp. SaCS17、Pseudomonas fluorescens strain CLW17等。Pseudomonas sp. SaCS17中含脱氨酶基因(acds),能够促进有机胺类的转化,该基因所表达的脱氨酶在根际促生菌中广泛存在,能够分解乙烯前体以提高植物在逆境胁迫下的适应能力(Janette等,2009),而Pseudomonas fluorescens strain CLW17是从一种的溶磷细菌,能够通过分泌酸性物质等改善植物根区对磷的吸收,对植物的生长有明显的促进作用(任嘉红等,2012)。
2.4 植物根系抗氧化酶活性
图3(1)为湿地系统中美人蕉根系SOD随三唑磷降解的沿程变化。进水三唑磷浓度越高,湿地美人蕉根系SOD活性越高。此外,各湿地系统中植物根系SOD活性呈现不同的沿程变化趋势。其中,对照系统CW1中,SOD活性一直处于较低状态;进水浓度为0.1 mg·L-1的CW2系统SOD活性由进水端至出水端整体呈现下降趋势,但变化不明显,出水端的SOD活性比进水端仅低18.3%;而CW3和CW4中SOD活性沿程的下降趋势相对较
明显,出水端SOD活性比进水端分别降低了38.1%和32.4%。方差分析结果显示,各湿地系统之间SOD活性存在极其显著差异(p<0.01)。为了进一步深入探讨不同浓度三唑磷在湿地中沿程变化情况,我们对不同湿地系统相同位点的SOD活性进行分析发现,CW4系统中SOD活性在所有样点均显著高于对照组和CW2系统;CW3系统SOD活性仅在样点1、2和5处显著高于对照组和系统CW2。
图3(2)为4~6月份湿地系统中美人蕉根系过氧化物酶POD活性随三唑磷降解的沿程变化情况。由图可以直观看出,同样进水三唑磷浓度越高,湿地美人蕉根系POD活性越高,即CW4(5 mg·L-1)>CW3(1 mg·L-1)>CW2(0.1 mg·L-1)>CW1(0 mg·L-1)。且随三唑磷在系统中的降解,在进水浓度不同的湿地系统中,POD活性呈现不同的变化趋势。对照系统CW1中,POD活性一直处于较低水平,且变化不明显;而实验组CW2、CW3和CW4中,POD活性除在湿地后半部分(样点4)有小幅上升外,沿程整体均呈显著下降趋势,出水端(样点5)的POD活性相较于进水端(样点1),分别降低了26.3%、29.9%以及33.9%。通过比较不同湿地系统,发现各湿地系统之间的POD活性均存在极其显著差异(p<0.01);而比较不同湿地系统相同位点的SOD活性发现,在进水端(样点1),实验组湿地系统与对照组差异最为明显,且四组湿地系统POD活性差异极其显著(p<0.01)。此外,CW4在湿地前端(样点2处),POD活性显著高于其它三组湿地系统(p<0.05)。
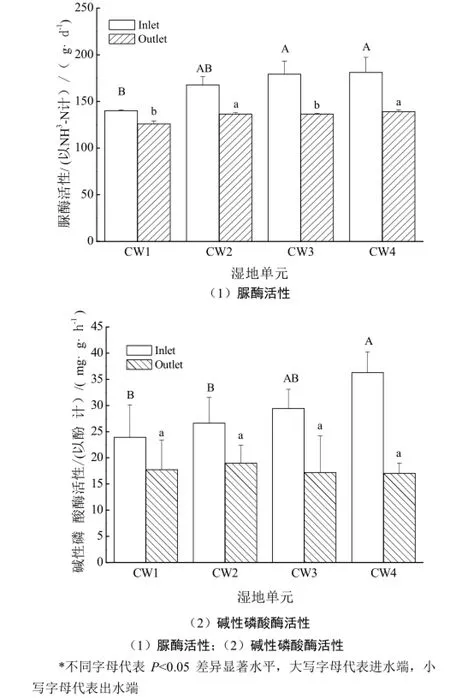
图2 湿地系统基质酶活性Fig.2 Enzyme activities in different constructed wetlands
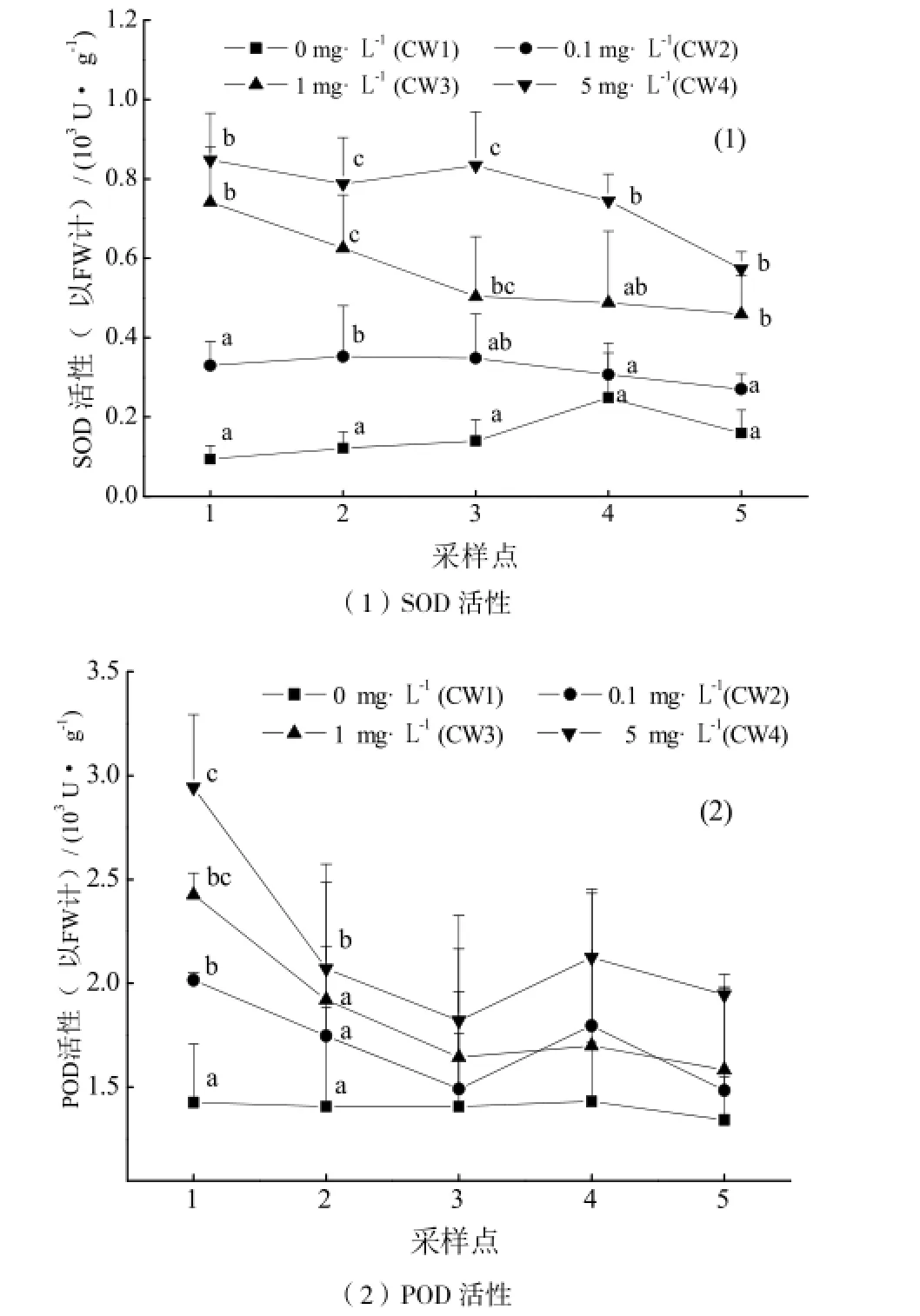
图3 美人蕉根系抗氧化酶活性沿程变化情况(1) SOD活性 (2) POD活性Fig.3 Variations of antioxidant enzyme activitys in Canna roots along the flow in wetland
3 讨论
在湿地系统中,脲酶是与氮元素循环密切相关的酶,主要作用于尿素的水解使其转变为氨。一般情况下,脲酶的活性与基质中的微生物含量、有机物质含量、全氮和速效氮含量成正相关(Kang等,1998),有研究表明湿地基质的脲酶活性与TN去除率有较好的相关性,可以把人工湿地根区基质中脲酶的活性作为人工湿地去除污水中含氮污染物效果的一个主要指标(吴振斌等,2001)。本研究中,当进水中含有三唑磷时,湿地系统微生物脲酶活性
受三唑磷影响而明显升高,特别是进水端(图2)。说明湿地中微生物能够以三唑磷为底物,并通过脲酶分泌量的增多来降解其水解中间产物——尿素(Liang等,2011)。此外,高浓度进水系统中,脲酶的活性没有随进水三唑磷浓度的显著增加而呈现明显的升高现象,这说明湿地微生物脲酶活性已接近最大值。磷酸酶能促进有机磷化合物水解,在生态系统P元素循环与周转中发挥着重要作用(Newman等,2003)。在土壤中,ALP活性与微生物的丰富度呈正相关,表明微生物是ALP的主要贡献者(Rani和Juwarkar,2012)。本研究中,随着进水三唑磷浓度的增加,湿地系统的进水端ALP活性同样呈上升趋势,说明系统中的微生物可根据进水三唑磷浓度分泌适量的ALP用于有机磷的转化降解。但与脲酶情况不同的是,在高浓度三唑磷系统中,进水端ALP活性随三唑磷浓度的增加呈显著升高现象,这表明湿地系统微生物ALP分泌量可能还有存在一定上升的空间。此外,出水端不论是脲酶还是ALP,其活性均远低于进水端,且各系统间差异并不明显,这可能与出水端水体营养盐不足,以及相应植物生长状况较差有关。
湿地基质微生物分离纯化及测序结果表明,对照组与三个实验组的微生物群落组成有一定的差异。实验组中存在与有机物降解相关的菌种,CW4中的042405WS-1菌株与含脱氨酶基因的Pseudomonas sp. SaCS17的有较高的相似性(99%),而已知的三唑磷降解过程中会产生有机胺类中间产物,表明042405WS-1菌株可能与三唑磷的降解直接相关。目前未发现其他菌株对有机磷存在专性降解作用,但发现的大部分菌株都与甲苯、烷基酚等有机污染物的降解密切相关,它们在三唑磷降解过程中的作用仍需进一步深入研究。
在正常情况下,植物组织中活性氧的形成和清除之间保持一种动态平衡,当植物遭受环境因子胁迫时,这种平衡被破坏,自由基积累,引起植物细胞水平的氧化伤害(Foyer和Noctor,2000)。SOD和POD是植物的两种重要抗氧化酶,能清除氧化物自由基,从而避免其对植物膜质的破坏作用。在本研究中,进水添加三唑磷的湿地系统中SOD和POD活性显著高于对照组(p<0.05),表明在三唑磷胁迫下,美人蕉本身的防御机能和抗逆性生理活动被刺激加快,通过SOD和POD活性提高以减弱活性氧的伤害。而三个实验系统之间美人蕉根系的SOD和POD活性同样存在极其显著差异(p<0.01),说明美人蕉根系抵抗三唑磷的胁迫能力随三唑磷浓度的升高而增强。特别在湿地前端,三唑磷未被植物和微生物吸收降解,导致四组湿地系统在采样点1处的SOD和POD活性均存在极其显著差异(p<0.01)。而随着三唑磷在人工湿地中的降解,胁迫作用逐渐降低,不同单元的SOD和POD活性呈不同程度下降趋势。值得注意的是,在三唑磷浓度较高的情况下(5 mg·L-1),植物根区SOD和POD作为抗氧化酶系统的防线仍保持较高的活性,说明美人蕉对三唑磷具有较高的抗胁迫能力。
4 结论
1)种植美人蕉的水平潜流人工湿地系统对受三唑磷污染的水体具有一定程度的净化作用,对低浓度三唑磷(TAP)污染有较好的去除效果。
2)三唑磷浓度会影响系统中尤其是进水端微生物脲酶和碱性磷酸酶的分泌,表明长期运行下的系统中微生物能够通过调节与三唑磷去除密切相关的酶实现对三唑磷的有效降解。
3)不同的三唑磷进水浓度会对系统的微生物群落组成产生明显的影响,持续运行的系统中微生物得到充分选择与驯化,能够分离出与三唑磷降解相关的菌种。
4)湿地植物美人蕉在一定范围内其抗氧化性随三唑磷浓度的升高而增强,对三唑磷具有较高的抗胁迫能力,能够实现对三唑磷的有效吸收和降解。
Agudelo R M, Machado C, Aguirre N J, et al. 2011. Optimal conditions for chlorpyrifos and dissolved organic carbon removal in subsurface flow constructed wetlands[J]. International Journal of Environmental Analytical Chemistry, 91 (7-8): 668-679.
Beauchamp C, Fridovich I. 1971. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels[J]. Analytical biochemistry , 44 (1): 276-287.
Budd R, O’Geen A, Goh K S, et al. 2009. Efficacy of constructed wetlands in pesticide removal from tailwaters in the Central Valley, California[J]. Environmental science & technology, 43 (8): 2925-2930.
Cheng S, Xiao J, Xiao H, Zhang L, et al. 2007. Phytoremediation of triazophos by Canna indica Linn. in a hydroponic system[J]. International journal of phytoremediation, 9 (6): 453-463.
Fischer S E, Fischer S I, Magris S, et al. 2006. Isolation and characterization of bacteria from the rhizosphere of wheat[J]. World Journal of Microbiology and Biotechnology, 23 (7): 895-903.
Fischer S E, Jofre E C, Cordero P V, et al. 2010. Survival of native Pseudomonas in soil and wheat rhizosphere and antagonist activity against plant pathogenic fungi[J]. Antonie van Leeuwenhoek, 97 (3): 241-251.
Foyer C H, Noctor G. 2000. Oxygen processing in photosynthesis: regulation and signalling[J]. New Phytologist , 146 (3): 359-388.
Ge Y, Zhang C, Jiang Y, et al. 2011. Soil microbial abundances and enzyme activities in different rhizospheres in an integrated vertical flow constructed wetland[J]. Clean - Soil, Air, Water, 39 (3): 206-211.
Hammerschmidt R, Nuckles E, Kuć J. 1982. Association of enhanced peroxidase activity with induced systemic resistance of cucumber to Colletotrichum lagenarium[J]. Physiological Plant Pathology, 20 (1): 73-82.
Janette O L, Ismael H L, Lourdes G, et al. 2009. ACC (1-Aminocyclopropane-1-Carboxylate) deaminase activity, a widespread trait in burkholderia species, and its growth-promoting
effect on tomato plants[J]. Applied and Environmental Microbiology, 75 (20): 6581–6590.
Joseph S , David R. 2012. Molecular cloning: a laboratory manual [M] . New York: Cold Spring Harbor Laboratory Press: 631-681.
Kandeler E, Gerber H. 1988. Short-term assay of soil urease activity using colorimetric determination of ammonium[J]. Biology and Fertility of Soils, 6 (1): 68-72.
Kang H J, Freeman C, Lee D, et al. 1998. Enzyme activities in constructed wetlands: implication for water quality amelioration[J]. Hydrobiologia, 368: 231-235.
Karpuzcu M E, Sedlak D L, Stringfellow W T. 2013. Biotransformation of chlorpyrifos in riparian wetlands in agricultural watersheds: implications for wetland management[J]. Journal of Hazardous Materials, 244– 245 (2013): 111– 120.
Kovacic D A, David M B, Gentry L E, et al. 2000. Effectiveness of constructed wetlands in reducing nitrogen and phosphorus export from agricultural tile drainage[J]. Journal of Environmental Quality, 29 (4): 1262-1274.
Liang B, Yang C, Gong M, et al. 2011. Adsorption and degradation of triazophos, chlorpyrifos and their main hydrolytic metabolites in paddy soil from Chaohu Lake, China[J]. Journal of environmental management, 92 (9): 2229-2234.
Michela S, Maurizio B , Serena D, et al. 2012. Wetland plants, micro-organisms and enzymatic activities interrelations in treating N polluted water[J]. Ecological Engineering, 47(2012): 36-43.
Monds R D, Newell P D, Schwartzman J A, et al. 2006. Conservation of the Pho regulon in Pseudomonas fluorescens Pf0-1[J]. Applied and Environmental Microbiology, 72 (3): 1910-1924.
Newman S, McCormick P V, Backus J G. 2003. Phosphatase activity as an early warning indicator of wetland eutrophication: problems and prospects[J]. Journal of Applied Phycology, 15 (1): 45-59.
Ortega-Clemente L A, Luna-Pabello V M, Poggi-Varaldo H M. 2013. Wastewater Reuse and Management[M]. México: Springer Netherlands: 373-395.
Rani R, Juwarkar A. 2012. Biodegradation of phorate in soil and rhizosphere of Brassica juncea (L.) (Indian Mustard) by a microbial consortium[J]. International Biodeterioration & Biodegradation, 71: 36-42.
Tang M, You M. Isolation. 2012. Identification and characterization of a novel triazophos-degrading Bacillus sp. (TAP-1) [J]. Microbiol ogical Research, 167 (5): 299-305.
Wang L, Zhang L, Chen H, et al. 2005. Isolation of a triazophos-degrading strain Klebsiella sp. E6 effectively utilizing triazophos as sole nitrogen source[J]. FEMS microbiology letters, 253 (2): 259-265.
Wang R, Baldy V, Perissol C, et al. 2012. Influence of plants on microbial activity in a vertical-downflow wetland system treating waste activated sludge with high organic matter concentrations[J]. Journal of environmental management, 95: 58-64.
Xiao H, Cheng S, Wu Z. 2010. Microbial community variation in phytoremediation of triazophos by Canna indica Linn. in a hydroponic system[J]. Journal of Environmental Sciences, 22 (8): 1225-1231.
陈永华, 吴晓芙, 何刚, 等. 2009. 人工湿地污水处理系统中的植物效应与基质酶活性[J]. 生态学报, 29(11): 6051-6058.
任嘉红, 刘辉, 吴晓蕙, 等. 2012. 南方红豆杉根际溶无机磷细菌的筛选,鉴定及其促生效果[J]. 微生物学报, 52 (3): 295-303.
吴振斌, 梁威, 成水平, 等. 2001. 人工湿地植物根区土壤酶活性与污水净化效果及其相关分析[J]. 环境科学学报, 21(5): 622-624.
Primary study on biological mechanism of removing triazophos by constructed wetland
FENG Yuqin, WU Liang, WU Juan, ZHONG Fei, DAI Yanran, CHENG Shuiping
State Key Laboratory of Pollution Control and Resources Reuse, Tongji University, Shanghai 200092, China
Four horizontal subsurface constructed wetlands (HSCWs), which were filled with ceramsite and planted with Canna indica, were constructed. The removal efficiencies of triazophos (TAP) by HSCWs were determined. The enzyme activities of urease and alkaline phosphatase (ALP) and population characteristic of microorganism in the medium and the superoxide dismutase (SOD) and peroxidase (POD) in root of C. indica were investigated to discuss the biological mechanisms in the process of removing TAP. Under the inflow concentration of TAP were 0 mg·L-1(CW1, control), 0.1 mg·L-1(CW2, lower concentration), 1 mg·L-1(CW3, medium concentration) and 5 mg·L-1(CW4, higher concentration), the removal percentages of TAP were 96.4%, 96.8% and 53.7% in CW2, CW3 and CW4, respectively. The activities of urease and ALP in the medium of the inlet section of CWs went up along with the increasing of inflow TAP. The urease activities in CW3 and CW4 were significantly higher than that in the control (CW1) with 21.8% and 29.2% (P<0.05), respectively. While ALP activity in CW4 was significantly higher than those in CW1 and CW2 with 51.7% and 36.3% (P<0.05). respectively. Compared to these in inlet section of HSCWs, the activities of these two enzymes decreased significantly in the outlet section of HSCWs (P<0.05). Correlation analysis indicated that there was significant positive correlation between TAP removal percentages and ALP activities in the HSCWs (P<0.05). These results suggested that urease and ALP play important roles in removing TAP in the HSCWs. By 16S rDNA gene sequences detection, some special microorganisms were isolated from the medium in the inlet section of the HSCWs treated with TAP, which could affect the nitrogen and phosphorus adsorption of plant and the degradation of organic phosphorus. It was notable that a bacterial strain containing deaminase gene (acds), capable of degrading organic amines, was isolated and identified from the higher TAP concentration inflow HSCW. Additionally, with the increasing discharge of TAP, the activities of SOD and POD in the root of C. indica increased and showed significant differences (P<0.05) in the four HSCWs. These indicated that C. indica owns the ability to resist TAP.
constructed wetland; triazophos; Canna indica; microorganism; enzymes activity
X17
A
1674-5906(2014)05-0853-06
国家自然科学基金(51278355);污染控制与资源化研究国家重点实验室(PCRRY11007)
冯玉琴(1989年生),女,硕士研究生,主要从事人工湿地技术研究。E-mail:yqffeng@163.com
*通讯作者:成水平(1969年生),男,教授,主要从事生态工程技术研究。E-mail:shpcheng@tongji.edu.cn
2014-01-08
冯玉琴,伍亮,吴娟,钟非,代嫣然,成水平. 人工湿地去除三唑磷的生物学机制初步研究[J]. 生态环境学报, 2014, 23(5): 853-858.
FENG Yuqin, WU Liang, WU Juan, ZHONG Fei, DAI Yanran, CHENG Shuiping. Primary study on biological mechanism of removing triazophos by constructed wetland [J]. Ecology and Environmental Sciences, 2014, 23(5): 853-858.
