三种食源性致病菌多重PCR检测方法的建立
2014-02-28姜琛璐钟慈平西南大学食品科学学院重庆400715
舒 畅,姜琛璐,钟慈平,李 林(西南大学食品科学学院,重庆400715)
三种食源性致病菌多重PCR检测方法的建立
舒 畅,姜琛璐,钟慈平,李 林*
(西南大学食品科学学院,重庆400715)
目的:建立同时快速检测沙门氏菌、志贺氏菌和肠出血性大肠杆菌O157∶H7的多重PCR方法。方法:根据沙门氏菌的invA基因、志贺氏菌的ipaH基因及肠出血性大肠杆菌O157∶H7的uidA基因设计3对引物,通过单因素实验、L9(34)正交实验优化反应体系,并对多重PCR扩增的敏感性进行分析。结果:3对引物能特异性扩增出495、620、252bp的目的片段;在最优多重PCR反应体系下,多重PCR检测3种致病菌的灵敏度达104CFU/mL;将该法应用于人工污染实验,可在5h内得到准确、稳定的检测结果。结论:该方法操作简单、检测特异性和灵敏度较高,能够实现对沙门氏菌、志贺氏菌和肠出血性大肠杆菌O157∶H7 3种食源性致病菌的快速监控和诊断。
食源性致病菌,多重PCR,沙门氏菌,志贺氏菌,肠出血性大肠杆菌O157∶H7
食品安全是当前世界公共卫生问题的焦点,近年来,食品安全事件频繁发生,其中食源性疾病以其高发病率成为食品安全面临的最突出问题。据世界卫生组织(WHO)统计,全球每年的食源性疾病病例多达数十亿例,其中有220万人因此而丧生[1]。引起食源性疾病的首要危害因子是食源性致病菌,其来源多样、繁殖迅速[2],常见的有沙门氏菌(Salmonella)、志贺氏菌(Shigella)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、单增李斯特菌(Listeria Monocytogens)等[3]。目前,对食源性致病菌的检测多采用常规培养法、免疫法等[4],程序繁琐,耗时费力,难以满足公共卫生事件应急处理快速、准确的需要。随着分子生物学的发展,尤其是PCR技术的诞生,针对如沙门氏菌[5]、金黄色葡萄球菌[6]、志贺氏菌[7]、单增李斯特菌[8]等某一种菌或某一类致病菌的PCR方法得以建立,弥补了传统培养方法的不足,提高了检测效率及准确性。然而,在食品工业高速发展的今天,食品的污染情况更为复杂,污染致病菌的不确定性及多样性使检测工作的难度加大,容易误检或漏检[9-10],因此,建立一种高效、灵敏、特异性强的检测方法迫在眉睫。多重PCR技术为此提供了可能,它可实现在一个反应体系中,使用多对特异性引物,完成对多种病原微生物的同时检测或鉴定[11],具有快速、经济、简便的特点,是未来食源性致病菌检测技术的主要发展趋势[12]。
沙门氏菌、志贺氏菌和肠出血性大肠杆菌是三种常见的食源性致病菌,均属肠杆菌科,其形态和生理特性较相似,容易交叉污染,引起食物中毒[13]。采用多重PCR技术同时对该三种菌进行检测具有较大的实用价值,然而,国内外在这方面的研究成果较少。本研究通过引物设计、单因素、正交实验确定了方法,并通过特异性和灵敏度实验对该方法进行了效果验证,并分析了实验中出现的问题及解决方案,以期为快速检测食源性致病菌、有效控制病原菌传播、预防食物中毒、减少疾病发生提供参考。
1 材料与方法
1.1 材料与仪器
菌株编号、名称及来源 见表1;细菌基因组DNA提取试剂盒、普通琼脂糖凝胶DNA回收试剂盒天根生化科技(北京)有限公司;10×PCR Buffer(Mg2+free)、MgCl2(25mmol/L)、dNTP Mixture(2.5mmol/L each)、rTaq DNA polymerase(5U/μL)、6×DNA loading Buffer、100bp DNA ladder、DL1000 DNA Marker 宝生物工程(大连)有限公司;沙门氏菌、志贺菌属琼脂平板(ss琼脂)、麦康凯琼脂平板 重庆庞统医疗器械有限公司;O157显色培养基 郑州博赛技术股份有限公司;脑心浸液肉汤 英国OXOID公司。
PTC-200核酸扩增仪 美国MJ公司;DYY-11电泳仪 北京市六一仪器厂;ChemiDoc XRS凝胶成像仪 美国伯乐公司;eppendorf离心机 德国eppendorf公司。
1.2 实验方法
1.2.1 引物的设计与合成 根据三种食源性致病菌的特异性保守序列[14-16],即沙门氏菌的invA基因、志贺氏菌的ipaH基因和肠出血性大肠杆菌的uidA基因,利用软件Oligo6.0、Primer5.0[17]设计引物,引物序列见表2,委托生工生物工程(上海)股份有限公司合成。

表1 菌株及其来源Table 1 Strains in this study

表2 多重PCR引物序列Table 2 Primers for multiplex PCR
1.2.2 细菌培养及模板DNA的制备 将沙门氏菌、志贺氏菌、肠出血性大肠杆菌O157∶H7分别接种于脑心浸液肉汤中,36℃过夜培养,采用细菌基因组DNA提取试剂盒制备模板DNA,产物于-20℃保存备用。
1.2.3 单重PCR反应
1.2.3.1 单重PCR体系的建立及引物特异性验证 分别以3株沙门氏菌、2株志贺氏菌、2株肠出血性大肠杆菌O157∶H7的基因组DNA为模板,采用25μL反应体系:上下游引物(10mmol/L)各0.5μL,10×PCR Buffer(Mg2+free)2.5μL,dNTP(2.5mmol/L each)2μL,Mg2+(25mmol/L)2μL,Taq DNA聚合酶(5U/μL)0.25μL,灭菌超纯水16.25μL,模板1μL;反应程序:94℃预变性4min,94℃45s、60℃90s、72℃1min,30个循环,72℃延伸7min,扩增产物经1.5%琼脂糖凝胶电泳后通过紫外成像进行检测;同时以上述程序扩增蜡样芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌、单增李斯特菌、致泻大肠埃希氏菌、副溶血性弧菌、苏云金芽孢杆菌、蕈状芽孢杆菌等菌株的基因组DNA,验证所设计引物的特异性。
1.2.3.2 单重PCR灵敏度检测 分别挑取3种细菌(以鼠伤寒沙门氏菌ATCC14028、福氏志贺氏菌CMCC51572和肠出血性大肠杆菌O157∶H7 ATCC43888为例)于灭菌生理盐水中制成菌悬液,用比浊仪测试其浓度至108CFU/mL,然后用灭菌生理盐水按10倍梯度稀释,使菌液浓度为108~100CFU/mL,分别提取DNA后,按上述条件进行PCR扩增,分析单重PCR扩增的敏感性。
1.2.4 多重PCR反应
1.2.4.1 多重PCR反应的建立及产物鉴定 将沙门氏菌、志贺氏菌和肠出血性大肠杆菌O157∶H7的基因组DNA进行组合作为模板,采用1.2.3.1的PCR反应条件进行扩增,并用普通琼脂糖凝胶DNA回收试剂盒回收目的条带,送往生物工程(上海)股份有限公司测序。
1.2.4.2 多重PCR反应体系优化 实验流程如下所示:
a.单因素实验:对引物、Mg2+、dNTP、Taq酶4个因素设计7个水平进行实验,确定各因素的适宜水平范围:引物添加量:上下游引物(10μmol/L)依次各加入0.1、0.2、0.3、0.4、0.5、0.6、0.7μL;Mg2+(25mmol/L)添加量:依次加入0.5、1.0、1.5、2.0、2.5、3.0、3.5μL;dNTP(2.5mmol/L)添加量:依次加入0.5、1.0、1.5、2.0、2.5、3.0、3.5μL;Taq酶添加量:依次加入0.10、0.15、0.20、0.25、0.30、0.35、0.40μL。引物、Mg2+、dNTP、Taq酶4个因素的固定水平取7个水平的中间值,分别为0.4、2.0、2.0、0.25μL。
b.正交实验:单因素实验确定的最佳水平并不能代表整个反应体系的最佳组合,不同的组合方式也可能对反应体系产生影响。本研究选取单因素实验确定的各因素的3个最佳水平,选用L9(34)正交设计表(见表3)进行实验。
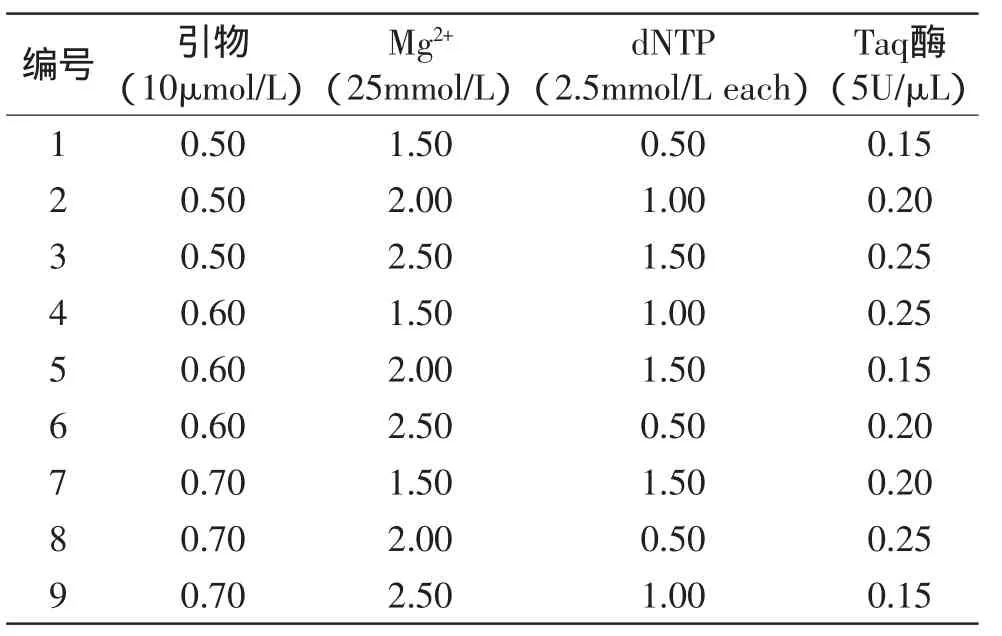
表3 L9(34)实验方案Table 3 The project of L9(34)experiment
1.2.4.3 退火温度优化 在实验确定的最佳反应体系基础上,对PCR退火温度进行优化筛选,依次设为55、56、57、58、59、60、61、62、63、64℃,从中确定最佳退火温度。
1.2.4.4 多重PCR灵敏度 取三种菌108~100CFU/mL各相同浓度的菌液等量混合,制成浓度为108~ 100CFU/mL的混合菌悬液,分别提取各稀释度的基因组DNA,按最优PCR反应体系进行扩增。
1.2.5 人工染菌 取经国标验证不含本研究的三种食源性致病菌的奶粉25g,加入225mL灭菌生理盐水均质,分别取三种菌过夜培养后的等浓度菌液各1mL加入7mL奶粉匀浆中混匀,然后以均质液作为稀释液进行10倍稀释,制成108~100CFU/mL的菌悬液,分别提取基因组DNA,按最优多重PCR体系进行扩增。
2 结果与分析
2.1 单重PCR反应
2.1.1 单重PCR扩增及引物特异性验证 3株沙门氏菌(鼠伤寒沙门氏菌14028、都柏林沙门氏菌50761、布伦登卢普沙门氏菌H9812)、2株志贺氏菌(福氏志贺氏菌51572、宋内志贺氏菌51592)和2株肠出血性大肠杆菌O157∶H7(肠出血性大肠杆菌O157∶H7 43888、肠出血性大肠杆菌O157∶H7 43889)的PCR扩增结果呈阳性,分别得到长度为495、620、252bp的目的片段,片段符合预期产物大小。其余9株菌株呈阴性,且无非特异性条带,表明本研究设计的3对引物特异性较好。

图1 单重PCR扩增结果及引物特异性验证Fig.1 The result of single PCR amplification and specificity of the primers
2.1.2 单重PCR扩增敏感性分析 由图2可知,单重PCR检测沙门氏菌的灵敏度达104CFU/mL,志贺氏菌的灵敏度达103CFU/mL,肠出血性大肠杆菌O157∶H7的灵敏度达104CFU/mL。
2.2 多重PCR反应
2.2.1 多重PCR反应的建立及产物鉴定结果 将三种食源性致病菌的基因组DNA组合后进行PCR扩增,均能得到目的片段,且相应的目的条带清晰,未发生交叉影响,表明本研设计三对引物可用于进行多重PCR扩增;将目的条带回收后测序,测序结果表明,沙门氏菌、志贺氏菌、肠出血性大肠杆菌O157∶H7的扩增序列与Genbank中公布的基因序列的同源性均达98%以上,从而证实PCR产物确为目的产物。

图2 单重PCR检测三种致病菌的灵敏度Fig.2 Detection sensitivity of single PCR for three pathogens

图3 多重PCR反应的建立Fig.3 Establishment of multiplex PCR
2.2.2 多重PCR扩增条件优化结果
2.2.2.1 单因素实验结果 根据单因素实验结果(图3),引物、Mg2+、dNTP、Taq酶4个因素的3个适宜水平确定如下:引物(10mmol/L)适宜添加量:上下游引物各添加0.5、0.6、0.7μL;Mg2+(25mmol/L)适宜添加量:1.5、2.0、2.5μL;dNTP(2.5mmol/L each)适宜添加量:依次加入0.5、1.0、1.5μL;Taq酶适宜添加量:依次加入0.15、0.20、0.25μL。

图4 单因素实验结果Fig.4 The results of single-Factor experiment
2.2.2.2 正交实验结果 根据单因素实验确定的4因素3水平设计正交实验,由图5可见,在9组反应体系中,由于引物、Mg2+、dNTP、酶4个因素添加量组合的不同,扩增效果出现了显著差异,其中第8泳道效果最佳,因此,25μL多重PCR最佳反应体系确定为:上下游引物各0.7μL(10μmol/L),10×PCR Buffer(Mg2+free)2.5μL,dNTP(2.5mmol/L each)0.5μL,Mg2+(25mmol/L)2μL,Taq DNA聚合酶(5U/μL)0.25μL,灭菌超纯水12.55μL,模板各1μL。

图5 正交实验优化多重PCR反应体系结果Fig.5 Optimization of multiplex PCR by orthogonal experiment design
2.2.3 最佳退火温度 如图6所示,选择55~64℃进行温度梯度PCR,均能得到目的条带,其中第3泳道的条带最亮,因此选择57℃作为本研究的最佳退火温度。

图6 最佳退火温度的选择Fig.6 Optimization of annealing temperature
2.2.4 多重PCR灵敏度检测 由图7可见,多重PCR同时检测沙门氏菌、志贺氏菌和肠出血性大肠杆菌O157∶H7的灵敏度为104CFU/mL。一般而言,多重PCR的检测灵敏度低于单重PCR的灵敏度,因为在多重PCR反应体系中,模板与引物的结合几率可能随引物、模板的种类和添加量的增加而降低[18],但本研究通过单因素实验和正交实验,优化出反应体系中各因素的最佳配比,有效地提高了模板与引物的结合效率,从而建立了与单重PCR灵敏度相当的多重PCR反应。

图7 多重PCR同时检测沙门氏菌、志贺氏菌和肠出血性大肠杆菌O157∶H7的灵敏度
2.3 人工染菌

图8 牛乳样品人工染菌的检测灵敏度Fig.8 Detection sensitivity of artificial pollution
由图8可见,采用本研究建立的多重PCR方法检测人工污染奶粉中的三种致病菌,可得到清晰、分明的条带,检出限为106CFU/mL,比没有食品介质的多重PCR灵敏度低2个数量级,这是因为食品中的成分十分复杂,有些成为PCR抑制因素,可能降低PCR检测的灵敏度,有研究表明脂肪是导致PCR检测灵敏度下降的因素之一[19]。
3 结论与讨论
多重PCR是以单重PCR为基础发展而来的检测技术,该技术不仅可实现对多种致病菌同时进行鉴定,还可对同一致病菌不同耐药性[20-22]或血清型[23]进行检测。到目前为止,多重PCR因其高效、快速、低成本等优点而被广泛用于食源性致病菌的检测中。然而,多重PCR并不是简单的混合体系反应,检测过程中会受多种因素的影响,首先,多重PCR的引物设计是关键,Settanni L[24]通过实验表明为了确保一对引物只能特异性扩增出唯一的产物,引物设计应更长、解链温度(Tm)应更高。本研究选取编码沙门氏菌侵袭蛋白的invA基因、编码志贺氏菌侵袭性质粒抗原的ipaH基因及编码大肠杆菌β-葡萄糖醛酸酶的uidA基因作为目的基因,结果显示引物特异性较好;其次,引物、dNTP、Mg2+、Taq酶、退火温度等是影响PCR的重要因素,多重PCR体系因存在多对引物、多个模板而更加复杂,鉴于此,本研究结合单因素实验和L9(34)正交实验建立了多重PCR的最佳反应体系(25μL):上下游引物各0.7μL(10μmol/L),10×PCR Buffer(Mg2+free)2.5μL,dNTP(2.5mmol/L each)0.5μL,Mg2+(25mmol/L)2μL,Taq DNA聚合酶(5U/μL)0.25μL,灭菌超纯水12.55μL,三种细菌的模板DNA各1μL,经验证该反应的特异性较好。但相比于其他PCR反应,本研究中的单重PCR及多重PCR的灵敏度相对较低,主要影响因素可能是模板,本研究采用试剂盒法提取基因组DNA,得到的模板纯度高,但量少,且因客观条件限制,不能对模板浓度进行测定,无法摸索最适反应浓度,可能对反应灵敏度造成了影响。后续研究中可在模板提取的最后一步适当少加入TE溶液溶解,以提高DNA模板的浓度;也可采用多种基因组提取方法,并进行效果对比;另外,在确定模板浓度的基础上,可将其加入到单因素实验、正交实验中,寻找反应各因素的最佳配比。此外,本研究所确立的多重PCR体系可直接从人工污染的奶粉中检测出沙门氏菌、志贺氏菌、肠出血性大肠杆菌O157∶H7 3种致病菌,从样品处理到检测结束仅需5h左右,但灵敏度降低了两个数量级,主要是由于样品中存在诸多干扰成分,如脂肪、多糖、蛋白质等均会影响多重PCR的检测灵敏度,可通过对样品进行增菌培养后再进行多重PCR来解决这一问题[25-26]。在后续的研究中,我们也将进一步探索提高检测灵敏度的途径,以期建立更加高效、稳定、灵敏的多重PCR方法。
本研究建立的多重PCR体系可同时检测沙门氏菌、志贺氏菌、肠出血性大肠杆菌O157∶H7,具有操作简单、快速、准确等优点,为食源性致病菌的快速筛查提供了重要的技术支持。
[1]World Health Organization.Food Safety-a World-wide Challenge[R].Uppsala:WHO,2001.
[2]VELUSAMY V,ARSHAK K,KOROSTYNSKA O,et al.An overview of foodborne pathogen detection:in the perspective of biosensors[J].Biotechnol Adv,2009,28(2):232-254.
[3]SCALLAN E,HOEKESTRA R M,ANGULO F J,et al. Foodborne illness acquired in the united states-major pathogens [J].Emerg Infect Dis,2011,17(1):7-15.
[4]徐潇,林兰,崔生辉,等.食品中致病菌常用检测技术分析[J].中国药事,2012,26(2):185-190.
[5]邵碧英,陈彬,汤敏英,等.沙门氏菌DNA提取及PCR反应条件的优化[J].食品科学,2007,28(7):331-334.
[6]RIYAZ-UL-HASSAN S,VERMA V,QAZI GN.Evaluation of three different molecular molecular markers for the detection of Staphylococcus aureus by polymerase chain reaction[J].Food Microbiol,2008,25(3):452-459.
[7]胡建华,李洁莉,马兆飞,等.牛奶样品中志贺氏菌的快速PCR检测技术研究[J].食品科学,2007,28(8):433-437.
[8]KIM H J,CHO J C.Rapid and sensitive detection of Listeria monocytogenes using a PCR-enzymelinked immunosorbent assay [J].J Microbiol Biotechnol,2008,18(11):1858-1861.
[9]王大勇,方振东,谢朝新,等.食源性致病菌快速检测技术研究进展[J].微生物学杂志,2009,29(5):67-72.
[10]李艳霞,吴松浩.食品微生物检测技术的研究进展[J].食品工业科技,2008,29(7):270-273.
[11]M C EDWARDS,R A GIBBS.Multiplex PCR:Advantages,development,and applications[J].Genome Research,1994,3(4):65-75.
[12]AVIJIT ROY,AMER FAYAD,G BARTHE,et al.A multiplex polymerase chain reaction method for reliable,sensitive and simultaneous detection of multiple viruses in citrus trees[J]. Journal of Virological Methods,2005,129(1):47-55.
[13]许一平,成炜,陈福生.多重PCR技术在食源性病原菌检测中的应用[J].食品科学,2007,28(2):355-359.
[14]WORRAL L J,VUCKOVIC M,STRYNADKA N C.Crystal structure of the c-terminal domain of the Salmonella type III secretion system export apparatus protein InvA[J].Protein Sci,2010,19(5):1091-1096.
[15]罗雁飞,丁旭,文雪,等.IpaH-1基因在志贺氏菌表达的检测及PCR条件的优化[J].中国实验诊断学,2012,16(10):1770-1773.
[16]RIYAZ-UL-HASSAN S,SYED S,JOHRI S,et al.Application of a multiplex PCR assay for the detection of Shigella Escherichia coli and shiga toxin-producing Esch.coli in Milk[J].J Dairy Res,2009,76(2):188-194.
[17]刘志杰,李如举,曾智勇,等.多重PCR反应的影响因素及其优化[J].黑龙江畜牧兽医,2011(7):26-28.
[18]王慧,朱瑞良,谭燕玲,等.多重PCR检测三种重要食源性致病菌方法的建立及应用[J].中国农业科学,2011,44(11):2334-2340.
[19]WILSON I G.Inhibition and facilitation of nucleic acid amplification[J].Applied and Environment Microbiology,1997,63(10):3741-3751.
[20]CATTOIR V,POIREL L,ROTIMI V,et al.Multiplex PCR for detection of plasmid-mediated quinolone resistance qnr genes in ESBL-producing enterobacterial isolates[J].J Antimierob Chemother,2007,60(2):394-397.
[21]POMBA C,MENDONCA N,COSTA M,et al.Improved multiplex PCR method for the rapid detection of beta-lactamase genes in Eseherichia coli of animal origin[J].Diagn Microbiol Infect Dis,2006,56(1):103-106.
[22]CHIA JH,CHU C,SU LH,et al.Development of a multiplex PCR and SHV melting-curve mutation detection system for detection of some SHV and CTX-M beta-lactamases of Escherichia coli,Klebsiella pneumonia,and Enterobacter cloacae in Taiwan[J].J Cin Microbiol,2005,43(9):4486-4491.
[23]MCCARTHY N,REEN FJ,BUCKLEY JF,et al.Sensitive and rapid molecular detection assays for Salmonella enterica serovars Typhimurium and Heidelberg[J].J Food Prot,2009,72(11):2350-2357.
[24]SETTANNI L,CORSETTI A.The use of multiplex PCR to detect and differentiate food and beverage-assciated microorganisms:a review[J].J Microbiol Methods,2007,69(1):1-22.
[25]张敬平,吴家林,肖勇,等.沙门菌、志贺菌和副溶血性弧菌的多重PCR快速检测技术的建立与应用[J].检验医学,2008,23(6):642-645.
[26]王如景.三种食源性致病菌多重PCR快速检测方法的研究[D].保定:河北农业大学,2012.
Establishment of a multiplex PCR detection method for three foodborne pathogens
SHU Chang,JIANG Chen-lu,ZHONG Ci-ping,LI Lin*
(College of Food Science,Southwest University,Chongqing 400715,China)
Objective:To establish a rapid multiplex polymerase chain reaction(PCR)method for the simultaneous detection of Salmonella spp.,Shigella spp.and Enterohemorrhagic Escherichia coli O157∶H7.Methods:Three pairs of primers had been designed based on the invA gene in Salmonella spp.,ipaH gene in Shigella spp. and uidA gene in Enterohemorrhagic Escherichia coli O157∶H7,single-factor experiment and L9(34)orthogonal experiment were used to optimize multiplex PCR amplification system,and the sensitivity of multiplex PCR was also analyzed.Results:Fragments of 495,620,252bp were obtained respectively.Under the optimized condition,the detection sensitivity of multiplex PCR for three pathogens was 104CFU/mL.This method had been applied to artificial experiment,the result was accurate and steady,which could be obtained within 5h. Conclusion:A simple,specific and sensitive multiplex PCR method had been established and it was valuable for rapid monitoring and diagnosis for Salmonella spp.,Shigella spp.and Enterohemorrhagic Escherichia coli O157∶H7.
foodborne pathogens;multiplex polymerase chain reaction(PCR);Salmonella spp.;Shigella spp.;Enterohemorrhagic Escherichia coli O157∶H7
TS201.3
A
1002-0306(2014)12-0049-06
10.13386/j.issn1002-0306.2014.12.001
2013-10-09 *通讯联系人
舒畅(1989-),女,硕士研究生,研究方向:食品安全与质量控制。
