经裸区肝脏悬吊法行右肝巨大肿瘤切除术
2014-02-27戴朝六贾昌俊徐锋赵闯
戴朝六 贾昌俊 徐锋 赵闯
肝脏外科发展的历史可谓是外科医生与出血做斗争的历史,也是临床实践紧密依托基础医学研究进展的范例。过去数十年来,肝实质切开前首先进行右肝的彻底游离被认为是右半肝切除术常规且最为重要的操作步骤,通过游离右半肝可充分显露肝后下腔静脉,便于处理汇入下腔静脉右侧的肝短静脉、肝右下静脉以及肝右静脉,以防肝切除过程中损伤出血。但游离操作过程中对右肝的翻动,可影响入肝血流,导致对残肝实质的挤压和损害甚至引起肿瘤破裂反而增加出血,而在恶性肿瘤患者尚有引起肿瘤局部与全身扩散之虑。为规避肝脏游离过程中所带来的不利影响,早在上世纪60 年代中山大学王成恩教授[1]提出了原位肝切除术亦即先根据预定切面切离肝实质再游离右半肝。此后,陈孝平教授[2]改进血流阻断方法行原位肝切除24例。至上世纪90年代Lai等[3]将这一术式称为逆行或前入路法右半肝切除技术,但此路径存在肝断面严重出血与损伤肝后下腔静脉的风险; 2001年Belghiti等[4]基于肝短静脉的分布特点的观察研究,提出了肝脏悬吊法(liver hanging maneuver,LHM),以提高前入路肝切除的安全性,并逐渐为许多学者所认可[5-9]。LHM的主要风险是盲目分离下腔静脉前壁,有导致肝短静脉出血的潜在风险,尤其是肝右叶巨大肿瘤常常推挤、压迫、甚至与下腔静脉紧密粘连使之扭曲移位、变形,恶性肿瘤还可侵犯肝后下腔静脉,此时并不适宜甚至禁忌行LHM。为此,陈孝平教授等[10]又提出了经腔静脉旁亦即右肝游离后经肝脏裸区肝脏悬吊法(transbare-aera LHM,TBLHM)行右半肝切除术。笔者经过临床实践,发现在传统方法(顺行或后入路)行右肝巨大肿瘤切除过程中应用该方法亦有其独特的优势,效果良好,现浅谈体会。
一、TBLHM技术的解剖学基础与理论依据
(一)LHM技术临床应用存在的问题
LHM是指先分离肝后段下腔静脉与肝实质之间的间隙并置带将肝脏悬吊,从而在不完全游离肝脏的情况下行肝实质的切离,最后彻底游离右半肝的周围韧带,完成右半肝切除术。该技术是建立在对肝脏解剖学尤其是下腔静脉前壁肝短静脉分布规律深入研究的基础上。通过对临床病例与解剖研究发现肝短静脉虽然多少不一,粗细不等,但其分布有一定的规律性。也即肝后段下腔静脉表面10~11点处,最窄处有一2~15 mm,平均(8.7±2.3) mm的无血管区[11],在适当向下分离(2~2.5 cm)下腔静脉前壁以及肝右静脉与肝中静脉间隙后,再紧贴下腔静脉前壁自下至上经过该无血管区盲目分离,可以置入悬吊带,切肝过程中适当提拉吊带,避免损伤下腔静脉与肝静脉,有利于肝实质的切开与止血(图1A),可以提高手术的安全性。然而,Ettorre等[12]对临床上17例肝移植患者研究发现,35%(6/17)的患者在所谓无血管隧道上有肝短静脉分布,并且约1/3肝短静脉的直径粗3~6 mm,尤其对无血管区最狭窄点宽度仅2 mm的病例而言,无疑会增加盲目分离时出血的风险,文献上也不乏应用LHM失败或引起出血的报告[6,13-15]。况且肿瘤浸润下腔静脉是LHM绝对禁忌证,而右肝巨大肿瘤对下腔静脉的推挤、压迫致其受压移位或其与下腔静脉前壁粘连则无疑增加操作的风险,限制了该技术的应用。尽管有研究者做了某些技术改进或应用术中超声、胆道镜辅助引导以减少出血风险[16-18],但在右肝巨大肿瘤手术时,由于术区空间狭小,势必影响操作,难以完全避免肝短静脉与下腔静脉损伤。有必要进一步探索或改进LHM技术,以提高肝右叶巨大肿瘤切除的安全性。
(二)TBLHM技术的解剖学与相关理论依据
TBLHM技术实际上是在既往(顺行或后入路)规则性右半肝切除术的基础上,对LHM技术进一步拓展,也是对LHM技术的补充与发展。主要的操作步骤是在解剖第一肝门并阻断右半肝入肝血流后、充分游离右侧肝周韧带亦即完全显露肝脏裸区,处理(或留到肝实质切离过程处理)肝短静脉和(或)肝右静脉使下腔静脉右前壁(或右缘)完全显露,然后经裸区于下腔静脉右前壁(或右缘)置肝脏悬吊带,最后沿预定切除线切开肝实质,完成右半肝切除(图1B)。此时多可使原本受肿瘤压迫、推挤的下腔静脉恢复直行,在其右前壁或右缘与右肝之间形成了一无血管 “沟状隧道” (图2B)。直视下沿下腔静脉缘“沟状隧道”放置悬吊带,依此为指引沿预定切除线进行肝实质的切离,完成右半肝的切除手术。该操作技术避免了LHM盲目穿插腔静脉无血管区可能导致肝短静脉损伤从而引起出血的风险; 此外腔静脉旁TBLHM技术还可通过牵引悬吊带将肝右静脉以及未处理的肝短静脉、右肝下静脉提起, 不但可以减少深部肝实质切离过程中来自肝静脉的断面出血, 上述静脉断端也可在断面从容处理, 变得简单、容易、确切, 符合目前精准肝脏外科的理念[19]。

A.LHM经肝后下腔静脉前壁无血管区自下到上置悬吊带;B.TBLHM经肝裸区紧贴下腔静脉右缘放置悬吊带;RHV:肝右静脉;IRHV:肝右下静脉;MHV:肝中静脉;LHV:肝左静脉图1 LHA与TBLHM示意图
二、TBLHM的操作方法
(一)术前评估
并无特殊之处。对肝脏巨大肿瘤拟行右半肝切除的患者需常规行一般状况、肝脏功能以及肝肿瘤状况的全面评估,其中影像学评估是制定手术方案、决定手术入路、了解手术难度最为重要的依据。对拟采用TBLHM的患者均应该行肝脏螺旋CT与MRCP检查,如能行肝脏血管构建与肝脏体积测定则更好,详细了解肿瘤与周围血管的关系、有无血管浸润、血管变异情况,以及残肝体积等。如果恶性肿瘤侵犯下腔静脉或肝右静脉形成癌栓,则提示术中需做全肝血流阻断的准备。MRCP检查则对了解胆管走行与变异及其与肿瘤的关系,防止术中胆管损伤有重要意义。
(二)手术操作步骤
TBLHM是右半肝切除术的一个辅助性技术环节,并没有改变右肝切除的基本技术流程。
1.一般采用右肋缘下切口,完成腹腔与肝脏肿瘤状况探查后,上多功能拉钩。
2.先切除胆囊。继之解剖右侧肝门,切开右侧肝门的Glisson鞘,可触及肝右动脉的搏动,予以分离后结扎、切断。然后紧贴门静脉壁分离门静脉右支,上牵引带后予以上钳,切断,断端用4-0 Prolene线连续缝闭。此时肝脏表面可出现一条明显的缺血分界线(图3)。右肝管则留到切肝过程中在肝断面处理。
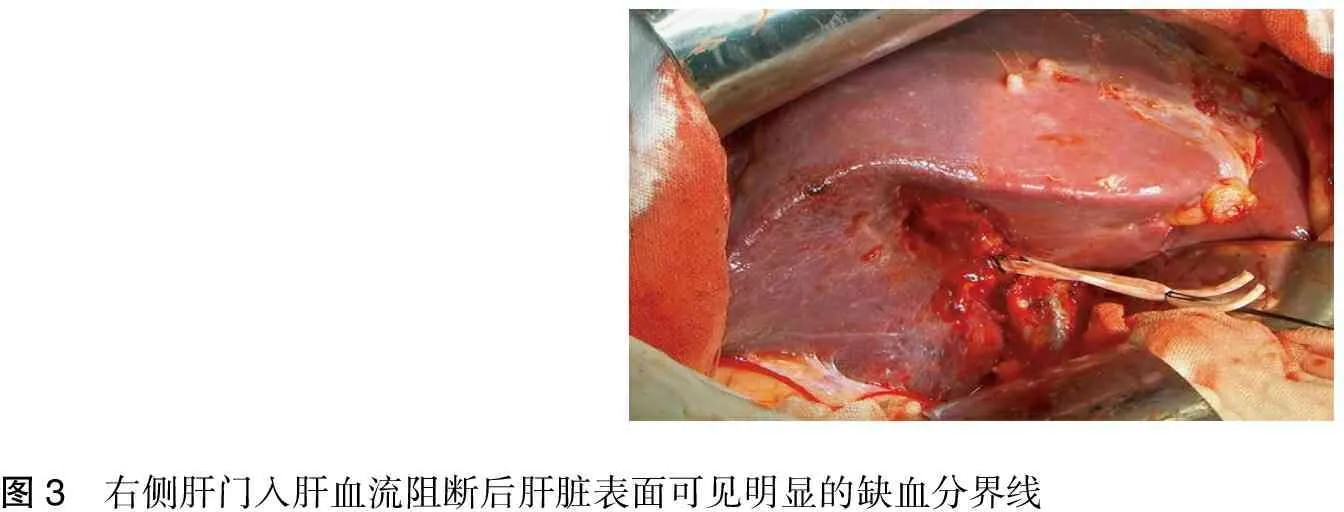
图3 右侧肝门入肝血流阻断后肝脏表面可见明显的缺血分界线
3.游离肝周韧带,用电刀紧贴肝脏表面切离肝冠状韧带、右三角韧带、肝肾韧带、肝结肠韧带,助手轻轻将右肝掀起,钝锐结合游离肝脏裸区。右肾上腺常与右肝有较为紧密的粘连,应在直视下,小心分离,如有出血,予以缝合止血。下腔静脉韧带,则多需上钳后切断,断端予以缝合,以防出血。自下到上尽可能显露下腔静脉右侧缘。
4.将右肝恢复原位,电刀小心剥离肝右静脉、肝中静脉与下腔静脉前壁之间的间隙,显露肝右静脉根部。再将肝脏轻轻向左上掀起,自下之上处理肝短静脉,将汇入下腔静脉右侧壁的肝短静脉依次切断,腔静脉侧断端用5-0 Prolene线缝扎止血。充分游离肝右静脉根部,紧贴静脉壁自下至上小心分离腔静脉前间隙,使之与原先自上而下分离的间隙相通,于肝右静脉根部上牵引带。在肝外上钳切断肝右静脉,4-0或5-0 Prolene线连续缝合残端。如肝外处理肝右静脉存在困难,则可留到切离肝实质时,在肝断面处理。此时肝脏游离结束。
5.直视下沿下腔静脉壁与肝脏间的“沟状隧道”放置悬吊带,我们常用12号导尿管(图4)。将肝脏完全复位,悬吊带两端则用钳子把持,以防误拔。
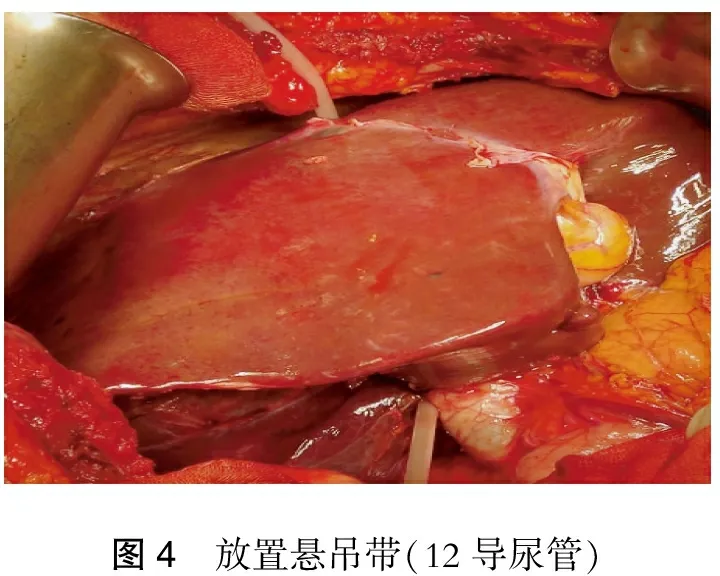
图4 放置悬吊带(12导尿管)
6. 在肝表面沿预定切割线做标记,切开肝实质。我们多采用高频电刀的电凝模式切肝,所遇条索状管道组织尽可能予以结扎后切断。当切至深部肝实质时,助手将悬吊带两端轻轻提起,在重力作用下,肝右叶向外侧翻开,使得切面敞开、术野变浅,悬吊带对肝组织的压迫作用可减少断面出血。在肝断面上结扎切断右肝管,断端尽可能留长,以防损伤肝门胆管。以悬吊带为目标,当切至下腔静脉附近肝实质时,术者左手将肝断面向外侧稍用力分开,第一助手提拉悬吊带的下端,另一助手提拉上端,稍向左内用力,术者自下而上沿悬吊带的外侧(右侧)切离肝组织,完成右肝的切除。
7.断面止血,放置引流关腹。
(三)术中需注意的问题
1.手术切口应该足够大,如肿瘤太大,尤其是特大血管瘤最大直径可以在20 cm以上,单纯右肋缘下切口术野显得狭小,影响操作,此时可考虑采用双肋缘下“人”字切口。
2.游离肝脏前,必须先行解剖肝门,阻断右肝入肝血流。阻断右半肝入肝血流后,可以降低肿瘤内压,可望减少或避免在游离肝脏时压迫肿瘤引起肿瘤破裂或癌细胞扩散的风险;当然,血管瘤等良性肿瘤并不存在肿瘤扩散的问题,但血流阻断后可以使瘤体张力下降、萎陷变小,包膜不易撕裂,并可扩大操作空间,便于下一步肝脏的游离。右肝管由于位置高,常受肿瘤推挤压迫影响,不易解剖,勉强分离容易损伤左右肝管分叉部,因此留到肝断面切开后再处理较为安全、简单。肝门解剖对一位训练有素的肝胆外科医生来说,不存在什么困难,关键是需要术前认真阅读影像学资料,了解肝门血管的走行,并随时与术中所见进行比较,以防误伤。
3.肝脏周围韧带切离以及分离肝裸区时,应遵循“先易后难、从前到后、由浅入深、上下结合、紧贴肝脏、稳步推进”的原则,亦即没有固定的先后顺序,以方便手术操作、减少对肝脏不必要的挤压为最高准则。
4.是否需要分离肝短静脉取决于肿瘤的位置及其与下腔静脉的关系。如果肿瘤离下腔静脉有一定距离,预定肝切面可以将其避开,则毋需游离下腔静脉右前壁的肝短静脉,将悬吊带沿下腔静脉右侧壁缘放置牵拉即可,此时肝切除后尾状叶腔静脉旁部与部分尾状突部肝组织可得以保留。
5.肝右静脉、肝短静脉、肝右下静脉等是否需要在肝外处理,则需要根据具体情况决定。由于肿瘤巨大,位置深在,术野狭小,不易显露,或肿瘤压迫肝右静脉根部,处理较为困难,尤其在分离其内侧壁上牵引带时,存在一定的盲目性,因此为安全起见,可留到肝内处理亦即在肝实质切离即将完成时最后处理。此时提拉肝悬吊带,不但可以阻断来自肝右静脉等的出血[10,20],也可使上述肝静脉拉长,便于上钳切断,此乃Belghiti提倡的LHM难以达到的效果(图5)。
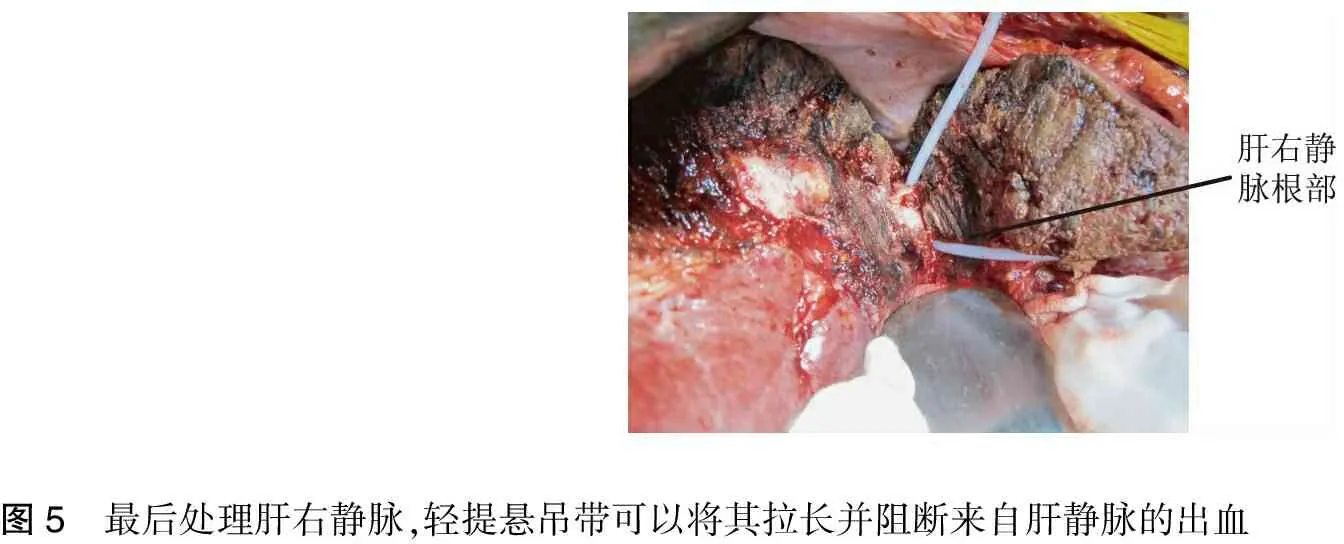
图5 最后处理肝右静脉,轻提悬吊带可以将其拉长并阻断来自肝静脉的出血
6.如果肝右静脉或肝右下静脉甚至下腔静脉存在癌栓,则需要备用全肝血流阻断技术。尤其是对经肝右静脉伸入下腔静脉的癌栓患者,需要在全肝血流阻断的前提下切开腔静脉取栓。此时可以将悬吊带上端经过肝右、肝中静脉与下腔静脉前壁的间隙引出(亦即类似LHM),引导肝实质的切离。最后,阻断全肝血流,切开腔静脉取栓。部分经肝右下静脉或肝短静脉侵入下腔静脉的癌栓,则多可在适当分离腔静脉前壁后,应用小儿心耳钳将静脉壁连同癌栓夹闭,再予以切开取出,不影响悬吊带的放置与操作。肝短静脉的保留断端均应缝扎,5 mm以上的断端应连续缝合闭锁。
7.肝实质的切离应耐心仔细,浅部切开时,没有必要牵拉悬吊带。当切至深部肝组织时,牵拉悬吊带断面才有止血效果。牵拉时用力须适中,理想的状态是,既有止血效果,又可导引切肝目标,以避免切肝过程中反复翻转肝脏。最后切离腔静脉旁肝组织时,必须沿悬吊带外侧或正中切离,切不可在其内侧操作,主要目的是避免损伤下腔静脉,亦有利于肝短静脉的处理。
三、评价
肝脏悬吊带技术(包括 LHM与TBLHM)是肝胆外科专家临床实践过程中智慧的结晶,已成为右半肝切除甚至左半肝切除的较为常用的辅助技术。笔者体为LHM在右肝恶性肿瘤尤其是在下腔静脉走行未受肿瘤影响如肿瘤位于右肝浅面,尤其是侵犯膈肌的巨大恶性肿瘤患者的右半肝切除术,有较高的应用价值[5]。此外活体肝移植供体的右半肝切除,由于下腔静脉解剖结构完全正常,LHM操作相对容易,且对移植物血流动力学影响较少,可以考虑应用LHM[21-23]。而巨大良性肿瘤,因其不存在术中挤压致肿瘤扩散的问题,故应首选TBLHM。而不管良性、恶性肿瘤,如其压迫或侵犯下腔静脉,或LHM失败者均可行TBLHM(图6)。TBLHM技术较LHM技术更为安全、实用,应成为解剖性右半肝切除的常规步骤。至于恶性肿瘤在游离肝脏过程中对肿瘤的挤压导致肿瘤播散的疑虑可否通过肝门血管的预先处理,以及轻柔、有序的操作予以消除,还有待更多的研究。
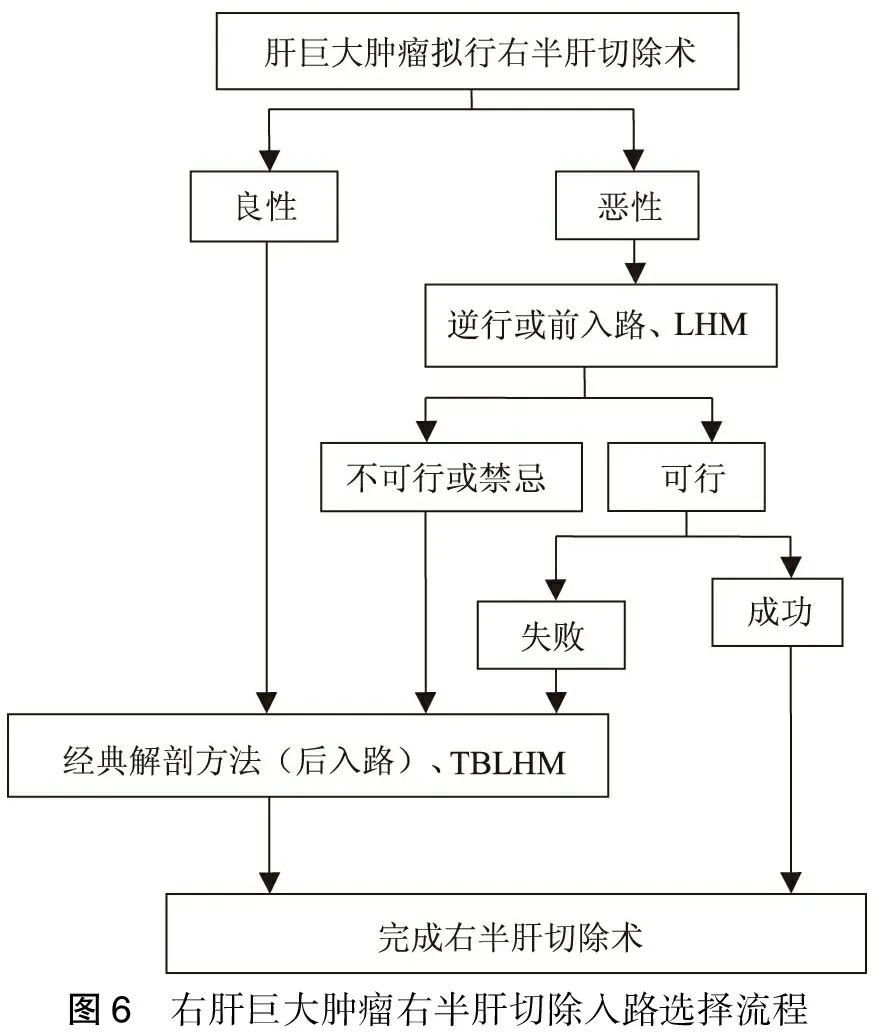
图6 右肝巨大肿瘤右半肝切除入路选择流程
1 王成恩.发性肝癌的外科治疗.中华外科杂志,1961,9:627-629.
2 陈孝平,编著.肝切除术.武汉:湖北科学技术出版社,1992.131-134.
3 Lai EC,Fan ST,Lo CM,et al. Anterior approach for difficult major right hepatectomy.World J Surg,1996,20:314-317.
4 Belghiti J,Guevara OA,Noun R,et al.Liver hanging maneuver:a safe approach to right hepatectomy without liver mobilization.J Am Coll Surg,2001,193:109-111.
5 Wang CC,Jawade K,Yap AQ,et al.Resection of large hepatocellular carcinoma using the combination of liver hanging maneuver and anterior approach. World J Surg,2010,34:1874-1878.
6 Utsunomiya T,Shimada M.Modified hanging method for liver resection. J Hepatobiliary Pancreat Sci,2012,19:19-24.
7 Endo I,Matsuyama R,Taniguchi K,et al.Right hepatectomy with resection of caudate lobe and extrahepatic bile duct for hilar cholangiocarcinoma.J Hepatobiliary Pancreat Sci,2012,19:216-224.
8 Yang JH,Gu J,Dong P,et al.Isolated complete caudate lobectomy for hepatic tumor of the anterior transhepatic approach:surgical approaches and perioperative outcomes.World J Surg Oncol,2013,11:197.
9 Mochizuki K,Eguchi S,Hirose R,et al.Hemi-hepatectomy in pediatric patients using two-surgeon technique and a liver hanging maneuver.World J Gastroenterol,2011,17:1354-1357.
10Chen XP,Zhang WG,Lau WY MD,et al. Right hepatectomy using the liver double-hanging maneuver through the retrohepatic avascular tunnel on the right of the inferior vena cava.Surgery, 2008,144:830-833.
11Trotovsek B,Gadzijev EM,Ravnik D,et al.Liver hanging maneuver for right hemiliver in situ donation-anatomical considerations. HPB(Oxford),2006,8:35-37.
12Ettorre GM,Douard R,Corazza V,et al.Anatomical basis of liver hanging maneuver:a clinical and anatomical in vivo study.Am J Surg,2007,73:1193-1196.
13Ogata S,Belghiti J,Varma D,et al.Two hundred liver hanging maneuvers for major hepatectomy a single-center experience.Ann Surg,2007,245:31-35.
14Meng WC,Shao CX,Mak KL,et al.Anatomical justification of Belghiti's _liver hanging manoeuvre_in right hepatectomy with anterior approach. ANZ J Surg,2003,73:407-409.
15Aydin UYP,Zeytunlu M,Zeytunlu M,et al.Bimanual _bifinger liver hanging maneuver: an alternative and safe technique for liver hanging.HPB 2007,9:195-198.
16Suzuki M,Unno M,Katayose Y,et al.Hepatic resection through an anterior approach employing a modified liver hanging maneuver inpatients with a massive liver tumor severely oppressing the inferior vena cava.Hepatogastroenterology,2004,51:1459-1463.
17Kokudo N,Imamura H,Sano K,et al.Ultrasonically assisted retro-hepatic dissection for a liver hanging maneuver.Ann Surg,2005,242:651-654.
18Lai PB,Wong J,Ng WW,et al.Safe modification of the liver-hanging maneuver by endoscopic-assisted dissection of the retrohepatic tunnel.Surg Today,2007,37:915-917.
19Dong J,Yang S,Zeng J,et al.Precision in liver surgery. Semin Liver Dis,2013,33:189-203.
20陈孝平.大肝癌和巨大肝癌切除20年回顾.中华消化外科杂志,2009,8:88-90.
21Shindoh J,Aoki T,Hasegawa K,et al.Donor hepatectomy using hanging maneuvers:Tokyo University experiences in 300 donors. Hepatogastroenterology,2012,59:1939-1943.
22Lee KW. Hanging maneuver by Glisson's approach before parenchymal dissection in living donor right hepatectomy under the upper midline incision. World J Surg,2012,36:2746-2747.
23Rotellar F,Pardo F,Benito A,et al.Totally laparoscopic right-lobe hepatectomy for adult living donor liver transplantation: useful strategies to enhance safety. Am J Transplant,2013,13:3269-3273.