肝下下腔静脉阻断在肝切除术中控制出血的临床应用
2014-02-27隋承军杨甲梅
隋承军 杨甲梅
肝切除术是治疗肝脏良、恶性肿瘤的主要方法之一,由于肝脏的血供非常丰富,术中大出血一直被认为是肝切除术中严重的并发症之一,更是决定预后的重要因素[1-2]。因此,在肝切除术中有效地控制出血一直是肝胆外科领域研究的热点。肝脏的血管系统比较复杂,有包括门静脉和肝动脉的流入道和肝静脉的流出道两套系统,即通常所说的第一肝门和第二肝门(第三肝门),因此对肝脏的血流控制就包括对流入道和流出道血流的控制[3]。控制流入道出血的方法有许多[4],目前国内最常用的是Pringle法[5],即阻断肝十二指肠韧带(第一肝门)内的门静脉和肝动脉的全部入肝血流,可采用常温下持续性阻断或间歇性阻断。在入肝血流阻断下,肝切除术中的出血主要来源于流出道的肝静脉系统,即肝静脉和肝短静脉的反流出血[6-7]。因此,学者们创立了许多控制流出道出血的方法,包括全肝血流阻断(total hepatic vascular exclusion, THVE)[8]、选择性全肝血流阻断(selective hepatic vascular exclusion,SHVE)[9-10]以及半肝血流完全阻断[11]等,但是这些方法都存在一定的弊端,且操作上具有一定的难度,只在特定的患者中被采用[12-13]。
1998年,Belghiti等[14]发现肝脏流出道的出血和中心静脉压(central venous pressure,CVP)密切相关,降低CVP可以减少切肝过程中的出血。之后,又有许多学者报道了降低CVP可以减少肝切除术中肝静脉系统的出血[15-17]。CVP的降低可以通过麻醉干预来实现,包括限制液体的入量,应用利尿剂,联合应用血管舒张剂(如硝酸甘油)[18],吗啡[19],以及减少呼吸机的潮气量[20]等。但是通过药物干预增加了麻醉管理的复杂性,并且有时很难调整和逆转。限制液体量会引起血流动力学的不稳定,尤其是在术中出现快速严重出血的病例,不但可能会影响组织的供氧,还可能损害诸如肾脏等器官的功能[21]。
近年来,应用第一肝门入肝血流阻断联合肝下下腔静脉(inferior vena cava, IVC)阻断以减少肝切除术中流出道的出血报道较多。肝下IVC阻断法提供了一种不需要限制全身液体量的降低CVP的方法,避免了麻醉干预的副作用,而且操作简便,效果显著,十分便于推广应用。
一、技术方法
肝下IVC阻断操作十分便捷,进入腹腔探查后,在完成肝脏游离或者是前入路法不游离肝脏的情况下,先放置第一肝门的阻断带,进行肝脏离断前,再于肝9段下方显露肝下IVC右侧壁,于右肾静脉开口上方切开覆盖于肝下IVC表面的腹膜,用血管钳钝性分离IVC右侧壁和后壁的疏松组织,然后带过一线带环绕IVC,用乳胶管收紧线即可阻断肝下IVC (图1)。
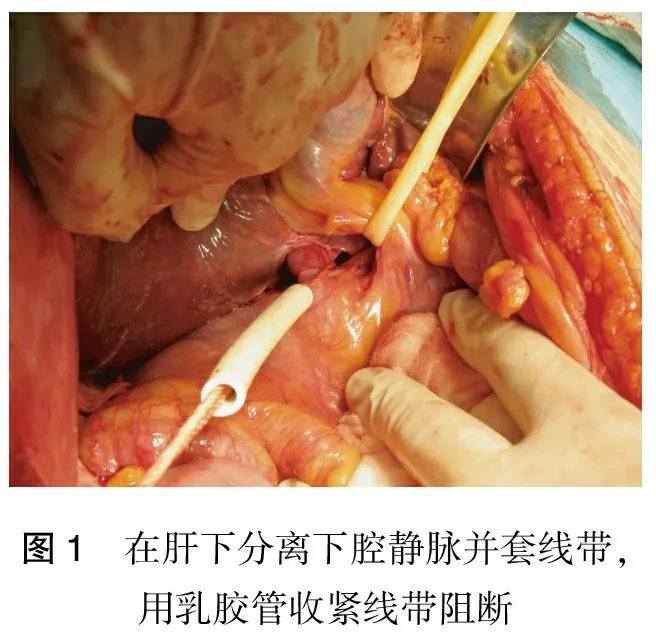
图1 在肝下分离下腔静脉并套线带,用乳胶管收紧线带阻断
二、应用现状
1990年,陈孝平等[22]首先介绍了肝尾叶(I段)切除术中采用阻断第一肝门和肝下IVC的方法控制出血,术中未发现血流动力学改变。2004年,Otsubo等[23]报道了阻断肝下IVC可有效减少肝切除术中的出血。该文回顾研究103例行左半肝或右半肝切除的病例,证实在CVP>5 cmH2O的患者中,肝下IVC阻断能明显降低CVP及减少术中出血。肝下IVC阻断前后CVP分别为(10.6±2.6) cmH2O和(6.9±2.4) cmH2O,阻断后CVP下降了3.7 cmH2O,下降明显(P<0.01)。肝下IVC阻断组的术中总出血量为(910±454) ml,未阻断组为(1 177±462) ml,前者明显低于后者(P=0.008)。在阻断前CVP>10 cmH2O的亚组患者中,肝下IVC阻断组的输血率明显低于对照组(P=0.03)。
随后,陈孝平等[24]于2006年进行了一项前瞻性的随机对照研究(RCT),在合并肝硬化的肝癌患者的中肝叶切除术中,一组采用第一肝门阻断联合肝下IVC阻断,对照组仅采用第一肝门阻断。结果显示,第一肝门联合肝下IVC阻断组和对照组的术中总出血量分别为(420±250) ml和(770±320) ml(P=0.009),断肝时的出血量分别为(350±110) ml和(680±280) ml(P=0.006),输血患者比例分别为13.3%和46.5%(P=0.041),前者均明显低于后者。说明即使是合并肝硬化的肝切除术,采用联合肝下IVC阻断也可获得良好的临床效果。
在Rahbari等[25]的另一项RCT研究中,152例患者随机分为肝下IVC阻断组和麻醉干预降低CVP组,结果显示两种方法均可显著降低术中CVP,肝下IVC阻断组和麻醉干预组的术中总出血量分别为550 ml(350~1 150 ml)和900 ml(500~1 500 ml)(P=0.02),断肝过程中的出血量分别为150 ml(85~500 ml)和400 ml(200~700 ml)(P=0.006),肝下IVC阻断组均明显低于麻醉法降低CVP组,提示肝下IVC阻断比麻醉干预降低CVP更能有效地减少肝切除术中出血。
Zhu等[26]进一步对肝下IVC阻断法和麻醉法降低CVP对术中出血量的影响进行了RCT研究,结果显示肝下IVC阻断组与麻醉法降低CVP组的术中总出血量分别为(315±192) ml和(439±229) ml(P<0.001),断肝过程中的出血量分别为(243±158) ml和(372±197) ml(P<0.001),断肝时单位面积的出血量分别为3.0 ml/cm2和5.5 ml/cm2(P<0.001),前者均明显低于后者。在合并肝硬化的患者中,前者在断肝过程中能更明显地减少出血,单位面积的出血量分别为(2.9±1.8) ml/cm2和(6.1±2.4) ml/cm2(P<0.001)。提示在合并肝硬化的肝切除术中,第一肝门阻断联合肝下IVC阻断可能有更明显的减少断肝时出血的效果。
Uchiyama等[27]的研究结果也证实在肝切除术中,第一肝门阻断联合肝下IVC阻断组和单纯第一肝门阻断组的术中出血量分别为(932±692) ml和(1 380±870) ml(P=0.025),输血率分别为20%和45%(P=0.049),前者均明显低于后者。
刘景丰等[28]回顾分析了在直径大于10 cm的巨大肝癌肝切除术中的出血量,显示Pringle法联合肝下IVC阻断组的出血明显低于单纯行Pringle组,两组的出血分别为(420±170) ml和(670±180) ml(P<0.01)。
笔者最近也进行了肝下IVC阻断法肝切除术的对照研究[29]。本组共91例肝切除患者,分为Pringle法联合肝下IVC阻断组43例,单纯Pringle法组48例,结果显示术中总出血量两组分别为(312.8±267.3) ml和(471.0±317.8) ml,断肝过程中的出血量分别为(80.7±79.8) ml和(200.2±165.1) ml,前者均明显少于后者(P<0.05)。
笔者还针对位于第二肝门的肿瘤肝切除术中两种阻断方法的应用进行了对照研究[30],结果显示应用Pringle法联合肝下IVC阻断组患者的术中出血量为(477.3±340.3) ml,而单纯Pringle法患者的术中出血量为(794.5±602.7) ml,前者出血量明显少于后者,差异有统计学意义(P=0.001);两组输血比例分别为8.3%和22.6%,前者明显少于后者(P=0.034);尤其还发现术后并发症的发生率前者也明显降低,分别为40.0%和60.4%(P=0.031);术后住院时间两组分别为(10.7±2.2) d和(12.9±4.8) d(P=0.008),Pringle法联合肝下IVC阻断组的术后住院时间也明显缩短。
尽管目前大多数的文献均报道肝下IVC阻断能有效地减少肝切除术中的出血,但也有研究发现两者无显著差异。Kato等[31]报道第一肝门阻断联合肝下IVC阻断与单纯第一肝门阻断进行RCT研究,结果显示两组术中总出血量分别为499 ml(60~1 254 ml)和584 ml(28~2 226 ml)(P=0.567),断肝过程中出血量分别为233 ml(40~875 ml)和285 ml(8~1 397 ml)(P=0.474),断肝时单位面积出血量分别为4.9 ml/cm2(1.1~14.9 ml/cm2)和6.6 ml/cm2(0.3~14 ml/cm2)(P=0.63),三者差异均无统计学意义。这可能与患者均采用超声刀离断肝实质,再处理血管有关。
然而,多数学者认为肝下IVC阻断后CVP降低,可直接导致肝血窦的压力下降,故CVP的降低应该能显著减少常用离断肝组织方法的切肝过程中的出血[6,15]。而且保持低CVP可以避免IVC膨胀,使得游离肝脏以及解剖肝静脉和肝短静脉更加容易。近年来有许多研究结果均显示CVP[7,17,32-33]或者肝后IVC的压力[34]和术中出血密切相关,但是仍存争议。如Rahbari等[25]报道,尽管肝下IVC阻断组的术中总出血量及断肝时的出血量均明显少于麻醉法降低CVP组,但是肝下IVC阻断组在切肝过程中的CVP却反高于麻醉法组。经多因素分析发现, CVP与术中出血没有明确关系。陈孝平等[24]的RCT研究中肝下IVC阻断组与未阻断组的CVP差异无统计学意义,但前者的术中总出血量、断肝时的出血量以及输血患者比例均明显低于后者。活体肝移植供体肝切除术中的研究也同样显示,CVP和术中出血量无明显相关性[35-36]。这些研究结果均对用CVP作为衡量肝静脉压的指标提出了挑战。因此,肝下IVC阻断对于术中出血的影响可能并不单纯是通过降低CVP起作用,而可能是肝下IVC阻断比麻醉干预能更有效降低肝静脉的压力有关。笔者推测可能的原因是麻醉法降低CVP是通过限制液体量以及应用血管活性药物,导致较长时间的全身各器官灌注不足,可能导致肝血窦内的血液淤滞,因而断肝过程中仍有相对较多的出血;而肝下IVC阻断后,源于双肾和下肢的回心血量减少,心脏代偿性的增加做功,阻断处以上部位的血液回流加速,肝血窦内的血液回流入心脏,从而减少了断肝时创面的出血。而且有学者发现[23],肝上、肝下IVC同时阻断(THVE)时,术中肝脏切面仍常发生较多出血,当解除肝上IVC的阻断而仅保留肝下IVC的阻断时,切面的出血反而减少,故认为其原因可能是THVE同时阻断了肾上腺静脉和膈静脉的回流从而导致肝脏创面出血较多。笔者认为,除上述可能的原因外,肝上IVC阻断使肝静脉回流受阻,切肝过程中原本肝血窦内淤滞的血液无法回流,也是导致肝创面出血的原因之一,而单独阻断肝下IVC,使CVP降低后,切肝过程中肝血窦中的血液可以继续经过肝静脉回流,减少了肝创面的出血。
尽管肝下IVC阻断减少肝切除术中出血的结论尚存争议,但多数临床研究结果显示肝下IVC阻断可明显减少断肝时肝创面的出血,其临床应用价值和机制值得进一步研究。
三、注意事项
肝下IVC阻断以后,由于回心血量减少,部分患者可能出现动脉血压下降,心率加快,不过大多无需特殊处理,少数动脉压下降明显的患者可临时应用升压药物以保证离断肝组织过程中的心、脑血管血液供应。Otsubo等[23]报道,肝下IVC阻断后先观察患者的耐受情况,如出现血压下降,收缩压低于80 mmHg,则稍放松阻断带,采用不完全阻断,即可使收缩压维持在80 mmHg以上,采用该方法,所有患者均能耐受阻断,阻断过程中血压、心率均可较稳定。陈孝平等[24]报道,肝下IVC阻断后平均动脉压(MAP)及心率均较稳定,与单纯第一肝门阻断的对照组比较差异无统计学意义。Uchiyama等[27]的报道也发现肝下IVC阻断对术中动脉压无明显影响,阻断前后患者动脉血气分析结果无明显差异。在笔者的研究中,肝下IVC阻断后仅2例患者心率明显加快,动脉压下降,但临时应用升压药物后很快好转,均能耐受阻断[28]。在与麻醉法降低CVP的比较中,Rahbari等[25]报道肝下IVC阻断组的术中MAP及心率与麻醉法组比较差异均无统计学意义,而两组患者术中血流动力学不稳定的发生率分别为0和6.3%,肝下IVC阻断组术中血流动力学不稳定的发生率要显著低于麻醉法组(P=0.04)。Zhu等[26]的报道也显示,肝下IVC阻断组术中全身血流动力学的变化相对于麻醉法降低CVP组更小,麻醉法组的MAP下降程度及心率增加程度均更明显。
在肝切除术中,空气可由肝静脉的破口被吸入右心房发生肺的空气栓塞,可能导致患者术中骤死。尤其是在CVP较低时,发生空气栓塞的风险更大,术中需特别注意防止气栓的发生,所以在离断肝实质时尽可能避免损伤肝静脉主干,一旦发生损伤,应及时堵住破口,进行修补。有学者认为,在断肝时采用Trendelenberg体位,即头低15°体位,可防止空气栓塞的发生[37]。
四、适应证
根据笔者的研究结果,在肝切除术中,Pringle法联合肝下IVC阻断不仅可以减少术中的出血量,而且术后并发症的发生率、术后住院时间均显著少于单纯Pringle法组。因此,可以认为第一肝门入肝血流阻断联合肝下IVC阻断应用在肝切除术中是一种安全、有效的方法,其对全身的血流动力学几无影响,对肾功能无明显损害,不增加并发症的发生率,甚至可能使肝功能恢复更快,还可能缩短住院时间。笔者认为,第一肝门入肝血流阻断联合肝下IVC阻断可推广应用于较复杂的肝切除术,如左、右半肝切除,中肝叶切除,尾状叶切除,以及包含有Ⅶ段或Ⅷ段肝切除在内的肝切除术,以减少术中肝静脉出血的风险,尤其是对于术前CVP较高的患者更加适用。
1 Katz SC,Shia J,Liau KH,et al.Operative blood loss independently predicts recurrence and survival after resection of hepatocellular carcinoma.Ann Surg,2009,249:617-623.
2 de Boer MT,Molenaar IQ,Porte RJ.Impact of blood loss on outcome after liver resection.Dig Surg,2007,24:259-264.
3 Hoekstra LT,van Trigt JD,Reiniers MJ,et al.Vascular occlusion or not during liver resection: the continuing story.Dig Surg,2012, 29:35-42.
4 刘允怡,赖俊雄,刘晓欣.肝血流阻断技术在肝切除中的应用.中国实用外科杂志,2010,3:625-626.
5 Pringle JH.V.Notes on the arrest of hepatic hemorrhage due to trauma.Ann Surg,1908,48:541-549.
6 Otsubo T.Control of the inflow and outflow system during liver resection.J Hepatobiliary Pancreat Sci,2012,19:15-18.
7 Wang WD,Liang LJ,Huang XQ,et al.Low central venous pressure reduces blood loss in hepatectomy.World J Gastroenterol,2006,12:935-939.
8 Belghiti J,Noun R,Zante E,et al.Portal triad clamping or hepatic vascular exclusion for major liver resection.A controlled study.Ann Surg,1996,224:155-161.
9 Fu SY,Lai EC,Li AJ,et al.Liver resection with selective hepatic vascular exclusion: a cohort study.Ann Surg,2009,249:624-627.
10Cherqui D,Malassagne B,Colau PI,et al.Hepatic vascular exclusion with preservation of the caval flow for liver resections.Ann Surg,1999,230:24-30.
11隋承军,陆炯炯,徐峰,等.半肝血流完全阻断法在肝功能受损的肝细胞癌患者肝切除术中的应用.中华外科杂志,2013,51:331-334.
12De Cosmo GA,Adducci E,Gualtieri EM.Haemodynamic and metabolic changes during major liver resection with use of hepatic total vascular exclusion.Int Surg,2000,85:243-247.
13Smyrniotis VE,Kostopanagiotou GG,Kontis JC,et al.Selective hepatic vascular exclusion versus Pringle maneuver in major liver resections: a prospective study.World J Surg,2003,27:765-769.
14Belghiti J,Marty J,Farges O.Techniques, hemodynamic monitoring, and indications for vascular clamping during liver resections.J Hepatobiliary Pancreat Surg,1998,5:69-76.
15Chen H,Merchant NB,Didolkar MS.Hepatic resection using intermittent vascular inflow occlusion and low central venous pressure anesthesia improves morbidity and mortality.J Gastrointest Surg,2000,4:162-167.
16Poon RT,Fan ST,Lo CM,et al.Improving perioperative outcome expands the role of hepatectomy in management of benign and malignant hepatobiliary diseases:analysis of 1222 consecutive patients from a prospective database.Ann Surg,2004,240:698-710.
17Eid EA,Sheta SA,Mansour E.Low central venous pressure anesthesia in major hepatic resection.Middle East J Anesthesiol, 2005,18:367-377.
18Rees M,Plant G,Wells J,et al.One hundred and fifty hepatic resections: evolution of technique towards bloodless surgery.Br J Surg,1996,83:1526-1529.
19Grossman M,Aboise A,Tangphao O,et al.Morphine induced venodilation in humans.Clin Pharmacol Ther,1996,60:554-560.
20Hasegawa K,Takayama T, Orii R, et al. Effect of hypoventilation on bleeding during hepatic resection.Arch Surg,2002,137:311-315.
21Sear JW.Kidney dysfunction in the postoperative period.Br J Anaesth,2005,95:20-32.
22陈孝平,吴在德,覃修福,等.肝段切除术120例.中华外科杂志 1990,28:599-601.
23Otsubo T,Takasaki K,Yamamoto M,et al.Bleeding during hepatectomy can be reduced by clamping the inferior vena cava below the liver.Surgery,2004,135:67-73.
24Chen XP,Zhang ZW,Zhang BX,et al.Modified technique of hepatic vascular exclusion:effect on blood loss during complex mesohepatectomy in hepatocellular carcinoma patients with cirrhosis.Langenbecks Arch Surg,2006,391:209-215.
25Rahbari NN,Koch M,Zimmermann JB,et al.Infrahepatic inferior vena cava clamping for reduction of central venous pressure and blood loss during hepatic resection:a randomized controlled trial.Ann Surg,2011,253:1102-1110.
26Zhu P,Lau WY,Chen YF,et al.Randomized clinical trial comparing infrahepatic inferior vena cava clamping with low central venous pressure in complex liver resections involving the Pringle manoeuvre.Br J Surg,2012,99:781-788.
27Uchiyama K,Ueno M,Ozawa S,et al.Half clamping of the infrahepatic inferior vena cava reduces bleeding during a hepatectomy by decreasing the central venous pressure. Langenbecks Arch Surg,2009,394:243-247.
28刘景丰,池闽辉,曾金华.肝血流阻断方法对肝切除术中大出血的影响.中华外科杂志,2010,48:177-180.
29隋承军,沈伟峰,陆炯炯,等.肝下下腔静脉阻断联合入肝血流阻断在复杂肝切除术中的应用.中国实用外科杂志,2012,32:771-774.
30Yang J,Sui C,Kan T,et al.Infrahepatic inferior vena cava clamping in hepatectomy for tumors involving hepatocaval confluence.Asian J Surg,2013,36:111-115.
31Kato M,Kubota K,Kita J,et al.Effect of infra-hepatic inferior vena cava clamping on bleeding during hepatic dissection: a prospective, randomized,controlled study.World J Surg,2008,32:1082-1087.
32Smyrniotis V,Kostopanagiotou G,Theodoraki K,et al.The role of central venous pressure and type of vascular control in blood loss during major liver resections. Am J Surg,2004,187:398-402.
33Feng ZY,Xu X,Zhu SM,et al.Effects of low central venous pressure during preanhepatic phase on blood loss and liver and renal function in liver transplantation.World J Surg,2010,34:1864-1873.
34Johnson M,Mannar R,Wu AV.Correlation between blood loss and inferior vena caval pressure during liver resection.Br J Surg,1998,85:188-190.
35Chhibber A,Dziak J,Kolano J,et al.Anesthesia care for adult live donor hepatectomy:our experiences with 100 cases.Liver Transpl,2007,13:537-542.
36Kim YK,Chin JH,Kang SJ,et al.Association between central venous pressure and blood loss during hepatic resection in 984 living donors. Acta Anaesthesiol Scand,2009,53:601-606.
37Donovan AJ,Berne TV.Liver and bile duct injury.In:Blumgart LH,editor.Surgery of the liver and biliary tract.2nd ed. Edinburgh: Churchill Livingstone,1994.1227.