响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析
2014-02-27李亚辉马艳弘黄开红赵延存张宏志王光祠
李亚辉,马艳弘,*,黄开红,赵延存,张宏志,王光祠
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.徐州华瑞芦荟制品有限公司,江苏 徐州 221700)
响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析
李亚辉1,马艳弘1,*,黄开红1,赵延存1,张宏志1,王光祠2
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.徐州华瑞芦荟制品有限公司,江苏 徐州 221700)
研究复合酶提取芦荟多糖的工艺,并测定其抗氧化性。在单因素试验的基础上,利用响应面法对复合酶提取芦荟多糖的条件进行了优化,通过测定芦荟多糖的总抗氧化能力、DPPH自由基和羟自由基清除能力研究其抗氧化性。结果显示,当料液比1∶30(g/mL)、果胶酶与纤维素酶配比1∶3、pH 4.5时,优化最佳提取条件为加酶量0.3%、酶解温度48 ℃、酶解时间40 min,此条件下芦荟多糖的提取率为5.65%,和超声波辅助法相比提取率提高了4.2%。芦荟多糖具有较好的抗氧化性,随着质量浓度的增加,其总抗氧化能力、DPPH自由基和羟自由基清除能力逐渐增强,在25 mg/mL时其DPPH自由基和羟自由基清除率分别达到75%和90%。复合酶法是一种新的、有效的芦荟多糖提取方法;芦荟多糖具有较好的抗氧化性。
复合酶法;芦荟多糖;响应面法;抗氧化性
芦荟为百合科芦荟属多年生常绿肉质草本植物,分布于热带和亚热带地区,目前已有品种600多种,是广泛应用的天然药用植物,其中库拉索芦荟、木立芦荟和中华芦荟等具有重要的食用价值和药用价值[1]。芦荟的化学成分较为复杂,主要包含蒽醌类物质、多糖类物质、氨基酸、有机酸、维生素、矿物质及微量元素等[2]。其中芦荟多糖是芦荟凝胶中的主要生物活性物质,具有免疫调节、抗菌、抗病毒、抗肿瘤、抗氧化、防衰老、防治艾滋病、防止糖尿病、提高免疫力等多种功效[3-8]。
芦荟中多糖是一种混合多糖,其含量、种
类、组成和结构具有较大差异,相对分子质量约在12 000~7 000 000之间[9-10]。这些多糖主要由葡萄糖、半乳糖、甘露糖和阿拉伯糖等通过β-1-4糖苷键连接而成,大多数芦荟多糖中都含有乙酰化的甘露糖结构[9]。目前,关于芦荟多糖的提取方法国内外已有较多报道,主要有热水浸提法、微波辅助法、超声波辅助法[11-15],超临界流体萃取法报道较少,但用酶法提取芦荟多糖尚未有报道。植物细胞壁中含有果胶和纤维素,果胶酶和纤维素酶可破坏植物细胞壁,提高细胞壁和细胞膜的通透性,加速细胞内溶物的溶出[16-21]。果胶酶和纤维素酶作用条件温和且容易控制,采用两者辅助提取植物细胞内有效成分会具有较好效果[22-24]。芦荟作为一种保健食品,目前对其多糖的功能性研究主要侧重于抗肿瘤、抗病毒、提高免疫力等方面,而对其抗氧化方面的报道还较少。因此,本研究利用果胶酶和纤维素酶提取芦荟多糖,通过响应面分析得到最佳提取工艺条件,并对其抗氧化性进行了初步研究。这对芦荟多糖的提取、加工、利用及功能性研究具有重要意义。
1 材料与方法
1.1 材料与试剂
库拉索芦荟由徐州华瑞芦荟制品有限公司提供。
羟自由基清除能力试剂盒 南京建成生物工程研究所;果胶酶 上海杰兔工贸有限公司;纤维素酶 无锡明辉国际贸易有限公司化工分公司;其他试剂均为市售分析纯。
1.2 仪器与设备
UV-3802H紫外-可见分光光度仪 上海尤尼柯仪器有限公司;R-120型旋转蒸发器 瑞士Büchi公司;LG10-2.4A高速离心机 北京医用离心机厂;DHG-9070电热鼓风干燥箱 上海齐欣科学仪器有限公司;HH-2数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 芦荟前处理
取新鲜芦荟叶洗净去刺,切成5 mm薄片,用鼓风干燥箱50 ℃烘干。将烘干的芦荟叶放入粉碎机粉碎,制成芦荟粉,置于棕色瓶内密封保存备用。
1.3.2 芦荟多糖的提取
1.3.2.1 复合酶法提取
将芦荟干粉按一定料液比加入到蒸馏水中,复水30 min,调节其pH值,加入一定量按一定比例混合的果胶酶和纤维素酶复合酶,在一定温度条件下水浴提取一定时间。将提取液真空抽滤,取滤液并真空旋转蒸发至体积约10 mL,然后加入5 倍体积的无水乙醇,混合均匀,置于4 ℃冰箱静置12 h,再将其在3 000 r/min转速下离心10 min,沉淀即为粗多糖。
1.3.2.2 超声波辅助提取
将芦荟干粉按料液比1∶30(g/mL)加入到蒸馏水中,复水30 min,然后在70 ℃条件下利用超声波(超声功率600 W、超声时间15 min)辅助进行提取,提取液按照1.3.2.1节中方法处理得粗多糖。
1.3.3 芦荟多糖提取率的测定
以葡萄糖溶液为标准溶液,绘制标准曲线所得回归方程为:C=0.997A-0.000 7,R2=0.998 5,式中:C为葡萄糖质量浓度/(mg/mL);A为吸光度。
采用苯酚-硫酸法测定多糖含量,通过测定样品的吸光度,带入标准曲线,可得多糖质量浓度,并计算多糖提取率。

1.3.4 单因素试验
按照1.3.2.1节所述复合酶法,分别研究了料液比、果胶酶与纤维素酶配比、pH值、加酶量、酶解温度和酶解时间对芦荟多糖提取率的影响。
1.3.5 响应面试验设计
在单因素试验结果基础上,选择料液比1∶30(g/mL)、果胶酶与纤维素酶配比1∶3、pH 4.5,采用Box-Behnken试验设计,以加酶量、酶解温度和酶解时间3 个因素为自变量,进行响应面分析,分别记为X1、X2、X3,并以-1、0、1分别代表自变量的低、中、高3 个水平,按方程xi=(Xi-X0)/X对自变量进行编码,其中xi为自变量编码值,Xi为自变量真实值,X0为试验中心点处自变量真实值,X为自变量变化步长,试验因素水平设计见表1。

表1 响应面试验设计因素与水平Table 1 Factors and levels used in response surface methodology
1.3.6 芦荟多糖的抗氧化性分析
1.3.6.1 总抗氧化能力测定
采用FRAP法[25]。取1 mL不同质量浓度的芦荟多糖水溶液进行实验,空白组用水代替,对照组用同等质量浓度的VC代替,每个样品重复测定3 次。以1.0 mmol/L FeSO4溶液为标准,样品抗氧化活性以达到同样吸光度所需FeSO4的浓度(μmol/L)表示,定义为FRAP值。
1.3.6.2 DPPH自由基清除能力测定
参考Atoui等的测定方法[26]。取1 mL不同质量浓度的芦荟多糖水溶液进行实验,空白组用水代替样品,对照组用同等质量浓度的VC代替,每个样品重复3 次。

式中:A1为样品组的吸光度,A0为对照组的吸光度。
1.3.6.3 羟自由基清除能力测定
采用2-脱氧核糖法[27]。取500 μL不同质量浓度的芦荟多糖水溶液进行实验,空白组用水代替样品,对照组用同等质量浓度的VC代替,每个样品重复3 次。

式中:A1为样品组的吸光度,A0为空白组的吸光度。
1.4 数据分析
利用SPSS 18.0和Design-Expert V8.0数据处理软件进行数据处理及统计分析。
2 结果与分析
2.1 复合酶法提取芦荟多糖的单因素试验
2.1.1 料液比对多糖提取率的影响
在果胶酶与纤维素酶配比1∶2、pH 5.0、加酶量0.2%条件下,40 ℃酶解30 min,料液比对多糖提取率的影响如图1所示。随着提取液用量的增加多糖提取率逐渐升高,但料液比在1∶30之后提取率增加幅度明显减小,因此选择1∶30为最佳料液比。

图1 料液比对多糖提取率的影响Fig.1 Effect of solid-to-liquid ratio on the extraction yield of aloe polysaccharides
2.1.2 果胶酶与纤维素酶配比对多糖提取率的影响
在料液比1∶2 0(g/mL)、pH 5.0、加酶量0.2%条件下,40 ℃酶解30 min,果胶酶与纤维素酶配比对多糖提取率的影响如图2所示。随着纤维素酶含量的增多,多糖提取率逐渐升高,可能是因为芦荟细胞壁中纤维素含量较高,提高纤维素酶量可以使细胞壁破裂更快更彻底,从而使多糖溶出更多。当果胶酶与纤维素酶比例小于1∶3时,多糖提取率增加幅度明显减小,因此选择1∶3为果胶酶与纤维素酶的最佳配比。

图2 果胶酶与纤维素酶配比对多糖提取率的影响Fig.2 Effect of pectinase/cellulase ratio on the extraction yield of aloe polysaccharides
2.1.3 pH值对多糖提取率的影响
在料液比1∶20(g/mL)、果胶酶与纤维素酶配比1∶2、加酶量0.2%条件下,40 ℃酶解30 min,pH值对多糖提取率的影响如图3所示。当反应液pH值小于4.5时,多糖提取率随着pH值的升高逐渐升高,当pH值大于4.5时,提取率随着pH值的升高逐渐降低,pH 4.5可能是果胶酶和纤维素酶这两种酶酶解芦荟细胞壁的最佳pH值,在此条件下芦荟细胞壁破裂较快,从而使较多多糖溶出,因此选择pH 4.5为提取液最佳pH值。

图3 反应液pH值对多糖提取率的影响Fig.3 Effect of hydrolysis pH on the extraction yield of aloe polysaccharides
2.1.4 加酶量对多糖提取率的影响
在料液比为1∶20(g/mL)、果胶酶与纤维素酶配比1∶2、pH 5.0条件下,40 ℃酶解30 min,复合酶添加量对多糖提取率的影响如图4所示。随着加酶量的增大,多糖提取率逐渐增大,但当加酶量大于0.3%时提取率增加幅度明显减小,考虑到实际生产中成本问题,选择复合酶最佳添加量为0.3%。

图4 复合酶添加量对多糖提取率的影响Fig.4 Effect of total enzyme dosage on the extraction yield of aloe polysaccharides
2.1.5 酶解温度对多糖提取率的影响
在料液比1∶20(g/mL)、果胶酶与纤维素酶配比1∶2、pH 5.0、酶解30 min条件下,酶解温度对多糖提取率的影响如图5所示。在50 ℃时提取率最高,此温度可能是果胶酶与纤维素酶在提取条件下的最适温度,因此选为最佳提取温度;60 ℃时提取率降低可能是因为酶的活力下降造成的;70 ℃时提取率升高可能是因为当酶失活后高温可增加多糖的溶出造成的。

图5 酶解温度对多糖提取率的影响Fig.5 Effect of hydrolysis temperature on the extraction yield of aloe polysaccharides
2.1.6 酶解时间对多糖提取率的影响
在料液比1∶20(g/mL)、果胶酶与纤维素酶配比1∶2、pH 5.0、酶解温度40 ℃条件下,酶解时间对多糖提取率的影响如图6所示。随着酶解时间的延长,多糖提取率逐渐增大,但当酶解时间大于60 min时提取率增加的幅度明显减小,所以选择最佳酶解时间为60 min。 2.2 复合酶法提取芦荟多糖的响应面优化

图6 酶解时间对多糖提取率的影响Fig.6 Effect of hydrolysis time on the extraction yield of aloe polysaccharides
2.2.1 回归模型的建立及其显著性检验
复合酶法提取芦荟多糖的响应面试验结果及其预测值如表2所示(实测值为3 次平行实验结果的平均值)。对表中试验数据进行多元回归拟合,获得芦荟多糖提取率对自变量复合加酶量、酶解温度、酶解时间的二次多项回归模拟方程如下:

式中:x1、x2、x3分别为加酶量、酶解温度和酶解时间的编码值。利用该方程所得预测值与试验值较为接近。

表2 响应面试验设计及结果Table 2 Experimental design and results for response surface methodology
所得回归模拟方程的方差分析如表3所示。酶解温度(x2)对多糖提取率影响显著(P≤0.05),加酶量二次项(x12)和酶解温度二次项(x22)对多糖提取率影响极显著(P≤0.01)。所得模型极显著(P≤0.01),失拟项不显著(P=0.650 3),且表1中试验值与预测值较接近,说明该回归模型合理,可很好解释响应值。

表3 回归模型方差分析Table 3 ANOVA for the response surface model
2.2.2 响应面分析及优化
回归方程响应面如图7~9所示,任何两个交互因素的响应面都存在最高点,加酶量和酶解温度对多糖提取率的影响较大,而酶解时间对提取率的影响较小。通过软件(Design-Expert V8.0)分析得到最佳多糖提取条件为加酶量0.29%、酶解温度48.18 ℃、酶解时间40 min,在此条件下芦荟多糖提取率的预测值为5.87%。为了验
证该响应面结果的可行性,对所得最佳条件进行了优化和验证实验。在加酶量、酶解温度和酶解时间分别为0.3%、48 ℃和40 min条件下进行5 次实验,所得芦荟多糖提取率平均值为5.65%,相对标准偏差为0.105%,说明该条件下试验结果稳定;与预测值的相对误差为3.75%,说明该响应面结果可靠。
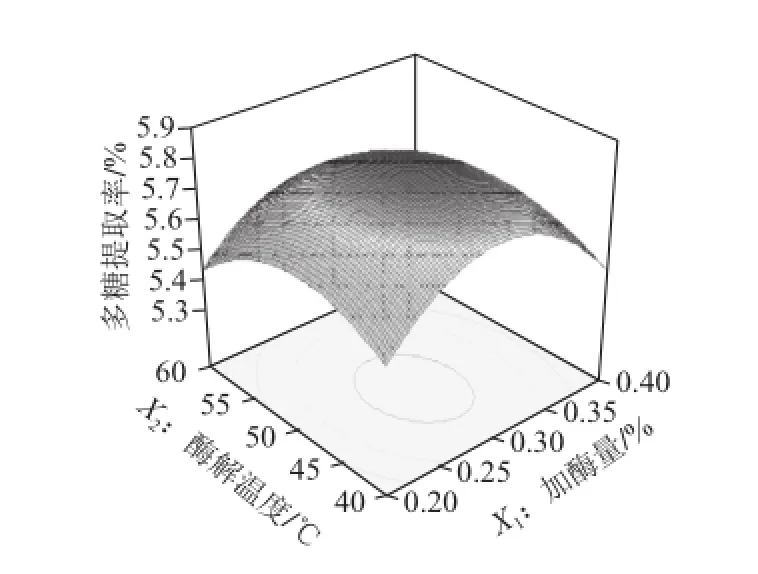
图7 加酶量和酶解温度对多糖提取率影响的响应面图Fig.7 Response surface model plot showing the effect of total enzyme amount and temperature on the extraction yield of aloe polysaccharides
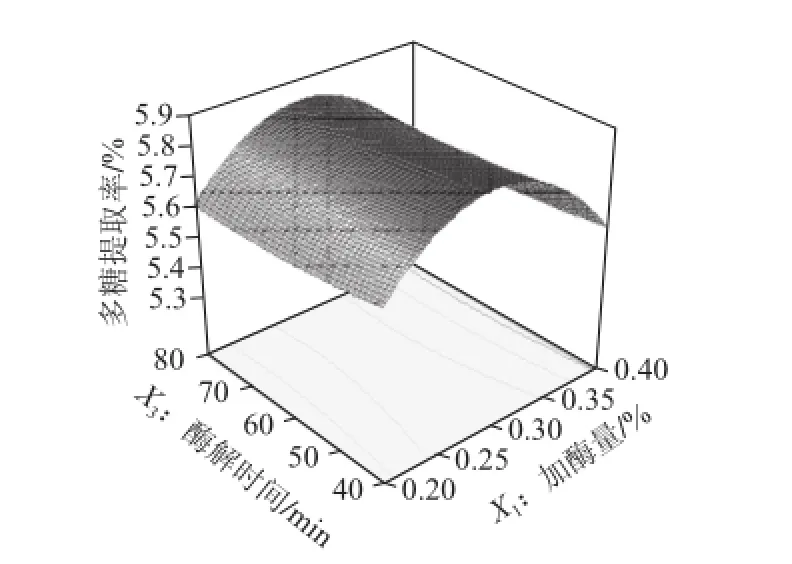
图8 加酶量和酶解时间对多糖提取率影响的响应面图Fig.8 Response surface plot showing the effect of total enzyme amount and hydrolysis time on the extraction yield of aloe polysaccharides
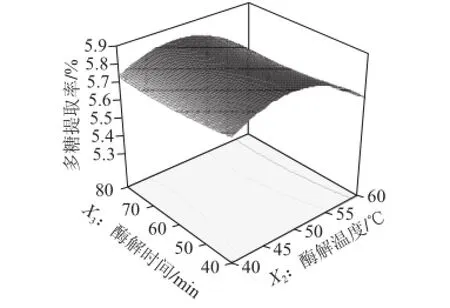
图9 酶解温度和酶解时间对多糖提取率影响的响应面图Fig.9 Response surface model plot showing the effect of hydrolysis temperature and time on the extraction yield of aloe polysaccharides
2.3 复合酶法与超声波辅助法的比较
利用超声波辅助法提取芦荟多糖的提取率为5.42%,响应面优化的复合酶法提取率为5.65%,复合酶法的提取率比超声波辅助法提高了4.2%。超声波辅助法是目前提取芦荟多糖常用并且效率较高的方法,复合酶法不仅可以达到较高的提取率,而且和超声波辅助法相比还具有反应条件温和、温度低、耗能少、对设备要求低等优点。复合酶法具有较好的芦荟多糖提取效果,可能是因为果胶酶和纤维素酶在短时间内快速降解了芦荟细胞壁中的果胶和纤维素,从而破坏了其细胞壁,提高了细胞壁和细胞膜的通透性,加速了细胞内部多糖的溶出[16-22]。
2.4 芦荟多糖的抗氧化性分析

图10 芦荟多糖的总抗氧化能力Fig.10 Total antioxidant power of aloe polysaccharides
芦荟多糖的总抗氧化能力测定结果如图10所示,随着芦荟多糖质量浓度的增加其总抗氧化能力逐渐增强,当质量浓度为25 mg/mL时其总抗氧化能力达到约130 μmol/L。与同质量浓度的VC相比芦荟多糖的总抗氧化能力略小,说明所提取芦荟多糖具有一定的总抗氧化能力。
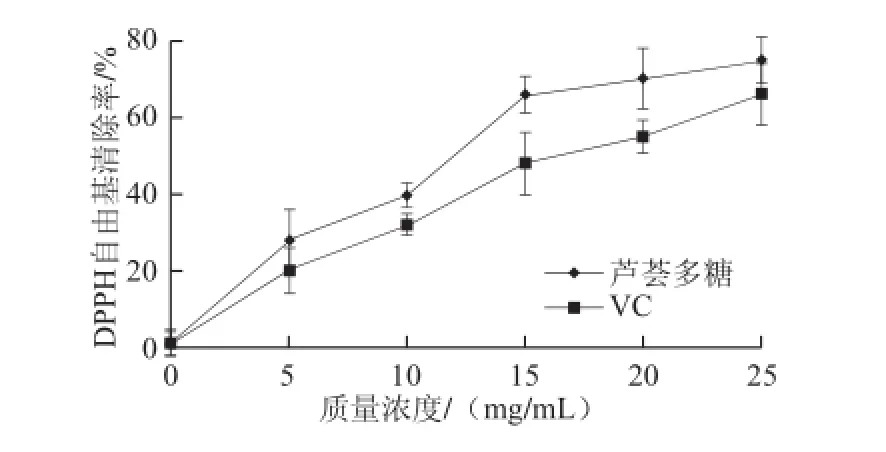
图11 芦荟多糖的DPPH自由基清除能力Fig.11 DPPH radical scavenging capacity of aloe polysaccharides
芦荟多糖的DPPH自由基清除能力测定结果如图11所示,当芦荟多糖质量浓度在0~15 mg/mL时,随着质量浓度的增加其DPPH自由基清除能力增加较快;在15~25 mg/mL时,其DPPH自由基清除能力增加较慢;在25 mg/mL时其清除率达到75%。和VC相比,芦荟多糖的DPPH自由基清除率略大于同质量浓度的VC,说明所提取芦荟多糖具有较强的DPPH自由基清除能力。
芦荟多糖的羟自由基清除能力测定结果如图12所示,与其DPPH自由基清除能力测定结果相似,在0~15 mg/mL时,其羟自由基清除能力增加较快,在
15~25 mg/mL时,其清除能力增加较慢;在25 mg/mL时其羟自由基清除率约为90%;其羟自由基清除率略大于同质量浓度的VC,说明所得提取芦荟多糖具有较强的羟自由基清除能力。芦荟多糖对羟自由基清除能力在其他文献中也有报道[28]。

图12 芦荟多糖的羟自由基清除能力Fig.12 Hydroxyl radical scavenging capacity of aloe polysaccharides
由以上所述可以得到芦荟多糖具有一定的抗氧化性,这些结果和已有报道[28-29](芦荟多糖具有抗氧化性)一致。芦荟多糖是由葡萄糖、半乳糖、甘露糖和阿拉伯糖等糖基由1-4糖苷键连接而成的一种混合多糖,其种类、组成、结构和性质具有较大差异。到底是哪一种多糖、多糖的什么结构使其具有抗氧化性目前还不清楚。在对芦荟多糖提取的基础上,还需对其进行分离纯化、结构鉴定和进一步的功能研究,相关实验正在进行中。
3 结 论
本研究在单因素试验结果的基础上,利用响应面法对复合酶提取芦荟多糖的条件进行了优化,并建立了合理可靠的二次多项模型。当料液比1∶30(g/mL)、果胶酶与纤维素酶配比1∶3、pH 4.5时,优化的最佳复合酶法提取条件为加酶量0.3%、酶解温度48 ℃、酶解时间40 min。在此条件下芦荟多糖的提取率为5.65%,和超声波辅助法相比,提取率提高了4.2%。对所提取芦荟多糖的抗氧化实验显示,随着质量浓度的增加,其总抗氧化能力、DPPH自由基清除能力和羟自由基清除能力逐渐增强,在25 mg/mL时其DPPH自由基清除率和羟自由基清除率分别达到75%和90%。酶法提取芦荟多糖用时短、效率高、条件温和且干净环保,为芦荟多糖的提取提供了一种新的、更有效的方法。
[1] 党秀丽, 刘雪英, 王庆伟, 等. 芦荟多糖的分离纯化及其相对分子质量和含量测定[J]. 医药导报, 2012, 31(1): 67-70.
[2] 黄凤兰, 高鸿蒙, 李娜娜, 等. 芦荟的研究进展[J]. 内蒙古民族大学学报: 自然科学版, 2012, 27(5): 553-556.
[3] WANG Zaojing, LUO Dianhui. Antioxidant activities of different fraction of polysaccharide purified from Gynostemma pentaphyllum Makino[J]. Carbohydrate Polymers, 2007, 68(1): 54-58.
[4] BHAT G, KUDVA P, DODWAD V. Aloe vera: natures soothing healer to periodontal disease[J]. Journal of Indian Society Periodontology, 2011, 15(3): 205-209.
[5] MIDRED A D, CHRISTOPHER R, PATEL S, et al. Aloe-emodin modulates PKC isozymes, inhibits proliferation, and induces apoptosis in U-373MG glioma cells[J]. International Immunopharmacology, 2004, 4(14): 1775-1784.
[6] JIA Yimei, ZHAO Guodong. JIA Jicheng. Preliminary evaluation the effects of Aloe Miller and Aloe arboresers Miller on word healing[J]. Journal of Ethnophar-macology, 2008, 120(2): 181-189.
[7] MARIITA R M, ORODHO I A, OKEMO P O, et al. Methanolic extracts of Aloe secundiflora Engl. inhibits in vitro growth of tuberculosis and diarrhea-causing bacteria[J]. Pharmacognosy Research, 2011, 3(2): 95-99.
[8] WU Junhua, XU Chen, SHAN C Y, et al. Antioxidant properties and PC12 cell protective erects of APS-1, a polysaccharide from Aloe vera var. chinensis[J]. Chinensis Life Sciences, 2006, 78(6): 622-630.
[9] 孔祥荣, 王宗伟. 芦荟多糖化学结构与生物活性[J]. 国外医药: 植物药分册, 2003, 18(1): 7-12.
[10] 赵华, 赵进, 何聪芬, 等. 转基因库拉索芦荟多糖的分离纯化与结构表征[J]. 食品科学, 2009, 30(15): 17-20.
[11] 何思微, 何凤林, 赵立超, 等. 库拉索芦荟中芦荟多糖提取方法比较[J].食品研究与开发, 2012, 33(2): 32-35.
[12] 安胜欣, 王纪纪, 唐小琼, 等. 微波辅助提取芦荟多糖的研究[J]. 安徽理工大学学报: 自然科学版, 2012, 32(3): 37-40.
[13] 韩秋菊, 王美珠. 木立芦荟多糖提取工艺研究[J]. 山东农业科学, 2013, 45(5): 103-104; 107.
[14] 韩秋菊, 卢生有. 微波法提取木立芦荟多糖的工艺研究[J]. 化学与生物工程, 2013, 30(5): 65-66; 71.
[15] 刘晓鹏, 姜宁, 向东山, 等. 库拉索芦荟多糖超声辅助提取工艺的研究[J]. 食品科学, 2008, 29(10): 286-289.
[16] CHANDINIA S K, JAGANMOHAN R L, GOWTHAMAN M K, et al. Enzymatic treatment to improve the quality of black tea extracts[J]. Food Chemistry, 2011, 127(3): 1039-1045.
[17] 袁春龙, 张金. 纤维素酶和果胶酶对番茄红素提取的影响[J]. 食品科学, 2010, 31(13): 100-104.
[18] 王璐, 胡仁和, 沈敏, 等. 纤维素酶和果胶酶共固定化研究[J]. 广东化工, 2013, 40(13): 79-80; 65.
[19] 裴海闰, 曹学丽, 徐春明. 响应面法优化纤维素酶提取苹果渣多酚类物质[J]. 北京农学院学报, 2009, 24(3): 50-54.
[20] 韩立宏, 马涛. 超声波辅助纤维素酶-碱液提取大枣皮红色素工艺的响应面优化研究[J]. 食品科学, 2008, 29(7): 221-225.
[21] 高文秀, 赵文卓, 李平平. 果胶酶酶解法辅助超声波法提取山楂中总黄酮的初步工艺优化[J]. 吉林化工学院院报, 2013, 30(7): 29-32.
[22] DEEPA D, YOGENDER P K, RAMESH C K. Optimization of cellulose production by a brown rot fungus Fomitopsis sp. RCK2010 under solid state fermentation[J]. Bioresource Technology, 2011, 102: 6065-6072.
[23] 赵光远, 常杨. 复合酶法生产红枣澄清汁工艺研究[J]. 郑州轻工业学院学报: 自然科学版, 2013, 28(3): 5-8.
[24] 余森艳, 刘海松, 张文硕. 复合酶法提取草莓汁的工艺优化[J]. 农产品加工, 2013(7): 43-45.
[25] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma as a measure of “antioxidant power”: the FRAP assay[J]. Analytic Biochemistry, 1996, 239: 70-76.
[26] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36.
[27] 曹炜, 卢珂, 陈卫军, 等. 不同种类蜂蜜抗氧化活性的研究[J]. 食品科学, 2005, 26(8): 352-357.
[28] 相炎红, 牛帅, 郑波, 等. 芦荟多糖的提取及其抗氧化性研究[J]. 中国食品工业, 2010(12): 74-75.
[29] 吴广枫, 汤坚. 芦荟多糖的纯化与体外抗氧化活性的研究[J]. 食品科学, 2002, 23(9): 129-132.
Optimization of Enzymatic Hydrolysis Conditions for the Extraction of Aloe Polysaccharides Using Response Surface Methodology and Assessment of Their Antioxidant Activity
LI Ya-hui1, MA Yan-hong1,*, HUANG Kai-hong1, ZHAO Yan-cun1, ZHANG Hong-zhi1, WANG Guang-ci2
(1. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. Xuzhou Huarui Aloe Products Co. Ltd., Xuzhou 221700, China)
The present study focused on the extraction of aloe polysaccharides by enzymatic hydrolysis using pectinase and cellulase together, and the antioxidant activity of aloe polysaccharides was also evaluated. The extraction conditions were optimized using response surface methodology on the basis of single factor experiments, and the antioxidant activity was assessed by measuring total antioxidant capacity, DPPH and hydroxyl radical scavenging capacity. Results showed that the optimum extraction process was found to be extraction at 48 ℃ with a total enzyme dosage of 0.3% under the pre-established conditions: solid-to-liquid ratio, 1:30 (g/mL); ratio of pectinase to cellulase, 1:3; and hydrolysis pH, 4.5. The yield of aloe polysaccharides under the optimized conditions was 5.65%, an increase of 4.2% over that obtained with ultrasonic-assisted extraction. The aloe polysaccharides obtained possessed potent antioxidant activity, showing a positive concentrationeffect relationship for total antioxidant capacity, and DPPH and hydroxyl radical scavenging capacity. The concentration 25 mg/mL scavenged 75% of DPPH free radical and 90% of hydroxyl free radical. To conclude, multienzymatic hydrolysis can provide a new effective method for the extraction of aloe polysaccharides with good antioxidant activity.
multienzymatic hydrolysis; aloe polysaccharide; response surface methodology; antioxidant activity
S567.2
A
1002-6630(2014)18-0063-06
10.7506/spkx1002-6630-201418012
2014-01-06
江苏省苏北科技发展计划—科技型企业技术创新项目(BC2012408);江苏省农业科技自主创新资金项目(CX(12)1005)
李亚辉(1985—),男,助理研究员,博士,研究方向为食品发酵与生物技术。E-mail:liqianhao217@126.com
*通信作者:马艳弘(1972—),女,副研究员,博士,研究方向为食品功能因子开发利用。E-mail:ma_yhhyy@126.com
