响应面法优化微波提取阳荷水溶性膳食纤维工艺
2014-02-27陈仕学郁建平
陈仕学,郁建平*,杨 俊,代 鸣
(1.铜仁学院材料与化学工程学院,梵净山特色动植物资源重点实验室,贵州 铜仁 554300;2.贵州大学生命科学学院,贵州 贵阳 550025; 3.印江刀坝初级中学,贵州 印江 555200)
响应面法优化微波提取阳荷水溶性膳食纤维工艺
陈仕学1,郁建平2,*,杨 俊3,代 鸣1
(1.铜仁学院材料与化学工程学院,梵净山特色动植物资源重点实验室,贵州 铜仁 554300;2.贵州大学生命科学学院,贵州 贵阳 550025; 3.印江刀坝初级中学,贵州 印江 555200)
研究野生阳荷水溶性膳食纤维的最佳提取工艺,以提取时间、料液比、微波功率和浸提液pH值为影响因素,进行四因素三水平的响应面试验设计,对其提取工艺条件进行优化,结果表明:最佳提取工艺条件为提取时间151.4 s、料液比1∶33(g/mL)、微波功率264 W、浸提液pH 3.65,此条件下水溶性膳食纤维的提取率为5.52%,与理论值5.75%相差较小。由此可知,响应面法优化微波辅助提取阳荷水溶性膳食纤维具有时间短、能耗低、提取率高等特点。
野生阳荷;水溶性膳食纤维;微波辅助提取;响应面分析法
阳荷(Zingiber strioatum Diels),俗称洋姜、山姜等,属于姜科姜属多年生草本植物[1]。阳荷是一种营养价值很高、食药同源的膳食纤维蔬菜,富含蛋白质、氨基酸和丰富的膳食纤维等物质,具有活血、消肿、止咳化痰、助消化等功效[2-4]。其膳食纤维具有很高应用价值。膳食纤维(dietary fiber,DF)是指不被人体消化的多糖类物质和木质素的总称,根据其溶解性不同,可分为水溶性膳食纤维(soluble dietary fiber,SDF)和水不溶性膳食纤维(insoluble dietary fibre,IDF)两大类。SDF是指不被人体消化道酶消化,但可溶于温水且其水溶液又能被4 倍体积的乙醇再沉淀的那部分物质[5]。在体内发挥代谢调节作用,如降低血液中的胆固醇水平,调节血糖水平,从而降低心脏病的危险,改善糖尿病症状、降低结肠癌的发病率等,该物质也广泛应用于食品中[6-11]。研究表明:微波法是用于天然产物提取的很好方法,并且具有节能、省时、高效、提取率高的优点;响应面法是由英国统计学家G. Box和Wilso于1951年提出的,它包括实验、建模、数据分析和提取条件优化,其原理为通过对实验建立数学模型然后对模型进行分析,对建立的提取率与各条件的回归方程进行数学求解,可以得出SDF提取率的最佳理论提取值和在该提取率条件下的各水平条件。响应面法还可以反应出各因素对试验结果的交互
影响,弥补了传统正交优化法只能考虑单因素对提取率的影响。目前关于阳荷SDF的响应面提取工艺未见报道。
本实验以梵净山野生阳荷为原料采用微波辅助提取并结合响应面(response surface methodology,RSM)法对其水溶性膳食纤维的提取工艺进行优化,为本地阳荷的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
野生阳荷采于梵净山附近林中,洗净、切碎、晒干,置于6 0 ℃烘箱中干燥,室温密封保存备用。
无水乙醇、硫酸 成都金山化学试剂有限公司;乙酸乙酯 天津市福晨化学试剂厂;三氯甲烷 成都科龙化工试剂厂;正丁醇 衡阳市凯信化工试剂有限公司;乙酸 长沙分路口塑料化工厂。以上试剂均为分析纯。
1.2 仪器与设备
MM823EC8-PS(X)型微波炉 美的微波电器制造有限公司;101-3型电热鼓风干燥箱 北京科伟永兴仪器有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市予华仪器有限责任公司;AR124CN型电子天平 奥豪斯仪器上海有限公司;80-2型离心沉淀机 江苏金坛市中大仪器厂;HH-2型数显恒温水浴锅 国华电器有限公司;FW80型万能粉碎机 北京科伟永兴仪器有限公司;秒表 深圳市超速达实业有限公司;PHS-3C型pH计雷磁仪器厂。
1.3 方法
1.3.1 阳荷SDF提取流程
选材→烘干→脱脂→烘干→粉碎→过筛→加浸提剂搅匀→超声处理→过滤→滤液浓缩→除蛋白→离心取滤液→脱色→加无水乙醇沉淀→静置过夜→过滤 →干燥
将已烘干的阳荷干品在常温下用350 mL的乙酸乙酯浸泡3 h,用蒸馏水清洗残留的有机溶剂至样品无味,将其置于60 ℃的烘箱内烘干,得脱脂样品。在脱脂样品中加入浸提剂,适当条件下超声处理,将样品过滤,取滤液水浴浓缩至1/2体积。用Sevag(氯仿∶正丁醇=4∶1)试剂除蛋白,离心去沉淀,向滤液加入体积分数5%过氧化氢溶液除色素。并加入4 倍体积无水乙醇室温静置过夜,用已干燥至恒质量的滤纸过滤,将滤纸及沉淀物置于70 ℃干燥箱中干燥,直至质量不变为止[12-15]。SDF的测定参照文献[16]。平行实验3 次,求平均值,计算SDF的提取率,见下式:
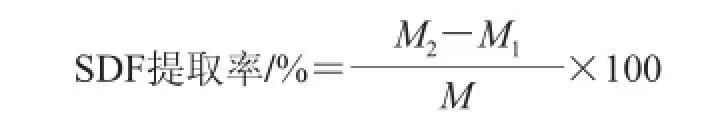
式中:M为阳荷样品的质量/g;M1为干至恒质量滤纸质量/g;M2为过滤后70 ℃烘干至恒质量的滤纸质量/g。
1.3.2 最佳浸提剂的选择
称取4 份1.0 g脱脂样品于烧瓶中,料液比1∶19(g/mL)分别加入pH 4的盐酸、硫酸、醋酸和pH 9的氢氧化钠混匀,微波处理时间120 s、功率264 W,经过滤、浓缩、除蛋白,最后加入4 倍体积的乙醇室温静置4 h,过滤干燥,计算SDF提取率。平行试验3 次,求平均值。
1.3.3 阳荷SDF提取单因素试验
准确称取1.0 g脱脂阳荷样品5 份,以最佳浸提剂为溶剂,微波提取时间40、80、120、160、300 s;料液比1∶19、1∶24、1∶29、1∶34、1∶39(g/mL);功率136、264、440、616、800 W;浸提液pH值分别为2、3、4、5、6进行单因素试验。
1.3.4 响应面试验
以微波提取时间、料液比、微波功率和浸提液pH值为自变量,根据中心组合试验设计,采用四因素三水平的响应面分析方法求取优化的工艺参数[17-18],试验因素和水平设计见表1。

表1 响应面试验因素水平表Table 1 Coded levels for independent variables used in response surface design
1.4 数据分析处理
单因素试验数据利用SSPS 19.0在95%和99%两个置信区间进行Duncan’s新复极差多重比较,然后采用Microsoft Office Excel 2007作图。响应面优化试验数据采用Design-Expert V8.0进行分析处理和作图。
2 结果与分析
2.1 最佳浸提剂的选择

表2 不同浸提液对提取率的影响Table 2 Influence of different extraction solvents on SDF yield
由表2可知,使用pH 4的硫酸浸提剂得到SDF提取率最高,其原因可能是硫酸作用下有利于细胞内的果胶和纤维素类物质容易溶出;盐酸的酸性比硫酸强,醋酸是弱酸,在提取过程中使其加速电离,影响SDF的提取率;氢氧化钠为碱性时不利于其溶出,从而影响SDF的提取率。
2.2 单因素试验
2.2.1 微波提取时间的最佳选择
称取5 份1.0 g脱脂阳荷样品在浸提液pH 4、料液比
1∶19(g/mL)、微波功率264 W、不同提取时间条件下处理。经过除蛋白质后计算SDF提取率。平行试验3 次,求平均值,结果见图1。

图1 提取时间对提取率的影响Fig.1 Influence of extraction time on SDF yield
由图1可知,随着时间的延长,SDF提取率也随之升高,但提取时间超过120 s,SDF提取率上升幅度较小,这是因为可溶性膳食纤维主要成分为果胶,而果胶中的原果胶溶解性较差,如果提取时间过短,则原果胶不能充分溶解出来,故适当延长提取时间,有利于阳荷中的果胶质充分溶解,提高产量;但如果提取时间过长,会增加果胶被裂解的量,并且果胶在水溶液中的部分会被氢离子水解而降低果胶产量[19]。因此,提取时间选择在120 s左右较为适宜。
2.2.2 料液比的最佳选择
称取5 份1.0 g脱脂阳荷样品在浸提液pH 4、提取时间120 s、微波功率264 W、不同料液比条件下处理。经除蛋白质后计算SDF提取率。平行试验3 次,求平均值,结果见图2。

图2 料液比对提取率的影响Fig.2 Influence of solid/liquid ratio on SDF yield
由图2可知,随着液体含量的增加,SDF提取率也随之升高。在料液比达到1∶29前,SDF提取率变化较为明显。液体含量过大会吸收微波发射的能量,从而降低了SDF的提取率。因此,选择料液比1∶29较为适宜。
2.2.3 微波功率的最佳选择
称取5 份1.0 g脱脂阳荷样品在浸提液pH 4、料液比1∶29(g/mL)、提取时间120 s、不同微波功率条件下处理。经除蛋白质后计算SDF提取率。平行试验3 次,求平均值,结果见图3。

图3 微波功率对提取率的影响Fig.3 Influence of microwave power on SDF yield
由图3可知,在微波功率较低时,SDF提取率随功率的升高而升高;当微波功率高于264 W时,SDF提取率随着功率的升高而降低。这是由于SDF主要成分为天然果胶和β-葡聚糖,功率过高,会使其本身分子结构受到破坏,从而使提取率降低。因此,微波功率应控制在264 W左右较为适宜。
2.2.4 浸提液pH值的最佳选择
称取5 份1.0 g脱脂阳荷样品按料液比1∶29(g/mL)加入浸提液pH值分别为2、3、4、5、6的浸提液,在微波功率264 W、提取时间120 s的条件下微波处理。通过除蛋白质后计算SDF提取率。平行试验3 次,求平均值,结果见图4。

图4 浸提液pH值对提取率的影响Fig.4 Influence of solvent pH on SDF yield
由图4可知,浸提液pH 2.0~4.0范围内,SDF提取率随着pH值的升高而增加;当pH>4.0时,SDF提取率随着pH值的升高而降低。由于果胶质的水解是在一定酸性条件下进行,酸性太弱,水解反应将进行得十分缓慢或者不发生反应;酸性太强,水解反应将会过于强烈,造成果胶脱酯裂解,产品提取率低[20-21]。因此,浸提液pH值控制在4.0左右较为适宜。
2.3 响应面法优化微波提取SDF
2.3.1 响应面优化试验设计与结果
为了优化微波提取SDF的最佳条件,以提取时间(X1)、料液比(X2)、微波功率(X3)、浸提液pH值(X4)为自变量,以SDF提取率(Y)为响应值,进行响
应面分析试验,方案与结果见表3,表3中共27 个试验,1~24为析因试验,25~27为中心试验,用以估计试验误差[22-23]。方差分析见表4。

表3 响应面试验设计及结果Table 3 The experimental design and results for response surface analysis
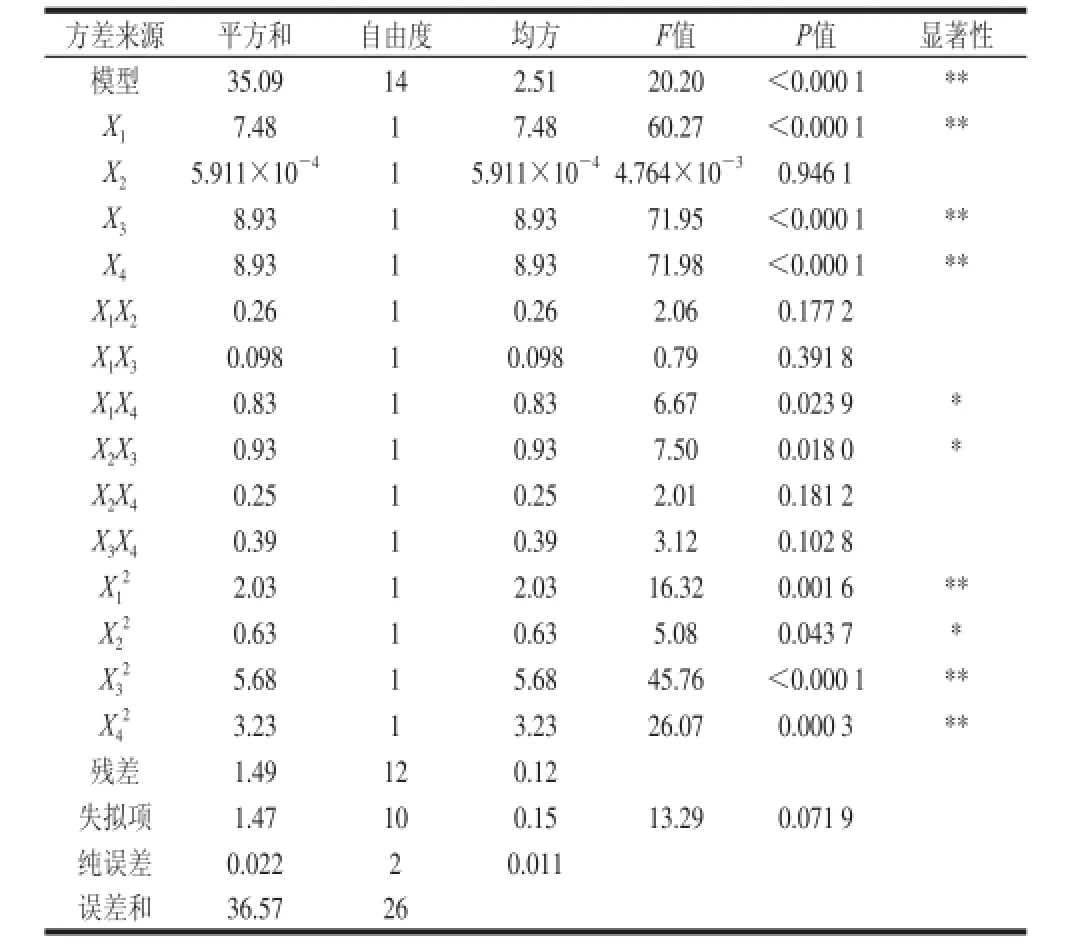
表4 回归方程方差分析Table 4 Analysis of variance for the regression equation
2.3.2 模型建立与方差分析

表5 回归方程可靠性分析Table 5 Credibility analysis of the regression equation
利用响应面分析法[24]优化微波辅助提取阳荷SDF的工艺参数,并采用Design-Expert V8.0软件进行分析,结果见表3,对表3结果进行统计分析,可建立如下多元二次回归方程:Y=5.04+0.80X1-7.132×10-3X2+0.86X3-0.88X4+0.25X1X2+0.16X1X3+0.45X1X4+0.48X2X3-0.25X2X4+0.31X3X4-0.62X12-0.34X22-1.06X32-0.78X42。对二次回归方程进行方差及可靠性分析,结果见表4、5。从表4可知,该二次回归方程的一次项、二次项及交互项中的X1、X3、X4、X1X4、X2X3、X12、X22、X32、X42均表现出了显著水平,该二次回归方程整体模型比较显著,并且失拟项不显著,该回归模型与实测值能较好地拟合。
2.3.3 响应面分析
为了考察交互项对提取率的影响,在其他因素条件固定不变的情况下,考察交互项对提取率的影响,对模型进行降维分析[25]。经Design-Expert V8.0软件分析所得的响应面图见图5。由图5可知,随着每个因素的增大,响应值增大;当响应值增大到极值后,随着因素的增大,响应值逐渐减小;在交互项对提取率的影响中,即提取时间与浸提液pH值(X1X4)和料液比与微波功率(X2X3)之间交互作用明显,与方差分析结果相一致。影响微波提取阳荷SDF的主次因素为X4>X3>X1>X2,即浸提液pH值>微波功率>提取时间>料液比。
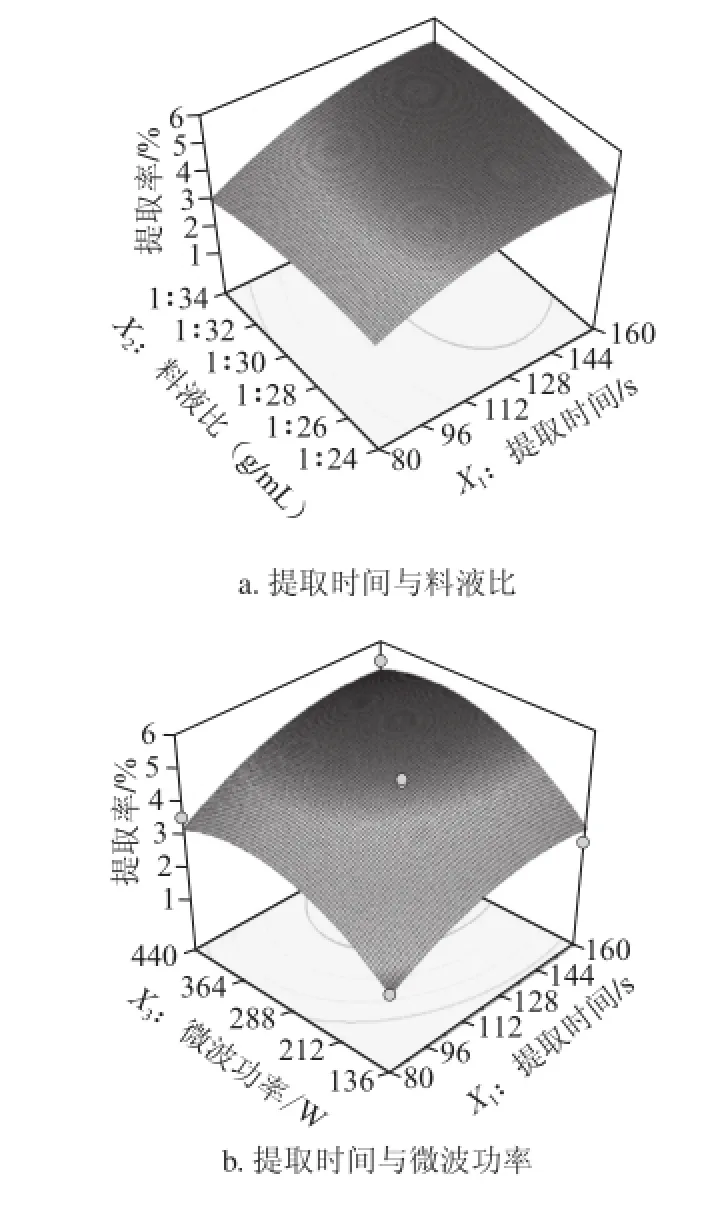
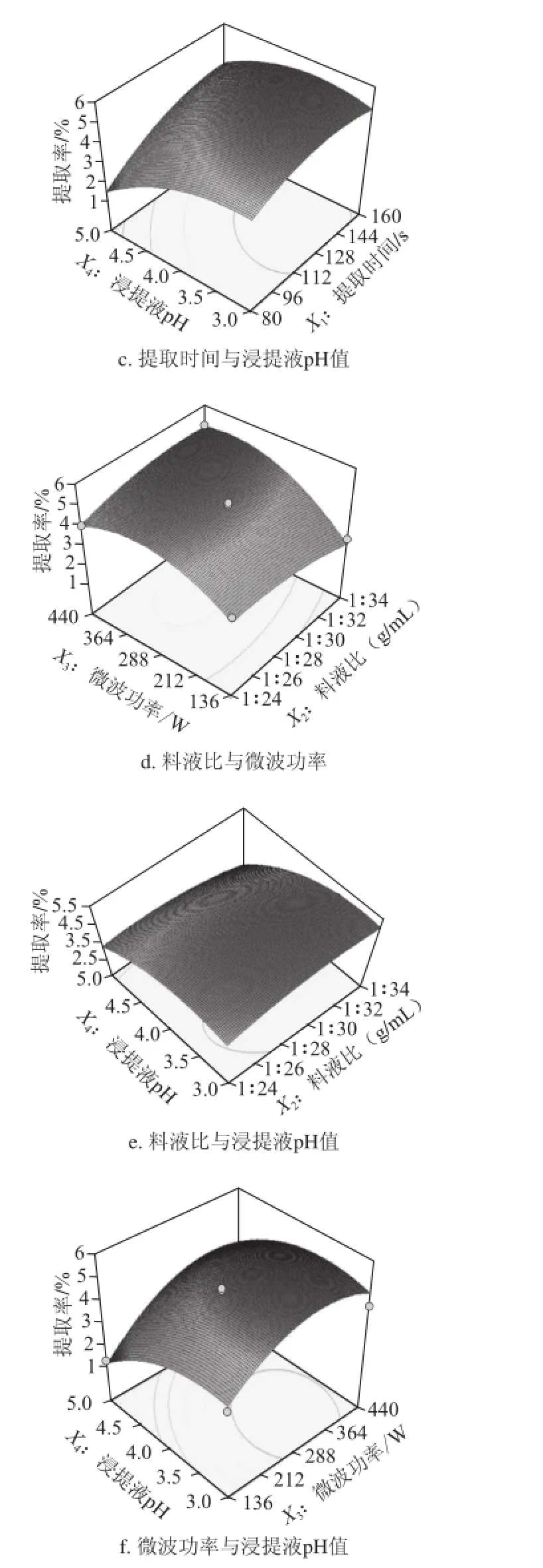
图5 提取时间、料液比、微波功率与浸提pH值对SDF提取率交互影响响应面图Fig.5 Response surface plots showing the effects of four extraction conditions on SDF yield
2.3.4 最佳提取工艺确定
通过Design-Expert V8.0对二元回归方程求最大值得到最佳提取工艺条件和SDF理论最大提取率,并根据实验室条件将最佳提取工艺条件进行优化,在优化条件下重复实验5 次测定SDF提取率,并计算相对标准偏差。条件与结果见表6和表7。

表6 提取条件优化Table 6 Optimum extraction conditions

表7 验证实验结果Table 7 Experimental verification of optimum extraction conditions
由表7可知,在最佳提取工艺下重复实验,SDF提取率为5.52%,相对标准偏差为1.52%,接近理论提取率5.75%,说明响应面法建立的阳荷SDF提取数学模型对阳荷SDF提取具有稳定可靠能指导实际生产应用。
2.4 SDF精密度实验
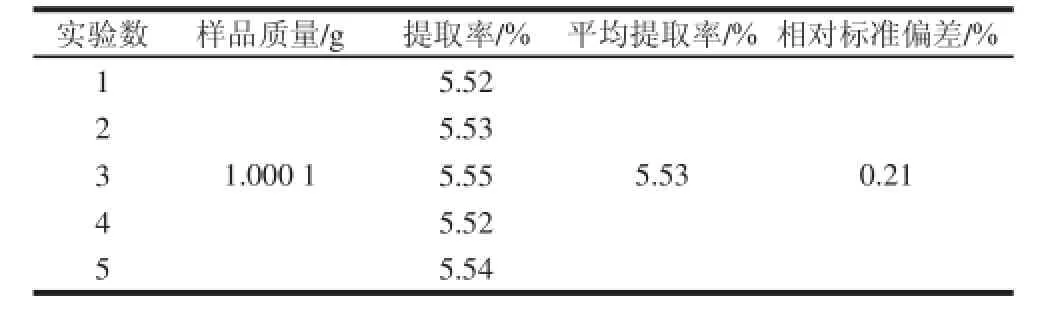
表8 精密度实验结果Table 8 Precision of the extraction method
按验证实验中1号样品称量,在最佳提取工艺下进行提取,同一条件下测量SDF提取率,结果见表8,重复实验5 次,得到相对标准偏差为0.21%,说明用此方法测量SDF提取率的精密度较高[26]。
2.5 不同浸提方法比较[27]

表9 不同提取方法对阳荷SDF提取率的影响Table 9 Comparison of extraction methods for SDF from Zingiibbeerr striolaattuumm Diels fruuiittss
由表9可知,响应面法优化微波法提取SDF所需料液比最少,提取时间最短,SDF提取率最高。这主要是因为响应面法优化微波辅助提取阳荷SDF具有时间短、能耗低、提取率高等特点。
3 结 论
本实验将响应面法运用到优化阳荷SDF的提取工艺研究,经试验优化后的微波提取阳荷SDF的最佳工艺条件为:提取时间151.4 s、料液比1∶33(g/mL)、微波功率264 W、浸提液pH 3.65。在此条件下SDF提取率为5.52%,理论最大提取率为5.75%,与Design-Expert.V8.0分析预测值相差较小,说明响应面法建立的阳荷SDF提取数学模型稳定可靠,能指导实际生产应用。
[1] 钱崇澍, 陈焕镛. 中国植物志[M]. 北京: 科学出版社, 1981: 146.
[2] 陈仕学, 郁建平. 梵净山野生阳荷红色素的提取及理化性质研究[J].山地农业生物学报, 2010, 29(5): 432-439.
[3] 朱玉昌, 周大寨, 彭辉. 阳荷红色素的提取及稳定性研究[J]. 食品科学, 2008, 29(8): 293-297.
[4] 扈晓杰, 韩冬, 李铎. 膳食纤维的定义、分析方法和摄入现状[J]. 中国食品学报, 2011, 11(3): 133-137.
[5] 刘成梅, 李资玲, 梁瑞红, 等. 膳食纤维的生理功能与应用现状[J].食品研究与开发, 2006, 27(20): 121-125.
[6] 吴洪斌, 王永刚, 郑刚, 等. 膳食纤维生理功能研究进展[J]. 中国酿造, 2012, 31(3): 13-16.
[7] 黄才欢, 欧仕益, 张宁, 等. 膳食纤维吸附脂肪、胆固醇和胆酸盐的研究[J]. 食品科技, 2006, 31(5): 133-136.
[8] 张根义, 柴艳伟, 冷雪. 谷物膳食纤维与结肠健康[J]. 食品与生物技术学报, 2012, 31(2): 124-133.
[9] 彭晓, 张蕾蕾, 常雅宁, 等. 微波法提取紫苏黄酮类物质及其成分分析[J]. 食品科学, 2012, 33(22): 53-57.
[10] 王文君, 欧阳克蕙, 徐明生, 等. 三叶草中水溶性膳食纤维的提取工艺研究[J]. 食品科技, 2009, 34(4): 88-93.
[11] 吴素蕊, 郑淑彦, 桑兰, 等. 金针菇菇脚可溶性膳食纤维提取工艺研究[J]. 食品工业科技, 2012, 33(11): 300-302.
[12] 黄鹏, 刘畅, 王珏, 等. 沙棘水溶性膳食纤维的提取及结构分析[J].食品科技, 2011, 36(2): 203-211.
[13] 李红霞, 王世清, 于丽娜, 等. 微波提取花生茎中水溶性膳食纤维的工艺优化[J]. 食品科学, 2010, 31(22): 221-225.
[14] 宋维春, 徐云升, 曹阳. 微波提取香蕉茎干中水溶性膳食纤维的工艺研究[J]. 食品科学, 2009, 30(6): 60-63.
[15] 陈仕学, 杨俊, 唐红, 等. 梵净山野生阳荷水溶性膳食纤维的提取工艺研究[J]. 食品工业科技, 2013, 34(8): 266-269.
[16] DA SILVA L P, DE CIOCCAM L S. Total, insoluble and soluble dietary fiber values measured by enzymatic-gravimetric method in cereal grains[J]. Journal of Food Composition and Anlysis, 2005, 18(1): 113-120.
[17] 柳嘉, 李坚斌, 刘健, 等. 响应面法优化豆渣水溶性膳食纤维提取过程的研究[J]. 食品科技, 2011, 36(9): 276-280.
[18] 李昊虬, 王国泽, 孙晓宇. 响应面法优化河套蜜瓜皮水溶性膳食纤维提取工艺的研究[J]. 食品工业科技, 2012, 33(7): 254-259.
[19] 洪华荣. 胡萝卜渣膳食纤维提取工艺及其功能特性研究[D]. 福州:福建医科大学, 2007: 1-63.
[20] 魏丹. 荸荠果皮膳食纤维提取工艺的研究[D]. 合肥: 合肥工业大学, 2007: 1-57.
[21] 姜亚东, 贾玉山, 格根图, 等. 苜蓿水溶性膳食纤维提取方法的研究[J].内蒙古草业, 2006, 18(3): 53-54.
[22] 韩扬, 何聪芬, 董银卯, 等. 响应面法优化超声波辅助酶法制备燕麦ACE抑制肽的工艺研究[J]. 食品科学, 2009, 30(22): 44-49.
[23] 王新雯, 海洪, 金文英, 等. 微波-超声波联合提取银杏叶黄酮工艺的响应面法分析[J]. 食品科技, 2010, 35(3): 183-188.
[24] GIOVINNI M. Response surface methodology and product optimization[J]. Food Technology, 1999, 37(2): 41-45.
[25] 王顺民, 汤斌, 余建斌, 等. 响应面法优化菜籽皮可溶性膳食纤维提取工艺[J]. 中国粮油学报, 2011, 26(9): 98-103.
[26] 刘旭辉, 姚丽, 覃勇荣, 等. 豆梨多糖提取工艺条件的初步研究[J].食品科技, 2011, 36(3): 159-163.
[27] 陈义勇, 窦祥龙, 黄友如. 响应面法优化超声-微波协同辅助提取茶多糖工艺[J]. 食品科学, 2012, 33(4): 100-103.
Optimization of Microwave-Assisted Extraction of Water-Soluble Dietary Fiber from Zingiber striolatum Diels Fruits by Response Surface Methodology
CHEN Shi-xue1, YU Jian-ping2,*, YANG Jun3, DAI Ming1
(1. Key Laboratory of Special Animal and Plant Resource in Fanjing Mountain, College of Material and Chemical Engineering, Tongren University, Tongren 554300, China; 2. College of Life Science, Guizhou University, Guiyang 550025, China; 3. Yinjiang Knife Dam Junior High School, Yinjiang 555200, China)
The microwave-assisted extraction of water-soluble dietary fiber (SDF) from Zingiber striolatum Diels fruits was optimized by response surface methodology. An experimental design was carried out involving four variables at three levels each. An extraction time of 151.4 s with a microwave power of 264 W using sulphuric acid solution at pH 3.65 as the extraction solvent with a solid-to-solvent ratio of 1:33 (g/mL) was found to be optimal. Experiments carried out under the optimized conditions resulted in an extraction yield of 5.52%, agreeing with the predicted value (5.75%). The extraction procedure presented in this study is characterized by time saving, low energy consumption and high extraction efficiency.
wild Zingiber striolatum Diels; water-soluble dietary fiber; microwave-assisted extraction; response surface methodology
TS201.1
A
1002-6630(2014)18-0057-06
10.7506/spkx1002-6630-201418011
2013-10-24
贵州省教育厅特色实验室建设项目(黔教合KY(2011)232);贵州省高等学校重点支持学科项目(黔教合重点支持学科字(2011)232);铜仁学院院级科研启动项目(2011(TS1121))
陈仕学(1976—),女,副教授,硕士,主要从事生化分离及天然产物研究。E-mail:tongrencsx01@126.com
*通信作者:郁建平(1959—),男,教授,博士,主要从事生化分离工程及天然产物化学研究。E-mail:E-yujp666666@163.com
