高血压及高脂血症与颈动脉粥样硬化的相关性分析
2014-02-27周晓欢杨玉春张源明陈玉岚
周晓欢,杨玉春,张源明,陈玉岚,陈 曦,梁 平
(新疆医科大学第一附属医院高血压科,新疆 乌鲁木齐830054)
颈动脉粥样硬化(carotid artery atherosclerosis,CAS)是脑血管病变的极高危因素之一,是西方发达国家主要的死亡原因。近些年由于我国人民生活水平的提高以及饮食习惯的改变,也逐渐成为中国人群的主要死亡原因。我国心脑血管病患者中有63%的患者伴有动脉粥样硬化斑块的形成[1]。其早期表现为颈 动 脉 内 膜-中 膜 厚 度 (imtima-media thickness,IMT)增加,伴有平滑肌细胞及纤维基质成分增生,使动脉管壁增厚变硬,可逐步发展形成动脉粥样硬化斑块,导致管腔闭塞或管壁破裂出血。其发生发展的形态学变化已经得到确认,但其间的机制尚未明确。本文就高血压、高脂血症与颈动脉粥样硬化之间的关系进行探讨,现报告如下。
1 资料与方法
1.1 一般资料 筛选2011年1月~2013年8月来本院体检的人群320例,将单纯高血压患者81例分为高血压组,其中男41例,女40例,平均年龄(54.3±4.5)岁;将单纯高脂血症患者77例分为高脂血症组,其中男39例,女38例,平均年龄(55.1±3.9)岁;高血压合并高脂血症患者82例为高血压合并高脂血症组,其中男41例,女41例,平均年龄(54.7±4.2)岁;既无高血压也无高脂血症患者80人为对照组,其中男39人,女41人,平均年龄(55.3±4.4)岁。高血压诊断标准为血压≥140/90mmHg[2],排除继发性高血压;高脂血症诊断标准为总胆固醇>5.72mmol/L和/或甘油三酯>1.70mmol/L。各组间年龄、性别等差异无显著性(P>0.05)。高脂血症组中患者的血脂水平对比以及高血压组患者之间血压水平差异亦无显著性(P>0.05),具有可比性。
1.2 仪器及检测方法 由于所选取的对照部位(颈动脉)位于表浅部位,可用超声显像颈动脉血管来辨别颈动脉内膜有无增厚及增厚的程度,有无斑块及斑块的数量等。故本院采用探头频率为10~12MHz的GE-LOGIQ7彩色超声诊断仪诊断。患者取仰卧位,颈部充分暴露,头部偏向检查对侧,选取颈总动脉远段、颈总动脉分叉处、颈总动脉近段3个检测位点,沿血管纵轴做纵切扫描,观察血管腔内有无粥样斑块的形成及其相应部位,并测量颈动脉内膜-中膜厚度(IMT)[3]。
1.3 判断标准 颈动脉内膜-中膜厚度(IMT)<1.0mm为正常,IMT在1.0~1.5mm 之间为增厚,若IMT≥1.5mm则为斑块形成[4]。颈动脉内膜-中膜增厚和/或颈动脉粥样斑块形成为颈动脉粥样硬化。
1.4 统计学方法 数据用SPSS 13.0统计软件处理,计量资料以±s表示,计数资料用χ2检验,组间对比采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 颈动脉粥样硬化检出率 在所有体检者中,高血压组有18例为CAS,检出率为22.22%;高脂血症组有有19例为CAS,检出率为24.68%;高血压合并高脂血症组有30例为CAS,检出率为36.58%;对照组有6人为CAS,检出率为7.50%,高血压组、高脂血症组、高血压合并高脂血症组的颈动脉粥样硬化斑块发生率与对照组比较差异有统计学意义(均P<0.05),且高血压合并高脂血症组与高血压组、高脂血症组对比差异亦明显(均P<0.05)。可以看出高血压、高血脂与颈动脉粥样硬化有密切联系,见表1。
2.2 颈动脉内膜-中膜厚度(IMT) 高血压组左侧IMT为(1.14±0.13)mm,右侧为(1.16±0.10)mm;高脂血症组左侧IMT为(1.20±0.09)mm,右侧为(1.22±0.10)mm;高血压合并高脂血症组左侧IMT为(1.29±0.16)mm,右侧为(1.28±0.17)mm;对照组左侧IMT 为(0.72±0.22)mm,右侧为(0.73±0.24)mm,各组颈总动脉左右两侧对比差异不明显(P>0.05);对照组与其他各组对比均有明显差异(均P<0.05)。可以看出高血压、高血脂与颈动脉增厚有密切关系,见表2。
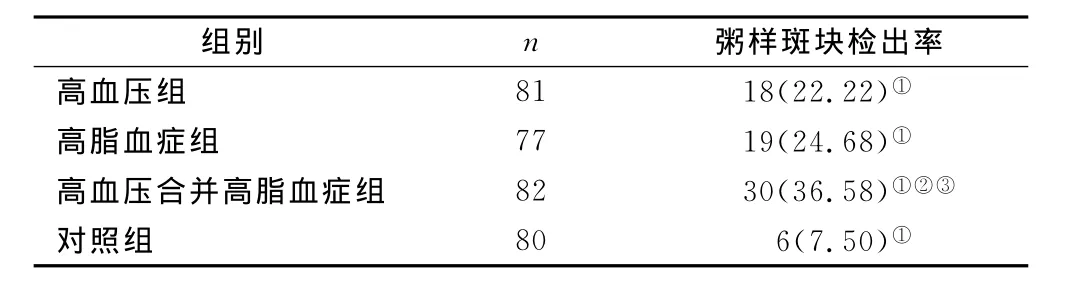
表1 体检者颈动脉粥样硬化检出率[n(×10-2)]Table 1 Incidence of carotid atherosclerosis
表2 体检者颈动脉内膜-中膜厚度(IMT)比较(±s)Table 2 IMT of carotid
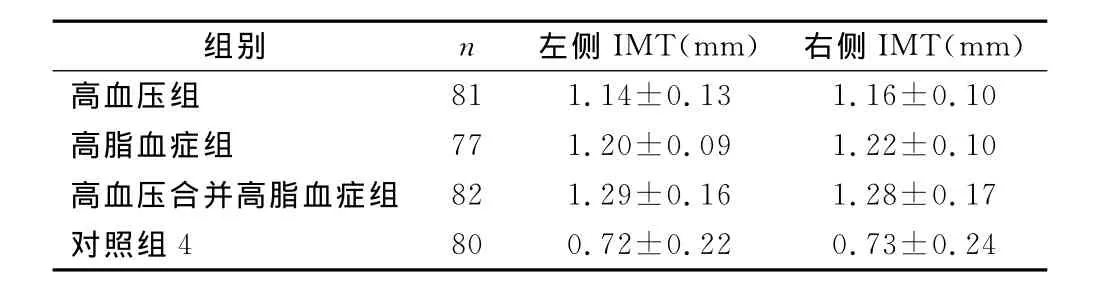
表2 体检者颈动脉内膜-中膜厚度(IMT)比较(±s)Table 2 IMT of carotid
注:与对照组比较,①P=0.034或P=0.035,均P<0.05
组别 n 左侧IMT(mm) 右侧IMT(mm)高血压组81 1.14±0.13 1.16±0.10高脂血症组 77 1.20±0.09 1.22±0.10高血压合并高脂血症组 82 1.29±0.16 1.28±0.17对照组4 80 0.72±0.22 0.73±0.24
3 讨论
动脉粥样硬化(AS)是动脉硬化疾病中最常见、危害最大的疾病,其特点是动脉血管管壁增厚、变硬、弹性降低、管腔缩窄,在动脉内膜上表现为黄色粥样斑块,主要累及部位为大中型动脉,其中主动脉、冠状动脉及颅脑动脉累及最多,其次为肢体动脉、肾动脉、肠系膜动脉等。颅脑动脉粥样硬化常常侵及颈内动脉和基底动脉,颈动脉血管分叉处为好发部位。动脉粥样硬化所导致的血管管腔狭窄可引起脑供血不足,局部斑块破裂或斑块碎片脱落可造成同侧TIA或脑栓塞等严重后果,长期的慢性脑供血不足还可导致血管性痴呆的发生[5]。其病理生理过程为动脉内膜下大量的脂质沉积,单核细胞、淋巴细胞广泛浸润,单核细胞吞噬脂蛋白形成泡沫细胞沉积在血管内膜下,同时伴有中膜平滑肌细胞向内膜迁移且大量增殖,这些造成病变部位相继出现脂质点和条纹、粥样和纤维粥样斑块复合病变[6]。
AS的发生机制目前尚未完全明确,主要有以下观点:①脂源性学说:该学说认为高脂血症可以引起内皮细胞损伤,增加血管壁通透性,利于血浆脂蛋白向动脉内膜下浸润,引起单核细胞聚集并吞噬脂蛋白,形成泡沫细胞,还可刺激血管平滑肌细胞的增殖,从而造成脂质斑块的形成[7]。有关动物实验表明,高胆固醇和高脂肪饮食饲喂的动物更易产生类似于人类的动脉粥样硬化病变。②损伤应答学说:有学者认为动脉粥样硬化的形成是以血管内皮损伤为始动因素,包括机械性、免疫性、高脂、缺氧、毒素、病毒等的损伤,这些因素作用于内皮,使内皮释放大量细胞因子,促使单核细胞与血管内皮的粘附以及摄取脂质,形成脂纹,进一步演化成纤维斑块。受损内皮细胞分泌的生长因子(GF)及单核细胞释放的血小板源性生长因子(PDGF)样生长因子可刺激血管中膜平滑肌的增生,致使纤维斑块进一步发展[8]。
高血脂与AS密切相关。有报道显示,血清中的胆固醇水平的增高与AS的发生呈正相关关系[9],降低低密度脂蛋白(LDL-C)含量以及增加高密度脂蛋白(HDL-C)的含量可以减少心血管病的发生率。本文中高脂血症患者AS发生率高于对照组就充分说明了这一问题。高血压也是AS发生的重要危险因素,长期血压增高会增加受力血管处内膜的损伤,增加AS的发病机会。有报道表明,脉压差与IMT以及AS的发生率呈正相关关系[10,11]。本研究所得出的结论与报道一致。另外,本研究还发现高血压合并高脂血症患者的CAS发生率以及IMT的增加都要远远高于单纯的高血压、高血脂患者,说明高血脂、高血压是诱发CAS的高危因素,需要引起足够的重视。
4 结论
在本研究中,高血压合并高脂血症组的AS检出率远高于单纯高血压组及单纯高脂血症组,而单纯高血压、高血脂患者的AS检出率也要远远高于正常对照组;高血压合并高脂血症组的IMT大于其余两组,单纯高血压、高血脂患者的IMT大于正常人群。证实了高血压以及高脂血症是诱发CAS的高危因素,而高血压合并高脂血症可加快加重CAS的发生发展这一观点。故加强患者血压及血脂的全方位控制,对预防脑血管疾病的发生发展具有极其重要的作用。
[1] 于兰芳,王娘娣,袁 波,等.颈动脉粥样硬化斑块与急性脑梗死患者血脂、血压关系的探讨[J].中国实用神经疾病杂志,2006,9(5):9-10.
[2] 刘力生.中国高血压防治指南[M].中华高血压杂志,2011,(8):701-743.
[3] 李志强,姚庆荣,张桂芳,等.彩色多普勒超声对颈动脉病变的诊断检查[M].西部医学,2007,19(5):912-913.
[4] 华 扬.实用颈动脉与颅脑血管超声诊断学[M].北京:科学出版社,2002:142.
[5] 中华神经科学会中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29:379-380.
[6] 吴先杰,王永霞.动脉粥样硬化发生机制研究现状及思路[J].中华实用诊断与治疗杂志,2012,26(7):629-630.
[7] Skaln K,Gustafsson M,Rydberg E K,et al.Subend0thelial retention of atherogenic lipoproteins in early atherosc1erosis[J].Nature,2002,417(6890):750-754.
[8] 万 恒,兰 俊,童南伟.高血压伴代谢综合征的诊断[J].西部医学,2007,19(1):124-126.
[9] 张 震,惠汝太.高密度脂蛋白(HDL)和甘油三酯作为治疗的靶点[J].中国分子心脏病学杂志,2003,3(5):296-304.
[10] 杨云霞,罗晓惠,周 莉.颈动脉粥样硬化与血液流变学相关性分析[J].云南医药,2009,30(3):319-320.
[11] Shah B,Kumar N,Garg P,et al.Metabolic syndrome does not impact survival in patients treated for coronary artery disease[J].Coronary Artery Disease,2008,l9(2):71-77.
