急性脊髓炎患者血清及脑脊液白蛋白免疫球蛋白及β-AP Tau蛋白的变化*
2014-02-27何明杰
何明杰,康 东
(1.成都医学院第一附属医院神经外科,四川 成都610500;2.遂宁市中心医院,四川 遂宁629000)
急性脊髓炎是指脊髓白质脱髓鞘或坏死而造成的急性横贯性损害。病因尚不清楚,可能与疫苗接种或感染后所引起的自身免疫应答反应相关,是临床上最为常见的脊髓炎症,主要临床症状为病损平面以下的肢体瘫痪、传导束性感觉障碍及大小便障碍[1]。脑脊液及血清蛋白质检测对中枢神经系统疾病血脑屏障损害有重要价值,而急性脊髓炎又可能与自身免疫应答相关,故对其免疫系统进行检测对疾病的诊治十分必要。此前急性脊髓炎是否早期就出现神经损害未见研究报道,为此,笔者对患者血清、脑脊液白蛋白及免疫球蛋白进行了相关研究,现报告如下。
1 资料与方法
1.1 一般资料 选取神经内科2013年5月~2014年3月行脑脊液检查的患者67例,按是否为急性脊髓炎将患者分为疾病组32例和对照组35例。疾病组中男性17例,女性15例,年龄16~68岁,平均45岁,均经临床症状、肌电图、血常规、诱发电位、CSF检查、CT以及MRI等检查确诊为急性脊髓炎;对照组中男性17例,女性18例,年龄19~64岁,平均43岁,经临床诊断均为神经系统非炎症性疾病患者。两组患者一般资料比较无统计学差异(P>0.05),具有可比性。
1.2 方法 留取两组患者静脉血和脑脊液各2ml,常规测定脑脊液寡克隆带(CSF-OCB)和24hIgG鞘内合成率(IgG-syn),运用白蛋白指数(QALB)=脑脊液微量白蛋白(CSF-Alb)/血清白蛋白(S-Alb)比值判定血脑屏障通透性,IgG指数=脑脊液IgG(CSFIgG)/脑脊液白蛋白(CSF-Alb)或血清IgG(S-IgG)/血清白蛋白(S-Alb)。CSF-OCB结果以在球蛋白负极端2cm范围内可见两条或者两条以上不连续不规则的血清条为阳性,24小时IgG-syn正常值<7mg/24小 时、QALB正常值<7×10-3、IgG指数正常值<0.7,大于或者小于正常值者为异常。采用放射免疫法测定血清β-AP和Tau蛋白水平,试剂由美国Sigma公司生产,纯度为97%。
1.3 统计学方法 采用SPSS 19.0软件进行数据分析,计量资料用±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血清白蛋白(SALB)、脑脊液白蛋白(CALB)和QALB指数比较 与对照组比较,疾病组SALB无明显差异(P>0.05);CALB和 QALB明显升高,差异有统计学意义(P<0.05),见表1。
表1 两组患者SALB、CALB和QALB指数比较(±s)Table 1 The comparison of SALB,CALBand QALBindex between the two groups
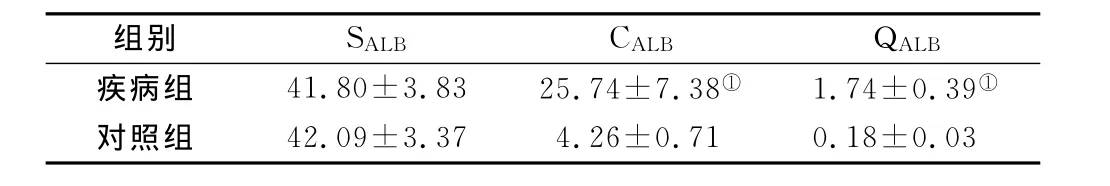
表1 两组患者SALB、CALB和QALB指数比较(±s)Table 1 The comparison of SALB,CALBand QALBindex between the two groups
注:与对照组比较,①P<0.05
组别 SALB CALB QALB疾病组 41.80±3.83 25.74±7.38① 1.74±0.39①对照组42.09±3.37 4.26±0.71 0.18±0.03
2.2 两组患者SIgG、CIgG、IgG 指数、IgG-syn和 CSFOBC比较 与对照组比较,疾病组SIgG、CIgG、IgG指数和IgG-syn均显著升高,差异有统计学意义(均P<0.05);CSF-OBC阳性患者9例(28.1%),两组间差异有统计学意义(P<0.05),见表2。
表2 两组患者SIgG、CIgG、IgG指数、IgG-syn和CSF-OBC比较(±s)Table 2 The comparison of SIgG,CIgG,IgG index,IgG-syn and CSF-OBC between the two groups

表2 两组患者SIgG、CIgG、IgG指数、IgG-syn和CSF-OBC比较(±s)Table 2 The comparison of SIgG,CIgG,IgG index,IgG-syn and CSF-OBC between the two groups
注:与对照组比较,①P<0.05
组别 SIgG CIgG IgG指数 CSF-OBC阳性率(×10-2) IgG-syn疾病组 33.28士11.26① 0.069±0.031① 1.05士0.58① 9(28.1)① 8.6±5.1①对照组 13.28士6.74 0.019士0.21 0.45士0.14 0(0.00)5.2±3.1
2.3 两组患者血清及脑脊液β-AP和Tau蛋白比较
与对照组比较,疾病组患者血清β-AP、脑脊液β-AP、血清Tau蛋白和脑脊液Tau蛋白均无明显变化,差异无统计学意义(均P>0.05),见表3。
表3 两组患者β-AP和Tau蛋白比较(±s)Table 3 The comparison ofβ-AP and Tau protein between the two groups

表3 两组患者β-AP和Tau蛋白比较(±s)Table 3 The comparison ofβ-AP and Tau protein between the two groups
组别 血清β-AP 脑脊液β-AP 血清Tau蛋白 脑脊液Tau 蛋白疾病组 53.40士8.17 7.84士2.31 20.18±9.14 118.84士42.31对照组 55.12士9.14 7.93士2.47 19.23±8.19 117.59士41.27
3 讨论
白蛋白是由肝脏合成的氨基残基单链多肽,能从血清中透过血脑屏障进入脑脊液。脑脊液中80%的白蛋白通过超滤作用来自血清中的白蛋白[2],血清白蛋白的浓度可以影响到脑脊液中白蛋白的浓度,但是不会影响到血脑屏障的通透性。血清白蛋白的含量稳定,不会随着机体损伤、炎症等应激反应而变化[3].正常情况下,因为血脑屏障的存在,脑脊液中白蛋白的含量甚微。当中枢神经系统发生感染炎症时,血脑屏障被破坏,分子量较小的白蛋白比起分子量较大的球蛋白更易透过血脑屏障进入脑脊液,因此脑脊液中的白蛋白含量可以较早地反映血脑屏障的损伤[4]。CALB与SALB的比值更加能够真实客观地反映出血脑屏障的损伤程度,因为它充分排除了影响脑脊液中白蛋白水平的血清白蛋白因素。CALB/SALB比值,即QALB的变化是评价血脑屏障功能完整性的较好指标[5],QALB值增大提示血脑屏障有损伤,比值越大,损伤程度越严重[6]。本研究通过与神经系统非炎症患者进行比较,发现急性脊髓炎患者SALB水平无明显变化,差异无统计学意义(P>0.05),而CALB水平明显升高,QALB也随之升高,差异有统计学意义(P<0.05),说明急性脊髓炎患者SALB含量在疾病早期无明显变化,在SALB含量不变的情况下,CALB水平却显著升高,患者存在血脑屏障损伤,而且在较早期就可以表现出明显的异常,因此早期检测SALB和CALB,计算患者QALB,是鉴别神经系统炎性疾病和非炎性疾病的一个很好的指标,对于疾病的早期治疗有重要价值。
目前医学界普遍认为神经系统自身具有一套完整的免疫应答体系,而且由于自身组织结构的特殊性,体液和细胞免疫等多种因素的参与和调节作用,它的维持又是一个复杂的过程[7],脑脊液检查是反映神经系统病变的一项重要手段,通过对脑脊液免疫指标如脑脊液寡克隆带(CSF-OCB)、24小时IgG鞘内合成率(IgG-syn)、IgG指数的测定,可以推测中枢神经系统有无体液免疫应答,以此来评价神经系统的免疫功能状态[8]。因此,有学者提出,即使血脑屏障通透性正常时,分析IgG-syn、CSF-OCB也能说明鞘内IgG存在异常合成。还有学者提出,即使血脑屏障被破坏,IgG–syn异常仍然是免疫球蛋白产生的证据之一[9]。本研究结果显示,急性脊髓炎患者SIgG、CIgG、IgG指数、IgG-syn和CSF-OBC均较对照组异常升高,说明急性脊髓炎的发病机制可能与感染后发生的非正常免疫应答相关。机体免疫的最初阶段,这种免疫应答是一种保护性的,但若免疫过程较激烈,这种免疫应答所产生的抗体又会成为致病性或破坏性抗体,因此体液免疫应答参与了急性脊髓炎的发展[10],血清及脑脊液免疫球蛋白指标的检测可以为临床诊治急性脊髓炎提供更多的指导。
β-AP是由淀粉样蛋白前体经蛋白水解酶作用后形成的一种跨膜糖蛋白,其主要影响是通过激活胶质细胞等途径产生大量细胞炎性因子、补体蛋白及其他相关免疫因子,从而产生神经毒性;或直接减退神经功能,或导致神经功能障碍,或通过产生神经纤维缠结间接导致神经功能减退[11,12]。Tau蛋白是功能化的磷蛋白,主要存在于轴索和神经元胞体中,与微管蛋白结合以促进微管蛋白的聚集和维持微管的稳定性,参与细胞分裂、形态维持、信号传递等生物学过程。病理状态下,Tau蛋白被过度磷酸化,丧失促进微管组装的生物活性,使微管结构被广泛破坏,正常轴突转运受损,引起细胞骨架的结构异常、突触丢失和神经元功能损伤,发生神经退行性改变[13,14]。
4 结论
本研究通过与神经系统非炎症疾病对比,发现急性脊髓炎患者β-AP和Tau蛋白均无明显变化,说明急性脊髓炎患者早期还尚未出现明显的神经功能损伤。所以,通过检测患者血清、脑脊液β-AP和Tau蛋白,对疾病的进展和预后具有积极的指导意义。
[1] 贾建平.神经病学 [M].北京:人民卫生出版社,2009:317.
[2] 张秀明,李健斋,魏明竟,等.现代临床生化检验学[M].北京:人民军医出版社,2001:378.
[3] 刘卫彬,陈理娥.动脉硬化性脑血管病外周血和脑脊液免疫球蛋白系列指标的观察分析[J].中国神经免疫学和神经病学杂志,2013,1(1):41-44.
[4] Tibbling G,Link H.Princip les of album in and IgG analys is in neurologicald isorders of reference values[J].Scand JLab Invest,2012,37(5):385-390.
[5] 杨维良.脑脊液白蛋白检测对中毒后迟发性脑病患者的临床意义[J].吉林医学,2010,21(6):366.
[6] 顾可梁.脑脊液检测的几个新问题[J].临床检验杂志,2011,16(3):187.
[7] Deisenhammer F,Bartos A,Egg R,et al.Guidelines on routine cerebrospinal fluid analysis.Report from An EFNS Task Force[J].Eur J Neurol,2010,13(9):913-922.
[8] 郝洪军,项 俊,高 枫,等.中枢神经感染患者脑脊液免疫指标分析[J].中国现代医学杂志,2011,16(5):683-685.
[9] Berger T,Rubner P,Schautzer F,et al.Antimyelin antibodyies as apredictor of clinically definite multiple sdlerosis after afirst demyelinating event[J].J N Engl J Med Boston,2008,349(2):139-146.
[10] 邵素君,王效敏.急性脊髓炎与脊髓型多发硬化的对比研究[J].中国现代医学杂志,2012,16(10):1531-1534.
[11] Zhang J,Dong Y,Xu Z,et al.2-Deoxy-D-glucose attenuates isolurane-induced cytotoxicity in an in vitro cell culture model of h4human neuroglioma cells[J].Anesth Analg,2011,113(6):1468-1475.
[12] 邓有琦,李静梅,杨小华,等,简易锥颅穿刺血肿或脑室引流术与开颅手术治疗高血压性脑出血的对比研究[J].西部医学,2012,24(12):2334-2338.
[13] Giro G,Sakakura CE,Gongalves D,et al.Effect of 17beta-estrad iol and alendronate on the removal torque of osseoin tegrated titanium implants in ovariecto mized rats[J].J Pefodontol,2010,78(7):1316-1321.
[14] Kaden D,Bush AI,Danzeisen R,et al.Disturbed copper bioavailability in Alzheimer's disease[J].Int J Alzheimers Dis,2011,2011:345614.
