藏族非综合征性耳聋儿童患者GJB2 SLC26A4 MTRNR1基因突变分析*
2014-02-27尼玛吉宗杨风林张桂林
巴 罗,边 片,尼玛吉宗,杨风林,张桂林
(西藏自治区人民医院耳鼻咽喉科,西藏 拉萨850000)
新生儿重度听力障碍发病率为1/1000,其中半数与遗传因素相关[1]。遗传性耳聋具有高度的遗传异质性,到目前为止,己定位的非综合征型耳聋致病基因位点有100余个,已克隆的耳聋相关基因70余个(Guy Van Camp,Richard Smith;The Hereditary Hearing loss Homepage;last update:January 7th,2014;http://hereditaryhearingloss.org/main.aspx-c=HHH&n=86162)。国内外已有多项大规模研究证实GJB2、SLC26A4、MTRNR1(12SrRNA)三个基因是最主要的致聋基因,在中国汉族非综合征型耳聋患者中,19.1%的患者携带GJB2复合杂合突变;其次是SLC26A4,12.1%的患者携带复合杂合;线粒体的 MTRNR1基因A1555G 突变携带率是1.6%[2~4]。本研究重点分析西藏自治区藏族先天性耳聋患者中,重度-极重度耳聋患者的GJB2、SLC26A4、MTRNR1(12SrRNA)基因突变发生的几率、突变形式和突变热点,为西藏自治区耳聋患者的早期诊断和早期干预提供有价值的数据。
1 对象和方法
1.1 对象选择 选取2012年1月~2014年1月西藏自治区各大医院出生的新生儿中临床确诊的耳聋患者13例,以及经西藏自治区残联确诊的14例,共27例藏族耳聋患者纳入本研究。27例患者均为先天性、非综合征性、重度-极重度耳聋患者。另选取种族匹配的正常者101例作为对照。所有受试人员本人及患者家属同意加入本研究并自愿签署知情同意书。27例患者中男性9例,女性18例,年龄3~12岁,中位年龄5岁。所有患者都行CT和MRI检查,未发现外、中、内耳形态异常;查体未发现糖尿病、视力障碍、神经系统、皮肤等其他系统病变;亦无感染、创伤、使用耳毒性药物等其它环境致聋因素。
1.2 诊断标准 本研究的耳聋表型分析判断标准参照Van Camp等2003年提出的《非综合征型遗传性耳聋家系遗传学及听力学描述术语建议案》:①根据是否伴有全身其他器官系统的异常而分为非综合征型聋和综合征型聋。②根据听力损失的性质分为传导性聋、感音神经性聋及混合性聋。③根据语言发育阶段分为语前聋和语后聋。④根据听力损失的频率分为高频听力损失型(2~8kHz听力下降为主)、低频听力损失型(0.25~0.5kHz听力下降为主)、中频听力损失型(0.5~2kHz听力下降为主)和全频听力损失型(0.25~8kHz听力下降)。⑤听力损失程度按照两耳中听力较好一耳的平均听阈(0.5~4kHz听阈的平均值)来评估:20~40dB HL为轻度听力损失,41~70dB HL为中度听力损失,71~95dB HL为重度听力损失,>95dB HL为极重度听力损失(M.Mazzoli,G.Van Camp;The Hereditary Hearing loss Homepage;http://hereditaryhearingloss. org/main. aspx-c =HHH&n=86638)。
1.3 实验方法
1.3.1 提取DNA 取外周血2~5ml,酚-氯仿法提取基因组DNA,溶解于TE溶液,分光光度计定量和纯度检测后,-70℃保存备用。
1.3.2 引 物 设 计 通 过 Primer3.0 软 件 (http://bioinfo.ut.ee/primer3-0.4.0/)对GJB2、SLC26A4、MTRNR1(12SrRNA)三个基因全部编码区设计引物,引物长度18~27bp,扩增片段长度250~1000 bp。测序扩增片段应包含所有全部编码区,且测序引物序列应距编码区40bp左右,引物序列见表1。
1.3.3 PCR扩增 反应体系为50μl,含10×PCR 缓冲液5μl,250μmoldNTPs(AmershamPharmcia),正反向引物各50ng,ExTag酶2U (TaKaRa),gDNA0.1μg。PCR反应在9600型PCR扩增仪(ABI)上完成,反应条件为:95℃预变性4min,95℃变性45s,60~55℃复性40s(根据不同引物调整),72℃延伸60s,30个循环,反应终止后再72℃延伸10min,4℃保存。
1.3.4 直接测序 使用ABI 3730XL型DNA测序仪,测序引物为扩增引物。
1.3.5 使用BLASTn程序在线将测序结果与含该基因的基因组序列相比较(http://blast.ncbi.nlm.nih.gov/Blast.cgi-PROGRAM=blastn&PAGE-TYPE=BlastSearch&LINK-LOC=blasthome)。引物序列扩增片断长度及退火温度见表1。
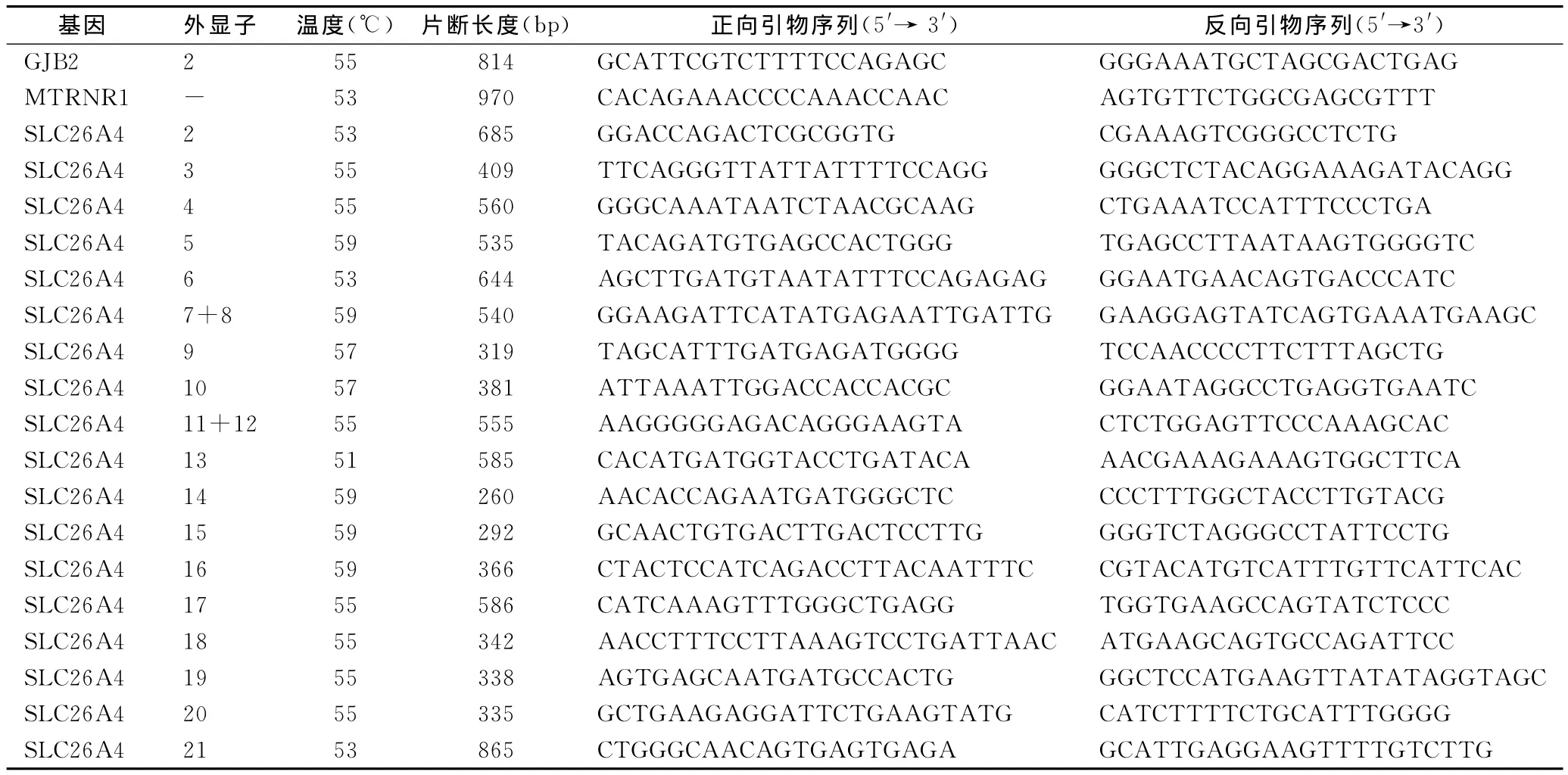
表1 引物序列、扩增片断长度及退火温度Table 1 The detail information of primer
2 结果
本研究中,27例确诊重度-极重度非综合征型耳聋患者中21例为散发病例,6例家族中有其他成员罹患耳聋,全部为语前聋,且没有氨基糖甙类药物使用史。在所有27例患者中,未发现有GJB2、SLC26A4、MTRNR1(12SrRNA)三个基因编码区携带任何致病突变。在101例种族匹配的正常对照者中,也未发现此三个基因的致病突变。本研究27例患者中,发现在GJB2基因中的2种常见多态性改变V27I(等位基因频率为27.8%)和 E114G(等位基因频率为16.7%),见图1。在101例正常对照者中,也发现在GJB2基因中的2种常见多态性改变V27I(等位基因频率为19.8%)和E114G(等位基因频率为14.9%)。
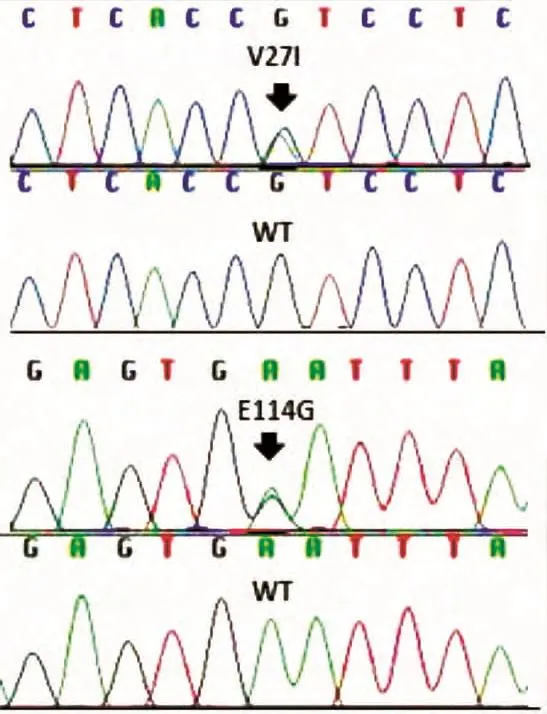
图1 本研究中发现的GJB2基因两种多态性改变V27I和E114G的测序峰图Figure 1 The peak figure of V27Iand E114GSNP in GJB2
3 讨论
耳聋是交流障碍最常见的病因,全球至少有二亿五千万人罹患中度以上听力损失,我国听力言语残疾人口已达到2000余万,居各种残疾之首,且每年新增聋儿3万。耳聋的病因复杂,环境和遗传因素都可致病。上世纪90年代以来,随着耳聋分子病因学研究的深入,遗传因素在耳聋发病中的地位得到重视,在许多国家已将遗传性耳聋的基因诊断列入常规临床检测项目。耳聋基因具有高度异质性,即使在GJB2、SLC26A4、MTRNR1(12SrRNA)三个最主要致聋基因中,基因突变谱在各种族中有很大差异,以GJB2基因为例,每个种族中都有高发的致病突变,如35delG突变在高加索人中[5,6];167delT突变在德系犹 太 人中[7];235delC突 变 在 中 国、韩 国 和 日 本 人 中[8,9];R143W突变在非洲人中[10]。这种等位基因的种族多样性更可能是由先证者效应引起,而非是突变热点[11]。
在最近的一项关于南方和北方典型汉族人群中的耳聋分子病因学研究显示,GJB2基因突变导致的耳聋占18.31%,SLC26A4基因突变导致的耳聋占13.73%,MTRNR1(12SrRNA)基因突变导致的耳聋占1.76%[12],其结果符合以往关于中国人中的耳聋分子病因学研究[3,4]。尚未发现在中国人口占主要多数的汉、蒙、满、回、壮和苗族中,遗传性耳聋的分子病因谱有明显的差别。
但是在另一项针对西藏114例藏族耳聋病人参加的分子病因学研究中,只发现2人携带杂合性GJB2基因的致病突变,没有病人同时携带两个致病突变;也没有发现SLC26A4基因明确的致病突变,且没有病人同时携带两个突变。这项研究第一次发现在大部分人群中最常见的GJB2和SLC26A4耳聋基因不是藏族耳聋病人的主要致病基因[13]。本研究中27例确诊为重度-极重度非综合征型耳聋患者中未发现有GJB2、SLC26A4 2个基因编码区携带任何致病突变,进一步证实了上述研究的结果。而本研究没有发现线粒体基因突变,可能由于本研究样本量较少有关,因此不能否定线粒体基因突变在藏族耳聋患者中的致病作用。因此,可以确认藏族耳聋病人拥有不同于其他种族的分子病因学特点。随着二代测序技术的发展和普及,进一步探索并发现导致藏族人群中非综合征性耳聋的病因构成将是我们下一步的工作。
西藏地区由于长期受特殊地理环境、历史以及文化等各种因素的影响,具有诸多特点:①西藏地处高原环境,平均海拔3500~4000m,常年氧分压低,含氧量仅占平原的50%~60%左右,这种低氧环境对机体各脏器均有不同程度的影响。有研究表明,低氧条件对人体听力影响最大。②农牧民人口众多,社会经济较落后,平均受教育程度较低等现状,导致对新生儿听力健康观念差。③由于特殊的原因,链霉素及庆大霉素等耳毒性药物在藏区仍广泛使用,故药物性耳聋也成为西藏地区耳聋的主要原因之一。④由于受当地风俗习惯的影响,仍存在着近亲结婚的现象,致遗传性耳聋发病率较高,且人口分散,存在大量隔离人群。⑤高原地区新生儿缺血缺氧性脑病高发病率和农牧民孕妇营养不良者居多,导致极低体重儿的高出生率等诸多因素,高危新生儿发生听力障碍而产生叠加效应。
根据2006年第二次全国残疾人抽样调查结果,在西藏自治区听力残疾人占人口总数的1.65%,略高于全国平均水平(1.54%)。考虑到西藏地区,环境因素在耳聋的病因构成中占据重要位置,因此,藏族人群由于地域限制造成的隔离性,决定了在耳聋分子病因学上与其他种族可能存在较大差异。鉴于西藏自治区有着巨大的聋人群体,且耳聋病因学研究起步较晚,对于遗传因素在耳聋病因构成中的地位研究还不多,因此,加快西藏地区的耳聋分子病因学研究,将进一步揭示藏族人群的耳聋病因学特点,并可促进本地区的聋病防治工作。
4 结论
GJB2、SLC26A4、MTRNR1基因是许多种族中最常见的耳聋基因,但每个种族中都有不同高发的致病突变,在各种族中有很大差异。国内耳聋分子病因学研究尚未发现在中国人口占主要多数的汉、蒙、满、回、壮和苗族中,遗传性耳聋的分子病因谱有明显的差别。但我们的研究显示,这三个基因并不是藏族耳聋病人的主要致病基因。这可能是由于藏族人群地域限制造成的隔离性,导致在耳聋分子病因学上,与其他种族可能存在较大的差异。
[1] Morton NE.Genetic epidemiology of hearing impairment[J].Ann N Y Acad Sci,1991,630(1):16-31.
[2] Dai P,Yu F,Han B,et al.GJB2mutation spectrum in 2063 Chinese patients with nonsyndromic hearing impairment[J].J Transl Med,2009,7(1):26-38.
[3] Ji YB,Han DY,Lan L,et al.Molecular epidemiological analysis of mitochondrial DNA12SrRNA A1555G, GJB2,and SLC26A4mutations in sporadic outpatients with nonsyndromic sensorineural hearing loss in China[J].Acta Otolaryngol,2011,131(2):124-129.
[4] Yuan Y,Guo W,Tang J,et al.Molecular epidemiology and functional assessment of novel allelic variants of SLC26A4in non-syndromic hearing loss patients with enlarged vestibular aqueduct in China[J].PLoS One,2012,7(11):e49984.
[5] Zelante L,Gasparini P,Estivill X,et al.Connexin26mutations associated with the most common form of non-syndromic neurosensory autosomal recessive deafness(DFNB1)in Mediterraneans[J].Hum Mol Genet,1997,6(9):1605-1609.
[6] Murgia A,Orzan E,Polli R,et al.Cx26deafness:mutation analysis and clinical variability[J].J Med Genet,1999,36(11):829-832.
[7] Morell RJ,Kim HJ,Hood LJ,et al.Mutations in the connexin 26gene(GJB2)among Ashkenazi Jews with nonsyndromic recessive deafness[J].N Engl J Med,1998,339(21):1500-1505.
[8] Abe S,Usami S,Shinkawa H,et al.Prevalent connexin 26 gene(GJB2)mutations in Japanese[J].J Med Genet,2000,37(1):41-43.
[9] Liu XZ,Xia XJ,Ke XM,et al.The prevalence of connexin 26(GJB2)mutations in the Chinese population[J].Hum Genet,2002,111(4-5):394-397.
[10] Brobby GW,Muller-Myhsok B,Horstmann RD.Connexin 26 R143Wmutation associated with recessive nonsyndromic sensorineural deafness in Africa[J].N Engl J Med,1998,338(8):548-550.
[11] Van Laer L,Coucke P,Mueller RF,et al.A common founder for the 35delG GJB2gene mutation in connexin 26hearing impairment[J].J Med Genet,2001,38(8):515-518.
[12] Yuan Y,You Y,Huang D,et al.Comprehensive molecular etiology analysis of nonsyndromic hearing impairment from typical areas in China[J].J Transl Med,2009,7(1):79-91.
[13] Yuan Y,Zhang X,Huang S,et al.Common molecular etiologies are rare in nonsyndromic Tibetan Chinese patients with hearing impairment[J].PLoS One,2012,7(2):e30720.
