吐温对红曲黄色素合成代谢的影响
2014-02-27钟海雁
周 波,田 园,钟海雁
(1.稻谷及副产物深加工国家工程实验室,湖南长沙410004;2.粮油深加工与品质控制湖南省重点实验室,湖南长沙410004;3.中南林业科技大学食品科学与工程学院,湖南长沙410004)
吐温对红曲黄色素合成代谢的影响
周波1,2,3,田园1,2,3,钟海雁1,2,3
(1.稻谷及副产物深加工国家工程实验室,湖南长沙410004;2.粮油深加工与品质控制湖南省重点实验室,湖南长沙410004;3.中南林业科技大学食品科学与工程学院,湖南长沙410004)
研究了四种吐温对红曲霉突变菌株合成代谢黄色素和橘霉素的影响。结果表明:吐温20和吐温80对黄色素的合成代谢有一定的促进作用,胞内黄色素生成量分别提高12.30%和9.32%,对橘霉素的合成代谢有一定的消除效果,但效果不明显,而吐温40和吐温60对橘霉素的合成代谢有明显的促进影响,分别能提高橘霉素生成量111.36%和317.44%,对黄色素的合成代谢影响出现不利影响,分别能使胞内黄色素生成量下降8.33%和15.23%。研究结果在一定程度上为红曲黄色素工业化液态发酵生产提供一定的理论依据和技术参考。
吐温,橘霉素,红曲黄色素,红曲霉突变菌株
红曲发酵历史悠久,关于红曲方面的研究主要集中在次级代谢产物的开发利用上,许多学者对红曲霉菌代谢产物种类及其功能性等方面做了较多研究,其中红曲色素是研究较多且应用广泛的主要次级代谢产物[1-2]。红曲色素作为食品着色剂,具有上千年使用历史的原因之一就是其不具生物毒性。目前完全确定结构的红曲色素有十几种,其中发现并确定结构的红曲黄色素就有六种,如安卡红曲黄素(Ankaflavin)和红曲素(Monascin)[3]、Xanthomonasin A和Xanthomonasin B[3]、monascusones A和monascusones B[4]。红曲黄色素不仅因其很好的耐热性和耐酸性而广受食品生产者和研究者的喜爱,同时还具有一定的生物活性,如Monascin及其衍生物对小鼠T细胞有免疫抑制作用[5],能减低皮肤癌的出现几率[6];ankaflavin通过调控细胞凋亡相关联的机制对癌细胞株有选择性细胞毒性等[7],但因菌种的缺乏,有关红曲黄色素工业化生产的研究报道较少[8-10]。
本实验室通过物理化学诱变获得一株高产黄色素的红曲霉突变菌株(Monascus anka mutant MYM 2)[9],并对其合成代谢黄色素的特性进行了一定的研究,也证实其合成代谢的黄色素是安卡红曲黄素(Ankaflavine)和红曲素(Monascin)[10-13]。这说明红曲霉突变菌株合成代谢红曲色素和橘霉素的机理跟其他红曲霉菌种合成代谢色素和橘霉素的机理基本一样。在本文中,根据红曲色素和橘霉素合成代谢的相关报道[4,14-17],来研究表面活性剂吐温对红曲霉突变菌株合成代谢黄色素和橘霉素的影响,希望能筛选出一种或几种能提高黄色素的合成代谢量以及消除橘霉素的合成代谢的化学物质,从而为实现红曲黄色素的工业化生产提供一定的技术支持。
1 材料与方法
1.1材料与仪器
红曲霉突变株菌(Monascus anka mutant) 华南理工大学生化工程研究室选育并保存;吐温均为Sigma进口分装;其余化学试剂均从广州市化学试剂厂购买,均为分析纯;斜面种培养基:麦芽汁琼脂培养基(麦芽汁由广东珠江啤酒有限公司提供);种子培养基(g/L):玉米粉30,硝酸钠3,FeSO4·7H2O 0.01,磷酸二氢钾4,pH6.0;发酵培养基(g/L):氯化铵15,可溶性淀粉70,葡萄糖20,玉米浆10,KH2PO45,初始pH 4.0。
2802SUV/VIS型紫外可见光分光光度计上海尤尼科斯科学仪器有限公司;C25KC型全温摇床美国New Brunswick Scientific公司;SPX-250B-Z型生化培养箱上海博迅实业有限公司医疗设备厂;ER-180A型电子天平日本A&D公司;Aglient 1100液相色谱美国安捷伦科技有限公司;Scientz IID超声波细胞破碎机宁波新芝生物科技股份责任有限公司。
1.2实验方法
斜面种在32℃下培养2~3d;种子液在32℃,160r/m in培养2~3d;摇瓶发酵条件为250m L三角瓶装30m L发酵培养基,发酵培养基中添加吐温种类(Tween 20、Tween 40、Tween 60、Tween 80)和浓度(0、0.1、0.3、0.5、0.7、0.9、1.2g/L)根据实验设计需要变化,发酵培养基灭菌接种后160r/m in,32℃下培养7d,所有发酵实验均设计三个平行实验,计算平均值。
1.2.1胞外色价测定取一定体积的发酵液,4000r/m in离心20m in,上清液经定性滤纸过滤,滤液经稀释至适当倍数,用分光光度计在波长410nm下测定其OD410值,此值乘以稀释倍数即为胞外黄色素色价;在波长510nm下测得OD510乘以稀释倍数即为胞外红色素色价,色价单位用U/m L表示。
1.2.2胞内色价测定离心后的菌体沉淀用70%乙醇抽提1h,然后4000r/m in离心20m in,上清液过滤,滤液经稀释至适当倍数,测定其OD410,此值乘以稀释倍数即为胞内黄色素色价;测得的OD510值乘以稀释倍数即为胞内红色素色价,色价单位用U/m L表示。
总黄色素色价为胞外黄色素色价与胞内黄色素色价之和。
1.2.3细胞干重(DCW)的测定吸取5m L发酵液,4000r/min离心20min,除去上清液,沉淀用蒸馏水洗涤,4000r/m in离心20m in,除去上清液,重复三次后沉淀于80℃烘箱中烘至恒重。黄色素相对于细胞干重得率为黄色素色价与细胞干重的比值。
1.2.4橘霉素的检测橘霉素标准曲线的制作和测定根据许赣荣报道的稍作修改[18]。5m L发酵液用5m L 95%乙醇抽提1h,通过超声波细胞破碎机(650W,变幅杆¢8,破碎时间30s,间隔时间30s,总时间5m in)破碎后于4000r/min离心20min,离心上清液通过滤纸过滤,滤液再用0.45μm有机系膜过滤,吸取滤液20μL来进行橘霉素色谱检测。HPLC检测条件:Aglient 1100的高效液相,柱为Eclipse XDB reverse C18柱(250mm× 4.6mm,5μm颗粒大小),柱温28℃,检测器为紫外检测器(λ=254nm);流动相(用色谱纯磷酸来调pH至2.5)为乙腈∶水(35∶65,v∶v),流动相流速为1.0m L/m in。橘霉素测定标准曲线为:(稀释倍数为100~300),其中为峰面积,为橘霉素浓度(mg/L)。
1.3数据分析
所有实验数据均为重复三次的平均值。用Origin 8.0进行作图,用SPSS 19.0进行数据单因素方差分析。
2 结果与分析
2.1吐温80对红曲霉突变菌株合成代谢黄色素和橘霉素的影响
从图1得知,0.5g/L的吐温80添加量有利于胞内黄色素的合成代谢,此时胞内黄色素色价为84.04U/m L,比没添加吐温80时的发酵情况高出9.32%,同样总黄色素的积累量也高出7.76%。再增加吐温80的添加量时,反倒不利于黄色素的合成代谢。

图1 吐温80对红曲黄色素合成代谢的影响Fig.1 Effectof Tween 80 on Monascus yellow pigments production
从表1得知,吐温80的添加能明显消除橘霉素的合成代谢,当添加1.2g/L的吐温80时,发酵液中检测不到橘霉素的存在。在一定范围内,添加一定量的吐温80有利于红曲霉突变菌株的生长,但影响不明显。吐温80对黄色素得率影响不是很大,都维持在3500~4000U/g之间。

表1 吐温80对红曲霉菌突变菌株生长和代谢的影响Table 1 Effectof Tween 80 on growth andmetabolism of Monascus anka mutant
有研究表明,添加一定量的Tween 80(0.4%)既不影响培养基中糖的消耗,也不延迟菌的生长,但能明显的提高红色素的产物得率(色价/细胞干重),是未添加时的6~8倍,当浓度低于或高于0.4%时,提高程度就不明显,但是就能明显影响菌的生长。进一步实验表明,添加适量的Tween 80并不是增加红曲菌细胞膜的通透性来提高色素的分泌能力,而应该是通过更复杂的代谢途径来影响色素的生成[15],而本文研究表明吐温80对黄色素得率影响不明显。
2.2吐温20对红曲霉突变菌株合成代谢黄色素和橘霉素的影响
添加一定量吐温20对胞外黄色素的合成代谢影响不是很明显,但是对胞内黄色素合成代谢的影响比较明显,从而对总黄色素积累量的影响也比较明显。当吐温20添加浓度为0.3g/L时,胞内黄色素的合成代谢量达到最大,高出没添加吐温20发酵时的11.84U/m L,提高了12.30%,总黄色素色价提高12.49%,但对胞外黄色素合成代谢量影响不明显(见图2)。

图2 吐温20对红曲黄色素合成代谢的影响Fig.2 Effectof Tween 20 on Monascus yellow pigments production
从表2中得知,吐温20的添加能明显消除了橘霉素的合成代谢,当添加0.9g/L的吐温20时,发酵液中检测不到橘霉素的存在。对红曲霉突变菌株的生长和黄色素得率的影响不明显(表2)。
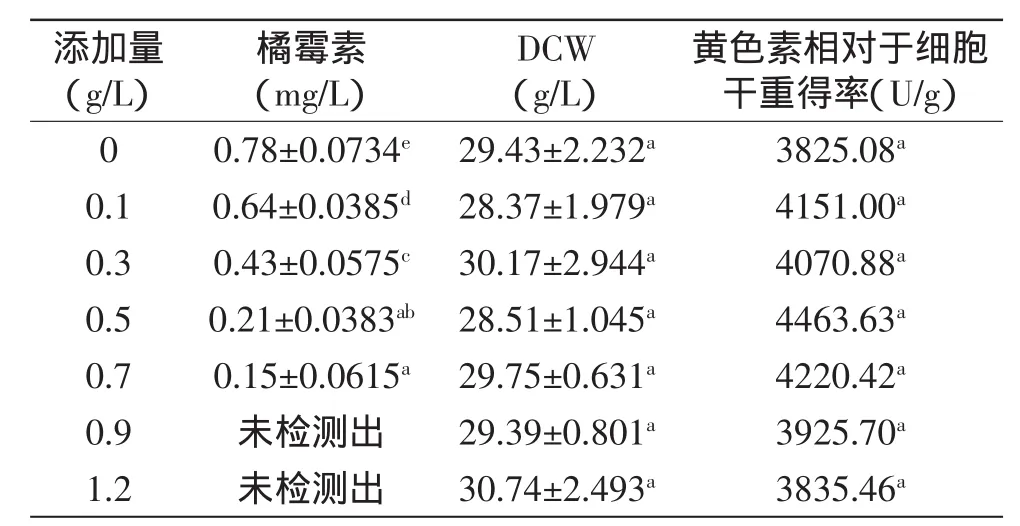
表2 吐温20对红曲霉菌突变菌株生长和代谢的影响Table 2 Effect of Tween 20 on growth and metabolism of Monascus anka mutant
吐温20对胞内黄色素合成代谢有一定的有利影响,对橘霉素的合成代谢起到一定的消除效果,但是对突变菌株的生长影响不是很明显(表2)。吐温20在一定程度上有利于黄色素的合成代谢是因为其作用在黄色素合成代谢途径上的结果,而不是促使菌大量生长导致黄色素积累量的增多。吐温20对橘霉素的消除效果很可能是因为吐温20在橘霉素合成代谢途径上起到一定的抑制作用而导致的。
2.3其他表明活性剂对红曲霉突变菌株合成代谢黄色素和橘霉素的影响
还研究了其他一些表面活性剂对红曲霉突变菌株合成代谢黄色素和橘霉素的影响。结果表明它们对黄色素的合成代谢有不利影响,同时对橘霉素合成代谢抑制效果不明显,甚至有促进作用(见表3和表4)。如吐温60能提高橘霉素含量317.44%,使胞内黄色素色价下降15.23%,胞外黄色素色价下降23.81%,总黄色素色价下降14.09%;吐温40能提高橘霉素含量111.36%,使胞内黄色素色价下降8.33%,胞外黄色素色价下降2.56%,总黄色素色价下降6.37%。吐温60和40吐温促进橘霉素的合成代谢或许是从代谢途径上促进橘霉素合成代谢,也许是增大了菌体膜的通透性,从而增加了橘霉素的分泌量。

表3 吐温60对红曲霉菌突变菌株生长和代谢的影响Table 3 Effectof Tween 60 on growth and metabolism of Monascus anka mutant

表4 吐温40对红曲霉菌突变菌株生长和代谢的影响Table 4 Effectof Tween 40 on growth and metabolism of Monascus anka mutant
3 讨论
吐温是聚合山梨醇结合不同的脂肪酸后再与不同浓度的环氧乙烷缩聚而制得,其中吐温20是结合月桂酸,吐温40是结合棕榈酸,吐温60是结合硬脂酸,吐温80是结合油酸。根据吐温的HLB值(吐温80、吐温60、吐温40、吐温20的HLB分别为15、14.9、15.6、16.7)得知,在本文研究中所用的吐温均为亲水性表面活性剂,但吐温20的亲水性最强。其中吐温80具有很强的破裂细胞膜的作用而引起刺激性、溶血性和致敏性(组胺释放)。吐温20有复性抗原的作用,可提高特异性的识别能力。
随着亲水性越强,胞外黄色素色价增加(见图1和图2),这说明亲水性越强的吐温有利于胞外色素(水溶性)的生成或分泌,而亲水性较差的吐温(如吐温80)有利于胞内黄色素(脂溶性)的合成代谢。这说明化学物质的亲水性强弱对于胞外和胞内黄色素的生成量有一定的影响,是影响细胞膜从而影响了黄色素的分泌或改变黄色素的分子空间结构从而影响黄色素的水溶性或脂溶性或其他原因,这些都还有待进一步的研究。
从细胞生长量角度而言,本文中所用的吐温对红曲霉突变菌株的生长没有明显的影响,这说明吐温促进或减少黄色素的代谢生成量并不是因为微生物菌体的增加或减少造成的(见表1~表4)。吐温80和吐温20对黄色素的合成代谢有一定的影响,并且能明显消除橘霉素的合成代谢(见表1和表2)。以上所有实验结果表明,吐温对红曲霉突变菌株合成代谢橘霉素和黄色素的影响不能简单从其理化特征来解释,在复杂的培养系统中吐温的存在对红曲菌次级代谢产物的合成代谢影响出现迭代性和综合性,应该是从代谢合成途径以及细胞膜的通透性方面来影响次级代谢产物的生成及其菌本身的生长。虽然有报道添加适量的Tween 80并不是增加红曲菌细胞膜的通透性来提高红色素的分泌能力,而应该是通过更复杂的代谢途径来影响红色素的生成[15],但是本文作者认为目标代谢产物及研究对象的不同,吐温的影响效果不一样,吐温对胞外黄色素的分泌应该与吐温的亲水性有关系。不论橘霉素还是黄色素的合成代谢,吐温对其的影响应该是从代谢途径或分泌途径上来实施的,而不是因为增加或减少微生物菌体量来影响的。
但是最近有人研究了几种表面活性剂对红曲菌种合成代谢色素的影响,发现除了Triton X-100对色素的合成有明显影响之外,其他表面活性剂除了吐温20外,一定浓度的吐温对色素的合成有一定的促进作用,但影响不明显[19]。以此进一步研究发现Triton X-100通过影响红曲菌细胞膜脂质的不饱和度,有利于色素的分泌,提高胞外色素的得率,且在一定程度上能消除橘霉素的生成[19-22]。但是在本文中为什么吐温20和80对黄色素的合成代谢有促进作用,对橘霉素的合成代谢有消除效果,而吐温40和60呈现完全相反的结果,其原因还有待进一步的研究,如果结合蛋白质组学和代谢组学来研究其橘霉素和色素的代谢机理也许是一个很不错的选择。
4 结论
吐温20和吐温80对黄色素的合成代谢有一定的促进作用,对橘霉素的合成代谢有一定的消除效果,但效果不明显,而吐温40和吐温60对橘霉素的合成代谢有明显的促进影响,对黄色素的合成代谢影响出现不利影响。研究结果在一定程度上为红曲黄色素工业化液态发酵生产提供一定的理论依据和技术参考。
[1]Blaine A,Pfeifer,Chaitan Khosla.Biosynthesis of polyketide in heterologous hosts[J].Microbiology and Molecular Biology Reviews,2001,65(1):106-118.
[2]David A,Hopwood.Genetic contributions to understanding polyketidesynthesis[J].ChemicalReviews,1997,97(7):2470-2497.
[3]Yii-Lih Lin,Teng-Hsu Wang,Min-Hsiung Lee,et al. Biologicallyactivecomponentsandnutraceuticalsinthe Monascus-fermented rice:A review[J].ApplMicrobiol Biotechnol,2008,77:965-973.
[4]Jongrungruangchok,Kittakoop SP,Yongsmith B.Azaphilone pigments from a yellow mutant of the fungus Monascus kaoliang [J].JPhytochemistry,2004,65:2569-2575.
[5]Martinkova L,Patakova Juzlova P,Kren V,et al.Biological activities of oligoketide pigments of Monascus purpureus[J].Food Additive Contaminent,1999,16:15-24.
[6]Akihisa T,Tokuda H,Ukiya M,et al.Anti-tumorinitiating effects ofmonascin,an azaphilonoid pigment from the extract of Monascus pilosus fermented rice(red-mold rice)[J].Chem Biodivers,2005,2:1305-1309.
[7]Su NW,Lin YL,Lee MH,et al.Ankaflavin from Monascus fermented red rice exhibits selective cytotoxic effect and induces cell death on Hep G2 cells[J].J Agric Food Chem,2005,53:1949-1954.
[8]Yongsmith B,Krairak S,Bavavoda R.Production of yellow pigments in submerged culture of amutant of Monascus spp[J].J Ferment Bioeng,1994,78:223-228.
[9]周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1909-1914.
[10]Bo zhou,Jufang Wang,Yuewu Pu,et al.Optimization of culture medium for yellow pigments production with Monascus anka mutant using response surface methodology[J].European Food Research and Technology,2009,228(6):895-901.
[11]周波,朱明军,王菊芳,等.铵盐对红曲黄色素、红色素及橘霉素代谢形成的影响[J].重庆工学院学报:自然科学版,2009,23(1):46-53.
[12]周波,杨玲,崔思颖,等.响应面法提高红曲黄色素色调[J].华南理工大学学报:自然科学版,2008,36(11):91-95.
[13]周波,浦跃武,朱明军,等.氮源对红曲霉突变菌株产黄色素的影响[J].现代食品科技,2008,24(2):123-127.
[14]Hassan Hajjaj,PBlanc J.Biosynthetic pathway of citrinin in the filamentous,fungus Monascus ruber as revealed by 13C nuelear magneticresouance[J].AppledandEnvironmental Microbiology,1999(1):311-314.
[15]Siu-Wai Chiu,Yam-Kau Poon.Submerged production of Monascus pigments[J].Mycologia,1993,85(2):214-218.
[16]周波,朱明军,吴振强,等.金属盐对红曲霉突变菌株合成代谢黄色素影响的研究[J].现代食品科技,2010,26(4):342-347.
[17]Hassan Hajjaj,Alain Klaebe,Gerard Goma,et al.Medium chain fatty acids affect citrinin production in the filamentous fungusMonascusrubber[J].AppliedandEnvironmentalMicrobiology,2000,66(3):1120-1125.
[18]Xu Ganrong,Chen Yun,Yu Huiling.HPLC fluorescence method for determination of citrinin from Monascus cultures[J]. Archiv fur Lebensmittelhygiene,2003,4,82-84.
[19]YonghuiWang,Bobo Zhang,Liping Lu,et al.Enhanced production of pigments by addition of surfactants in submerged fermentation of Monascus purpureus H1102[J].JSci Food Agric,2013,93:3339-3344.
[20]Blyu Kang,Xuehong Zhang,Zhenqiang Wu,et al. Solubilization capacity of nonionic surfactantmicelles exhibiting strong influence on export of intracellular pigments in Monascus fermentation[J].Microbial Biotechnology,2013(6):540-550.
[21]ZhiqiangHu,XuehongZhang,ZhenqiangWu,etal. Perstraction of intracellular pigments by submerged cultivation of Monascus in nonionic surfactant micelle aqueous solution[J]. Appl Microbiol Biotechnol,2012,94:81-89.
[22]Blyu Kang,Xuehong Zhang,Zhenqiang Wu,et al.Effect of pHand nonionic surfactant on profile of intracellular and extracellular Monascus pigments[J].Process Biochemistry,2013,48(5-6):759-767.
Effect of Tween on Monascus yellow pigment anabolic
ZHOU Bo1,2,3,TIAN Yuan1,2,3,ZHONG Hai-yan1,2,3
(1.National Engineering Laboratory of Rice and by-products Processing,Changsha 410004,China;2.Hunan Province Key Laboratory of Grain&Oil Processing and Quality Control,Changsha 410004,China;3.School of Food Science and Engineering,Central South University of Forestry and Technology,Changsha 410004,China)
Four kinds of Tween had been used to influence on Monascus yellow pigments and citrinin p roduction by Monascus anka mutant and the results showed that intracellular Monascus yellow p igments p roduc tion had been im p roved w ith 12.30%and 9.32%by add ing Tween 20 and Tween 80,respectively,and elim ination for citrinin p roduction,butallwas notobviously.On the contrary,As far as Tween 40 and Tween 60 were concerned,citrinin p roduc tion had been increased w ith 111.36%and 317.44%and intracellular Monascus yellow p igments had been decreased w ith 8.33%and 15.23%by Monascus anka mutant,respectively.The results in this paper could p rovide theoretical exp lanation and technical reference for the monascus yellow pigments submerge p roduction w ith industrialscale.
Tween;citrinin;Monascus yellow pigments;Monascus anka mutant
TS201.1
A
1002-0306(2014)18-0203-05
10.13386/j.issn1002-0306.2014.18.035
2013-11-19
周波(1978-),男,副教授,研究方向:微生物发酵。
国家自然科学基金(31301550);湖南省教育厅科学研究项目(14C1185);中南林业科技大学青年科学基金。
