海带岩藻聚糖硫酸酯降解及基本结构分析
2014-02-27郭峰君
郭峰君,胡 靖,赵 雪
(中国海洋大学食品科学与工程学院,山东青岛266003)
海带岩藻聚糖硫酸酯降解及基本结构分析
郭峰君,胡 靖,赵 雪*
(中国海洋大学食品科学与工程学院,山东青岛266003)
用离子交换色谱法对海带岩藻聚糖硫酸酯粗糖进行分离纯化,然后采用铜-过氧化氢氧化降解法获得低分子量多糖,对降解条件和产物进行研究。得出结论:离子交换色谱中加入一定浓度氯化钠,可以获得高硫酸根和岩藻糖含量的岩藻聚糖硫酸酯。红外光谱和核磁共振分析确定硫酸根的位置在C2或C3上,糖构型属于α-D-吡喃糖。研究表明自由基氧化降解海带岩藻聚糖硫酸酯的降解条件与其硫酸根和岩藻糖含量有关,硫酸根含量越高,多糖越难以降解。最优降解条件:60℃下,500μL 20mg/mL糖溶液,加入0.0267mol/L乙酸铜,F3、F4加10μL 15%H2O2,F5加50μL 15%H2O2,反应4h。采用PAGE凝胶电泳方法可以很好的分析氧化降解产物的分子量分布。
海带,岩藻聚糖硫酸酯,氧化降解,聚丙烯酰胺凝胶电泳
岩藻聚糖硫酸酯是褐藻、海参和海胆中特有的一种岩藻糖为主的硫酸酯多糖[1]。海参和海胆的岩藻聚糖硫酸酯主要是直链的岩藻多糖,没有支链,而且岩藻糖的含量占到总糖含量的90%以上。但是褐藻中的岩藻聚糖硫酸酯的糖组成复杂,相对分子质量从几万到几十万都有,除了岩藻糖,还含有半乳糖、甘露糖、葡萄糖、木糖、乙酰氨基葡萄糖和葡萄糖醛酸,其化学组成和结构随海藻的种类、生长季节和提取方法的不同而不同[2]。随着活性研究的深入,发现多糖的高级结构、侧链的位置以及分支的密度、单糖糖苷键的结合形式、分子量、聚合度以及硫酸根的位置和含量对活性的影响较大[3]。Alban发现高分子量硫酸多糖很难被吸收,而低分子量多糖溶解性好、黏度小、吸收利用率高,能显著提高多糖的生物活性[4]。海带硫酸多糖降解发法主要有酸降解、碱降解、酶降解以及自由基降解方法[5]。张全斌和Alain Nardella对自由基降解产物分析,得到的低分子多糖活性也较高[6]。本实验室前期采用H2O2-Cu2+自由基降解法,连同分步超滤,制备了低分子量岩藻聚糖硫酸酯,具有很好的抗血栓、抗病毒、提高免疫力、抗氧化和保护肠胃的功能[7-10]。但是对自由基氧化降解岩藻聚糖硫酸酯的降解条件和产物的结构分析还需进一步的研究。本文对不同结构的岩藻聚糖硫酸酯的结构和降解活性进行研究,并采用聚丙烯酰胺凝胶电泳分析降解产物的分子量。
1 材料与方法
1.1 材料与仪器
海带岩藻聚糖硫酸酯粗糖 日照洁晶海洋生物技术有限公司;Q-Sepharose FF树脂 美国Amersham Parmacia Biotech公司;葡聚糖标准品(180u、2.5、4.6、7.1、10ku)、单糖标准品(岩藻糖、半乳糖、甘露糖、鼠李糖、木糖、乳糖、葡萄糖醛酸、乙酰氨基葡萄糖) 美国Sigma公司;中空纤维膜(6ku) 天津膜天膜科技有限公司。
DYCZ-24DN迷你双垂直电泳仪 北京六一仪器厂;Aglient1100高效液相色谱仪 美国Aglient科技有限公司;ICS2000离子色谱仪 美国DIONEX公司;Nicolet-Nexus 470红外光谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 阴离子交换色谱法分离纯化岩藻聚糖硫酸酯
取岩藻聚糖硫酸酯粗糖300mg溶解于PBS缓冲液(0.05mol/L,pH7.8),然后加入到Q-Sepharose FF强阴离子交换色谱柱(300m L,2.6×30cm)。待多糖吸附后,依次用0、0.5、1.0、1.5、2、2.5mol/L NaCl(PBS缓冲液溶解)梯度洗脱,用硫酸-苯酚法检测洗脱液的糖含量,分别收集各组分,用截留分子量为10~12ku的透析袋透析脱盐,用AgNO3检验脱盐完毕后,旋蒸浓缩,冻干后获得样品,分别命名为F1、F2、F3、F4、F5、F6。分别称量获得的F1~F6的样品质量,其与300mg的比值即为得率。
1.2.2 海带岩藻聚糖硫酸酯化学组成分析 总糖含量采用苯酚硫酸法测定[11]。
1.2.2.1 硫酸根含量测定 采用离子色谱法[12]。选用Dionex离子色谱仪,Ionpac AS11-HC(4×250mm)为分离柱,Dionex Ionpac AG11-HC(4×50mm)为保护柱,ASRSULTRAⅡ为抑制器,抑制电流为238mA,进样体积为25μL,30mmol/L KOH为淋洗液,控制流速为1.0m L/min。
1.2.2.2 分子量测定 采用高效液相色谱法[13]。采用Agilent 1100高效液相色谱仪,选用TSK-gel G2500 PWxl色谱柱(Tosoh Bioscience),用0.2mol/L的NaCl作为流动相,洗脱速度为0.5m L/m in,保持柱温40℃,采用示差检测器(G1362A),以Mw为180u、2.5、4.6、7.1、10ku右旋糖酐为标准品,做多糖分子量对数与保留时间的标准曲线,得到分子量计算公式:lgMw=-0.2646tR+ 7.0746(r=0.986,tR为保留时间)。并根据GPC软件得到待测多糖的重均分子量(Mw)、数均分子量(Mn)和分配系数D=Mw/Mn。
1.2.2.3 单糖组成测定 采用柱前衍生高效液相色谱法[14-15]。使用Agilent1100高效液相色谱仪,ZORBAX Eclipse色谱柱XDB-C18分离柱(4.6×250mm,5μm),245nm紫外检测器(DAD),控制流速为1.0m L/min,保持柱温为25℃,采用流动相A:10%(V/V)乙腈,0.1mol/L乙酸铵-乙酸缓冲液(pH 5.5)和流动相B:25%(V/V)乙腈,0.1mol/L乙酸铵-乙酸缓冲液(pH 5.5),时间梯度:0→40m in,浓度梯度:流动相B 40%→100%。
1.2.2.4 红外光谱分析[16]将干燥的各待测样品与KBr压制成片,使用Nicolet-Nexus 470傅立叶变换红外光谱仪,扫描600~4000cm-1波长范围内的光谱吸收值。
1.2.2.5 核磁共振波谱法[17]取多糖样品F3、F4和F5各100mg分别装入核磁管中,用0.5m L重水溶解,然后冻干,再用重水溶液溶解后进行检测,以HDO峰为内标进行光谱分析。
1.2.3 丙烯酰胺凝胶电泳法(PAGE)分析多糖的分子量 100mmol硼酸,100mmol Tris和1mmol EDTA,用水溶解定容至1L,调pH为8.3,配制成外室缓冲液。1.24mol甘氨酸、200mmol Tris,用水溶解定容至1L,调pH为8.3,配制成内室缓冲液。丙烯酰胺、甲叉双丙烯酰胺和蔗糖用外室缓冲液配成15%分离胶和5%浓缩胶,脱气备用。制胶时,15%分离胶:分离胶5m L,APS 15μL,TEMED 5μL;5%浓缩胶:浓缩胶1m L,APS 45μL,TEMED 1.5μL。电泳分析时电压200V,时间30~50m in。然后将分离胶用0.5%阿利新蓝染色30m in后,用0.2%乙酸脱色。硫酸软骨素标准品凝胶采用UNSCANIT软件(Silk科技公司,美国)扫描,根据硫酸软骨素的分子量和电泳距离,计算出标准曲线。
1.3 低分子量岩藻聚糖硫酸酯制备
1.3.1 自由基降解[18]取4.5g岩藻聚糖硫酸酯粗糖溶于67.5m L蒸馏水,加入0.0267mol/L醋酸铜,用2mol/L NaOH调pH至7.5左右,在60℃恒温加热。然后用蠕动泵以0.9m L/m in速度加入4.5%H2O2溶液,反应中不断加入2mol/L NaOH保持反应液pH为7.5,5h后停止加H2O2。将反应液中加入0.3m L 2mol/L NaOH,冷却至室温,采用10000r/min离心20min,除去大部分Cu2+,将液体pH调至中性,加入Chelex 100螯合柱除去残留的Cu2+。降解产物采用截流分子量为6ku的中空纤维膜超滤,分别收集分子量小于6ku组分和分子量大于6ku组分。分子量小于6ku组分采用截流分子量为500u的透析袋透析脱盐,然后旋蒸后冻干。
1.3.2 微量降解条件 分别取500μL 20mg/m L F3、F4和F5,加入0.0267mol/L醋酸铜,采用60℃恒温加热。F3和F4中加10μL/h的15%H2O2,F4中加50μL/h的15% H2O2。反应4h,并随时用0.3mol/L的NaOH调至碱性。
2 结果与讨论
2.1 岩藻聚糖硫酸酯的化学成分分析
采用苯酚硫酸法确定粗糖的总糖含量为66.59%,为了进一步分离纯化岩藻聚糖硫酸酯,我们采用阴离子交换色谱对粗糖进行分级纯化。采用不同浓度的氯化钠溶液对多糖进行分离,得到6个不同的组分。表1为分离纯化的岩藻聚糖硫酸酯各组分的硫酸根含量的比较。比较看出洗脱用的NaCl的浓度越高,岩藻聚糖硫酸酯的硫酸根含量越高。由于QFF凝胶为强阴离子柱,岩藻聚糖硫酸酯的硫酸根含量越高,与柱子的亲和力越强,需用越高浓度的NaCl溶液才能被洗脱下来。其中F1和F2组分硫酸根很低,F5和F6硫酸根最高,超过35%。而F1~F6的得率分别是26.77%、12.85%、33.37%、20.11%、1.9%、0.5%。组分F6虽然硫酸根和岩藻糖含量(见表2)很高,但是因为得率太低,所以后续实验没有以F6为研究对象再进行分析。

表1 岩藻聚糖硫酸酯各组分硫酸根含量的比较Table 1 Comparison of sulfated ester contentof different fucoidan fractions
图1为F4的HPLC分析结果。根据出峰时间来确定样品中单糖的种类,根据浓度-吸光值标准曲线计算样品中各单糖的含量。表2为不同岩藻聚糖硫酸酯组分的单糖组成比较。比较发现,组分的硫酸根含量越高,其岩藻糖含量越高,其中F3、F4和F5岩藻糖含量较高,达到50%,其次是甘露糖和半乳糖含量较高。而低硫组分F1和F2中岩藻糖含量只有30%和21%,但其含有较高的葡萄糖醛酸和半乳糖。
根据图2软骨素分子量标准品得出分子量与移动距离之间的标准曲线(图3),硫酸软骨素的分子量为2~8ku之间,分子量与电泳距离呈线性关系。而分子量大于8ku的多糖的分子量与电泳距离没有呈线性关系。根据硫酸软骨素的分子量为14ku左右,只能大约的估计图7、图8中a处硫酸多糖分子量约为20~ 100ku,b处约为8~20ku。
离子交换柱分离纯化的多糖组分经过截流分子量为10ku的透析袋透析后,采用15%PAGE凝胶电泳分析其分子量分布情况,如图4所示。比较发现,采用0和0.5mol/L NaCl洗脱的组分中,分子量低于10ku寡糖含量比较高,而高分子量组分含量很低,说明低浓度氯化钠可以去除到粗糖中的低硫杂质;而1、1.5、2mol/L NaCl洗脱出的组分中高分子量组分含量非常高,但是仍然含有少量的分子量低于10ku的组分,说明透析并不能完全将分子量低于10ku的低分子量糖完全去除掉。

图2 硫酸软骨素和硫酸软骨素酶解物的PAGE电泳分析Fig.2 PAGE electrophoresis analysis of Chondroitin sulfate and its enzymatic hydrolysate
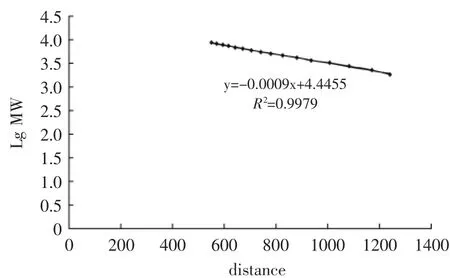
图3 PAGE凝胶电泳分析硫酸软骨素分子量-电泳距离之间关系的标准曲线Fig.3 The standard curve of the relationship of themolecular weightof chondroitin sulfate and electrophoresis distance by PAGE electrophoresis analysis

图4 岩藻聚糖硫酸酯粗糖及各洗脱组分的PAGE电泳图谱Fig.4 PAGE electrophoresis of polysaccharides and elution composition
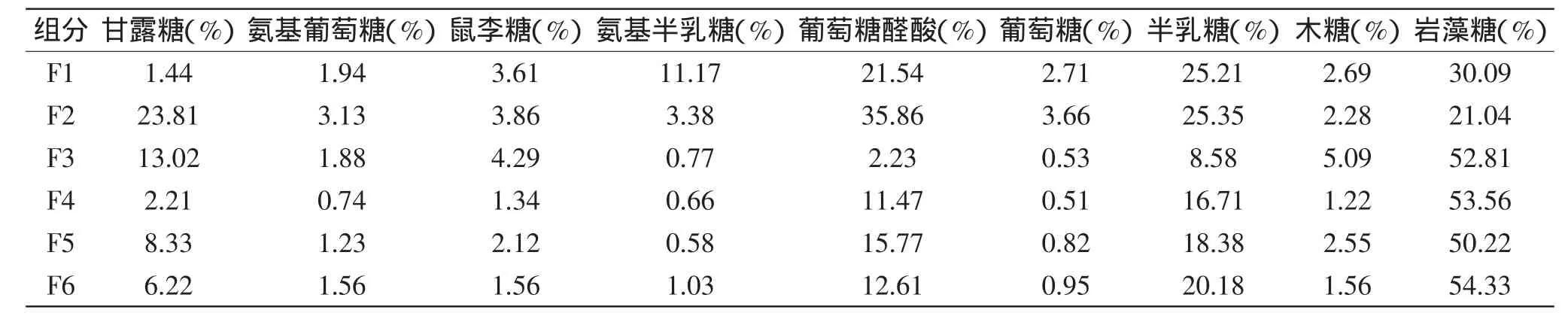
表2 岩藻聚糖硫酸酯各组分的单糖组成分析Table 2 Comparison ofmolar proportion ofmonosacchride composion in different fucoidan fractions
2.2 岩藻聚糖硫酸酯的红外分析
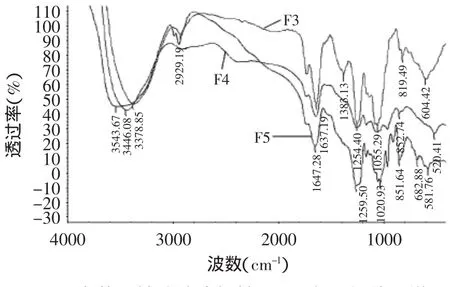
图5 岩藻聚糖硫酸酯粗糖F3、F4和F5红外图谱Fig.5 IR spectra of fractions F3,F4 and F5
由图5可知,F5糖在3444cm-1处为O-H强伸缩振动峰;所有多糖在3000~2800cm处均出现不同程度的吸收,尤其集中在2990cm和2940cm附近,2937cm-1处为C-H伸缩振动峰,这是岩藻糖的甲基吸收峰,是个弱吸收峰;1647cm-1处出现强吸收峰,为N-H变角震动,1417cm-1处是C-O的伸缩振动峰,是个弱吸收峰,说明有少量的糖醛酸存在;1259cm-1处是S=O官能团的伸缩振动峰,是强吸收峰,818cm-1处是C-O-S赤道配位的伸缩振动,表明该糖存在硫酸基团,与硫酸根含量测定结果相符,属于α-D-半乳吡喃糖。C-O-S伸缩振动峰的位置与多糖链上硫酸根的位置有关,是连接在岩藻糖C4位上的直立键硫酸根,在851cm-1处产生吸收峰,为α-端基差相异构的C-H变焦振动,而吸收峰在820cm-1左右的,是连接在岩藻糖C2或C3位,平伏键上的硫酸根,由红外光谱图得出,该糖的硫酸根连接在C2或C3上。
2.3 岩藻聚糖硫酸酯的核磁共振分析

图6 低分子量多糖的核磁结构Fig.6 The nuclearmagnetic structure of low molecular weight polysaccharides
图6为经过自由基氧化降解后得到的低分子量多糖的1H NMR谱图。对于糖来说,1H NMR谱中C-1上的质子(H-1)信号通常在4.8~5.5ppm。而C-2和C-6的质子信号都集中在3.2~4.8ppm。1.1~1.3ppm为岩藻糖的甲基氢。谱图中大部分质子信号在3.6~5.2ppm,出现在5.1~5.4ppm左右的异头氢质子H-1的信号峰,能初步推断该糖是α型吡喃糖,与红外数据相吻合。
2.4 不同结构岩藻聚糖硫酸酯降解条件的研究

图7 F3、F4和F5降解产物的PAGE电泳比较Fig.7 The PAGE electrophoresis analysis of F3、F4、F5
图7为粗糖及其自由基降解产物的PAGE凝胶电泳分析。可以看出,采用离子交换色谱分离纯化粗糖后,岩藻聚糖硫酸酯的分子量大多为20ku以上,但是仍有少量分子量小于20ku的低分子量多糖和寡糖存在。高分子量岩藻聚糖硫酸酯采用自由基氧化降解后,用截流分子量为6ku的中空纤维素膜过滤,得到分子量小于6ku和分子量大于6ku的两个部分。由PAGE凝胶电泳分析发现,超滤后得到的分子量小于6ku的岩藻聚硫酸酯的主要是分子量低于2ku的寡糖,而分子量大于6ku的组分中仍然含有分子量小于6ku的低分子量糖和寡糖,说明用超滤膜的截流分子量确定硫酸多糖的分子量存在不准确性。分析原因认为,纤维素膜的截流分子量是根据球形的蛋白质的分子量来确定的,而岩藻聚糖硫酸酯为直链多糖,并且具有较高的硫酸根,与中空纤维膜有一定的吸附。因此采用截流分子量为6ku的纤维素膜来分离岩藻聚糖硫酸酯时,只有聚合度小于10的寡糖(分子量大约2ku)通过了纤维素膜,而其他分子量较高的组分无法通过纤维素膜。
采用铜-过氧化氢诱导产生的羟基自由基对岩藻聚糖硫酸酯进行降解,对其降解条件及其产物的分子量之间的关系进行研究。500μL糖溶液中加入0.0267mol/L铜离子作为催化剂,以10μL/L 15%H2O2进行降解。比较发现,低硫组分F3、F4比高硫组分F5更容易降解,添加10μL 15%过氧化氢连续降解4h,低硫组分很快被降解成分子量低于8ku的低分子组分,而高硫组分仍有大量大分子组分没有降解。因此要降解高硫的F5组分,需要将过氧化氢用量升高到50μL。从图8可以看出,三个组分都被降解成为低分子组分,产物主要是寡糖和分子量低于8ku的低分子量组分,分子量分布比较广。说明自由基氧化降解得到的低分子量岩藻聚糖硫酸酯是分子量分布比较广的多糖的混合物。

图8 经自由基氧化降解和超滤分离后的岩藻聚糖硫酸酯的PAGE电泳分析Fig.8 The PAGE electrophoresis of lowmolecularweight fucoidan after degradation and ultrafiltration
3 结论
海带中岩藻聚糖硫酸酯分子量大,糖组成复杂,分子量分布较广。采用离子交换色谱可以对岩藻聚糖硫酸酯分离纯化,提高岩藻聚糖硫酸酯的纯度。采用自由基氧化降解法降解岩藻聚糖硫酸酯,通过调整过氧化氢浓度来优化岩藻聚糖硫酸酯的降解条件。比较发现硫酸根越高,岩藻聚糖硫酸酯难以降解。采用离子交换PAGE凝胶电泳,可以很好的分析高分子量和低分子量的岩藻聚糖硫酸酯的分子量分布,硫酸多糖的分子量在2~8ku之间,其分子量与电泳距离呈现很好的线性关系。PAGE电泳法简单便宜、能够准确直观地表征多糖分子量的分布。实验发现,采用截流分子量为6ku的纤维素膜对低分子量岩藻聚糖硫酸酯进行超滤分离,通过纤维素膜的岩藻聚糖硫酸酯分子量远远低于6ku,只有分子量大约2ku的组分能够通过纤维素膜。说明采用球型蛋白定义的超滤膜的截留分子量,并不适用于线性的硫酸多糖。
[1]张彦民,李宝才,朱利平,等.多糖化学及其生物活性研究进展[J].昆明理工大学学报,2003,28(3):140-145.
[2]纪明侯.海藻化学[M].北京:科学出版社,1997:318-319.
[3]Wang CY,Guan HS.Advances of researches on antiviral activities of polysaccharide[J].生物工程进展,2000,20(1):17.
[4]Alban S,Franz G.Characterization of the anticoagulantactions of a semisynthetic curdlan sulfate[J].Thromb Res,2000,99(4):377-388.
[5]Zhang QB,QiHM,Zhao TT,et al.Chemical characteristics of polysaccharide from Porphyra capensis(Rhodophyta)[J]. Carbohydrate Research.2005,340(15):2447-2450.
[6]Alain Nardella,Frederic Chauber,Catherine Boisson. Anticoagulant low molecular weight fucans produced by radical process and ion exchange chromatography of high molecular weight fucans extracted from brown seaweed Ascophyllum nodosum[J].Carbohydrate Research,1996,289:201-208.
[7]赵雪,李芳,董诗竹,等.相对低分子质量海带岩藻聚糖硫酸酯的制备及其对纤溶系统的影响[J].中国海洋药物杂志,2011(6):25-30.
[8]周贞兵,戴腾飞,王士长,等.马尾藻多糖的提取及免疫研究[J].安徽农业科学,2009(16):24-26.
[9]罗鼎真,崔艳秋,王晓民.褐藻多糖硫酸酯减轻1-甲基-4-苯基吡啶离子引起的细胞损伤和氧化应激[J].首都医科大学学报,2009,30(4):475-480.
[10]Kuznetsova TA.Fueoidan Extraeted from Fueus Evaneseens Brown Algae Correets Inununity and Hemostasis Disorders in ExPerimental Endotoxemia[J].Bulletinof ExPerimental Biology and Medieine,2009,147(1):66-69.
[11]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:56-78.
[12]马心英.利用离子色谱测定海带硫酸多糖中硫酸根的含量[J].曲阜师范大学学报,2002,28(2):84-86.
[13]魏远安,方积年.高效凝胶渗透法测定多糖纯度和分子量[J].药学学报,1989,24(7):532.
[14]Fu D,O Neill RA.Monosaccharide composition analysis of oligosaccharides and glycoproteins by high-performance liquid chromatography[J].Anal Biochem,1995,227(2):377-384.
[15]Strydom D J.Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone derivatized neutral,acidic and basic aldoses [J].JChromatogr A,1994,678(11):17-23.
[16]嵇国利,于广利,吴建东,等.爆发期条浒苔多糖的提取分离及其理化性质研究[J].中国海洋药物,2009(3),28:7-12.
[17]Bilan MI,AA GraeheV,NE Ustuzhanina,et al.Strueture of a fueoidan from the brown seaweed Fueus evaneseens C.Ag[J]. Carbohydrate Research,2002,337(8):719-730.
[18]Chen R H,Chang J R,Shyur J S.Effects of ultrasonic conditions and storage in acidicsolutions on changes inmolecular weight and polydisperity of treated chitosan[J].Carbohydrate Research,1997,299(4):287-294.
Degradation and structure analysis of fucoidan extracted from Lam inaria Japonica
GUO Feng-jun,HU Jing,ZHAO Xue*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
To separate and purify fucoidan from Lam inaria Japonica by anion-exchange chromatography.To obtain and analyze low molecular weight fucoidan by copper-hyd rogen peroxide free rad ical deg radation,High sulfate and fucose content fucoidan were obtained by certain concentration of sod ium chloride from anionexchange column.Infrared spectrum method determ ined the position of the sulfated group was on C2 or C3. NMR further demonstrated the existence ofα-D-pyranose.The molecular weight of fucoidan and low molecular weight fucoidan fractions were analyzed w ith PAGE electrophoresis.Result revealed that the content of sulfate g roup and fucose p layed an im portant role on the free radical deg radation of fucoidan.The fucoidan fraction w ith high sulfate and fucose content was more d ifficult to be degraded.The op timal deg radation cond itions were ob tained:500μL 20mg/m L fucoidan solution,w ith 0.0267mol/L cup ric acetate,10μL 15%H2O2for F3,F4 and 50μL 15%H2O2for F6,reacted for 4h at 60℃.Using the method of PAGE could analyze the distribution of the molecular weight of oxidative degradation p roducts.
Lam inaria Japonica;fucoidan;free rad ical deg radation;electrophoresis
TS254.9
A
1002-0306(2014)18-0093-05
10.13386/j.issn1002-0306.2014.18.011
2013-12-09 *通讯联系人
郭峰君(1989-),女,在读硕士研究生,研究方向:海带岩藻聚糖硫酸酯结构和预防治疗脑血栓活性研究。
国家自然科学基金(31371759)。
