花生苹果酸脱氢酶基因的克隆及其蛋白序列分析
2014-02-24汪巧英应濠泽余佳宁祝锦晶徐自力杜照奎
汪巧英,应濠泽,余佳宁,祝锦晶,徐自力,杜照奎*,2,3
(1.台州学院 生命科学学院,浙江 台州 318000;2.浙江省植物进化生态学与保护重点实验室,浙江 台州 318000;3.台州学院 生态研究所,浙江 台州 318000)
花生苹果酸脱氢酶基因的克隆及其蛋白序列分析
汪巧英1,应濠泽1,余佳宁1,祝锦晶1,徐自力1,杜照奎*1,2,3
(1.台州学院 生命科学学院,浙江 台州 318000;2.浙江省植物进化生态学与保护重点实验室,浙江 台州 318000;3.台州学院 生态研究所,浙江 台州 318000)
根据已知植物的苹果酸脱氢酶基因序列设计简并引物,采用RT-PCR技术从花生叶片中克隆得到苹果酸脱氢酶基因,命名为AhMDH,Genbank登录号为KF499119,该基因编码区长度为1071bp,编码356个氨基酸。序列比对结果表明,AhMDH编码蛋白与大豆、蒺藜苜蓿和豌豆等具有较高的相似性。
花生;苹果酸脱氢酶;克隆;序列分析
0 引言
苹果酸脱氢酶(malate dehydrogenase,MDH,EC 1.1.1.37),广泛存在于动、植物和微生物中,可以催化草酰乙酸与苹果酸之间的可逆转换。MDH可催化草酰乙酸生成苹果酸,使NAD+生成NADH,为硝酸还原过程提供还原力[1];胞质中生物氧化产生的NADH不能通过线粒体内膜,但NADH可在MDH作用下将氢交给草酰乙酸生成苹果酸,后者可通过苹果酸-天冬氨酸穿梭系统被运送到线粒体基质,线粒体基质中的苹果酸被重新氧化成草酰乙酸和NADH,然后通过呼吸链进行氧化[2]。因而,MDH参与了植物众多生理活动,如三羧酸循环、脂肪酸的合成、氮同化和氨基酸的合成等。研究表明,MDH在植物种子萌发、生长发育、果实成熟等方面起着重要作用。
目前,人们已经陆续水稻[3]、小麦[4]、玉米[5]、香蕉[6]、甘蔗[7]、大白菜[8]和苹果[9]等植物中克隆出MDH基因。花生(Arachis hypogaea L.)是豆科落花生属一年生草本植物,富含脂肪和蛋白质,为重要的食用植物油来源,但至今尚未见花生MDH基因序列及表达情况的报道。前期蛋白质组学研究表明,受到UV-B辐射处理24h后,花生MDH表达量下调。本文采用RT-PCR技术克隆花生苹果酸脱氢酶基因(AhMDH),并进行序列分析,为进一步验证其在耐受UV-B等逆境胁迫的生物学功能奠定基础。
1 材料与方法
1.1 试验材料
供试花生品种为“小京生”,种子购自新昌县种子公司。2013年3月5日播种,4月8日采集幼嫩、健康的叶片,75%酒精擦拭后立即提取总RNA。
大肠杆菌 (Escherichia coli)菌株DH5α由本室保存。pUCm-T载体、总RNA提取试剂盒、cDNA的合成试剂盒和琼脂糖凝胶回收试剂盒购自碧云天公司;dNTP、DNA Marker、Taq DNA聚合酶、
DNA Marker DL2000、限制性内切酶、T4 DNA连接酶、氨苄青霉素、琼脂糖和DEPC购自上海生工公司;胰蛋白胨和酵母提取物产自英国OXOID公司;其他试剂均为国产分析纯产品。
上、下游引物分别为MDHF:5’-ATGGA(A/G)GCA(A/T/C)(A/G)TGCAGCGG-3’和MDHR:5’-TTATTTTCTGATGAA(A/T)(T/G/C)(C/A)TATC-3’,由上海英骏生物技术有限公司合成。
1.2 叶片总RNA提取和cDNA的合成
花生叶片总RNA的提取和cDNA的合成按照试剂盒提供的说明书进行。取3 μL RNA于1%琼脂糖凝胶上进行非变性电泳,检测RNA的完整性。通过Nanodrop ND-2000超微量分光光度计测定RNA浓度。
1.3 PCR扩增体系和程序
扩增体系:反转录cDNA约50ng作为模板,引物终浓度为10μmol·L-1,dNTP终浓度为100μmol·L-1,Taq酶1U,加无菌水至总体积10μL。
PCR反应在美国Bio-Rad MyCycler热循环仪中进行,反应条件为:94℃预变性5min,94℃变性30 s,55℃退火45s,72℃延伸90s,共30个循环,最后72℃延伸10min。
1.4 PCR产物的回收、连接与测序
PCR产物的回收按试剂盒说明书进行,回收产物与pUCm-T载体连接。连接产物转化大肠杆菌DH5α感受态细胞,经蓝白斑及菌液PCR初步筛选阳性克隆菌,由上海生工生物工程技术服务有限公司测序确认。
1.5 序列分析
通过ExPASy(http://www.expasy.org/tools/protparam.html)进行蛋白质的疏水性分析,运用PSORT (http://psort.hgc.jp/form.html) 进行亚细胞定位; 运用 SOPM (http://npsa-pbil.ibcp.fr/cgi-bin/ npsa_automat.pl?page=/NPSA/npsa_sopm.html)预测其编码蛋白的二级结构;运用CDD(http://www.ncbi. nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行保守区分析;运用SWISS-MODEL进行结构域的三维建模。在GenBank(http://www.ncbi.nlm.nih.gov/)数据库中下载其它物种苹果酸脱氢酶基因,用软件MEGA4.1 NJ法(Neighbor-Joining method)构建系统发育树,进行1000次bootstrap检验系统发生树可靠性。
2 结果与讨论
2.1 花生叶片总RNA的提取和检测
花生叶片总RNA琼脂糖凝胶电泳结果显示(图1),28S RNA和18S RNA条带清晰可见,两者亮度基本接近2:1,表明总RNA没有明显的降解,完整性较好;紫外分光光度计测定OD260=0.898、OD280= 0.454,通过计算OD260/OD280=1.98,说明纯度较高,可用于后续试验研究。

图1 花生叶片总RNA凝胶电泳结果Fig.1 Total RNA from Arachis hypogaea leaves separated on agarose gel
2.2 花生苹果酸脱氢酶基因的克隆
提取花生叶片总RNA,反转录得到cDNA。以cDNA为模板、分别以MDHF和MDHR为引物对进行PCR扩增,琼脂糖凝胶电泳结果显示:在DNA Marker DL2000的1 000bp和2 000bp之间获得一条特异性扩增的条带,PCR扩增产物纯度较高,大小约为1 700bp(图2)。
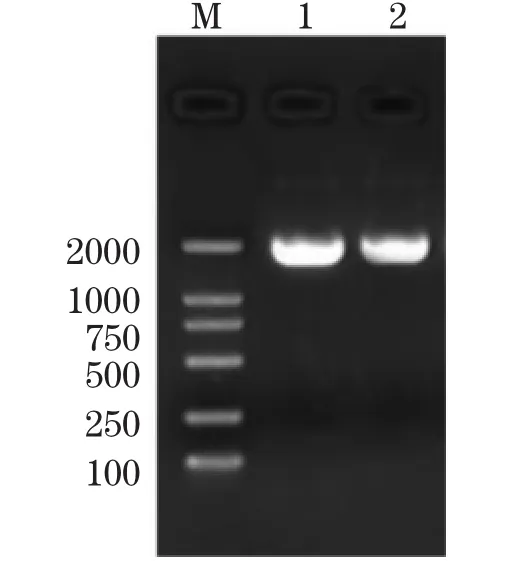
图2 花生AhMDH基因RT-PCR扩增结果Note:Lane M is DNA Marker DL2000;Lane 1 and 2 are AhMDH PCR productsFig.2 Amplification of gene MDH from A.hypogaea by RT-PCR
2.3 阳性克隆质粒的鉴定
RT-PCR产物分别回收纯化后,与T载体连接,转化E.coli DH5α感受态细胞,从氨苄青霉素抗性平板上挑取白色单菌落进行短时培养,菌液PCR结果显示 (图3),加样孔1、2和4在DL 2000的1 000~2 000bp处出现单条清晰条带,大小与图2较吻合,初步估计所挑菌落为阳性克隆。测序结果表明目的片段长度分别为1 071bp,将其命名为AhMDH,序列已提交NCBI网站,登录号为KF499119。
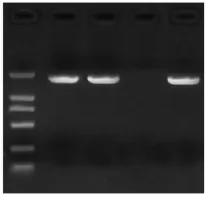
图3 重组质粒PCR鉴定结果Note:Lane M is DNA Marker DL2000;Lane 1-4 are colony PCR product of AhMDH from transformated LB plate.Fig.3 Identification of recombinant plasmid pUCm-T-MDH by PCR
2.4 AhMDH序列分析
ProtParam显示,AhMDH基因编码蛋白分子式C1668H2711N461O495S11;由356个氨基酸组成(图4),所含氨基酸组成以Ala最多,酸性氨基酸(Asp和Glu)和碱性氨基酸(Lys和Arg)个数均为37;相对分子质量为37.50 KD;等电点为6.97;不稳定指数分别为24.65,属于稳定蛋白质。

图4 AhMDH基因的编码区及推导的氨基酸序列Fig.4 Coding sequence of AhMDH gene and its deduced amino acid sequence
使用PSORT在线程序预测蛋白的亚细胞定位特性,结果表明:MDH蛋白可能定位于线粒体基质。保守结构域分析表明,MDH中含有三种结构域,分别是辅酶NAD+结合结构域、MDH二聚体结合结构域和底物结合结构域(图5)。

图5 AhMDH基因编码蛋白保守结构域预测Fig.5 Prediction of conserved domain in AhMDH protein
2.5 AhMDH编码蛋白序列比对分析
为比较不同植物已知MDH基因的序列差异和进化关系,从NCBI数据库下载大豆 (Glycine max,登录号:BAG09381.1)、蒺藜苜蓿(Medicago truncatula,登录号:AES90524.1)、豌豆(Pisum sativum,登录号:AAO27260.1)、欧洲油菜(Brassica napus,登录号:CAB43995.1)、毛果杨(Populus trichocarpa,登录号:EEE87160.1)、紫苏(Perilla frutescens,登录号:ABW79813.1)、克莱门柚(Citrus clementina,登录号:ESR35923.1)、蓖麻(Ricinus communis,登录号:EEF40237.1)、葡萄(Vitis vinifera,登录号:CAN65552.1)、节节麦(Aegilops tauschii,登录号:EMT13267.1)、荠菜(Capsella rubella,登录号:EOA30902.1)、番茄(Solanum lycopersicum,登录号:AAU29200.1)、野草莓 (Fragaria vesca subsp. vesca,登录号:XP_ 004289711.1)、黄瓜(Cucumis sativus,登录号:XP_004143423.1)、毛竹(Phyllostachys edulis,登录号:ADB85313.1)、白绿竹(Bambusa oldhamii,登录号:ACN62414.1)、水稻(Oryza sativa Japonica Group,登录号:EEE53658.1)、高粱(Sorghum bicolor,登录号:EES17483.1)、玉米(Zea mays,登录号:ACF87717.1)和大麦(Hordeum vulgare subsp.vulgare,登录号:BAJ99028.1)序列。用DNAMAN软件对其蛋白质序列比对分析发现,MDH在不同物种间的相似性较高,除N端有差异性较大外,其它区域相对保守(图6),花生与
大豆的相似性最高,为92.13%,与玉米的相似性最低,仅为78.37%。

图6 AhMDH编码蛋白序列与同源蛋白序列的比对Fig.6 Multi-alignment of AhMDH deduced amino acid sequences with its homologous genes
运用Mega 5.0软件采用Neighbor-Joining法对AhMHD编码蛋白质序列构建的系统发育树,结果表明:单子叶(节节麦和大麦、毛竹、水稻、高粱和玉米)植物和双子叶植物各聚为一大组(图6),双子叶植物中同为豆科的花生与大豆、蒺藜苜蓿和豌豆聚为一组,亲缘关系最近;十字花科的欧洲油菜和芥菜聚为一组,这与传统的植物学分类结果一致。
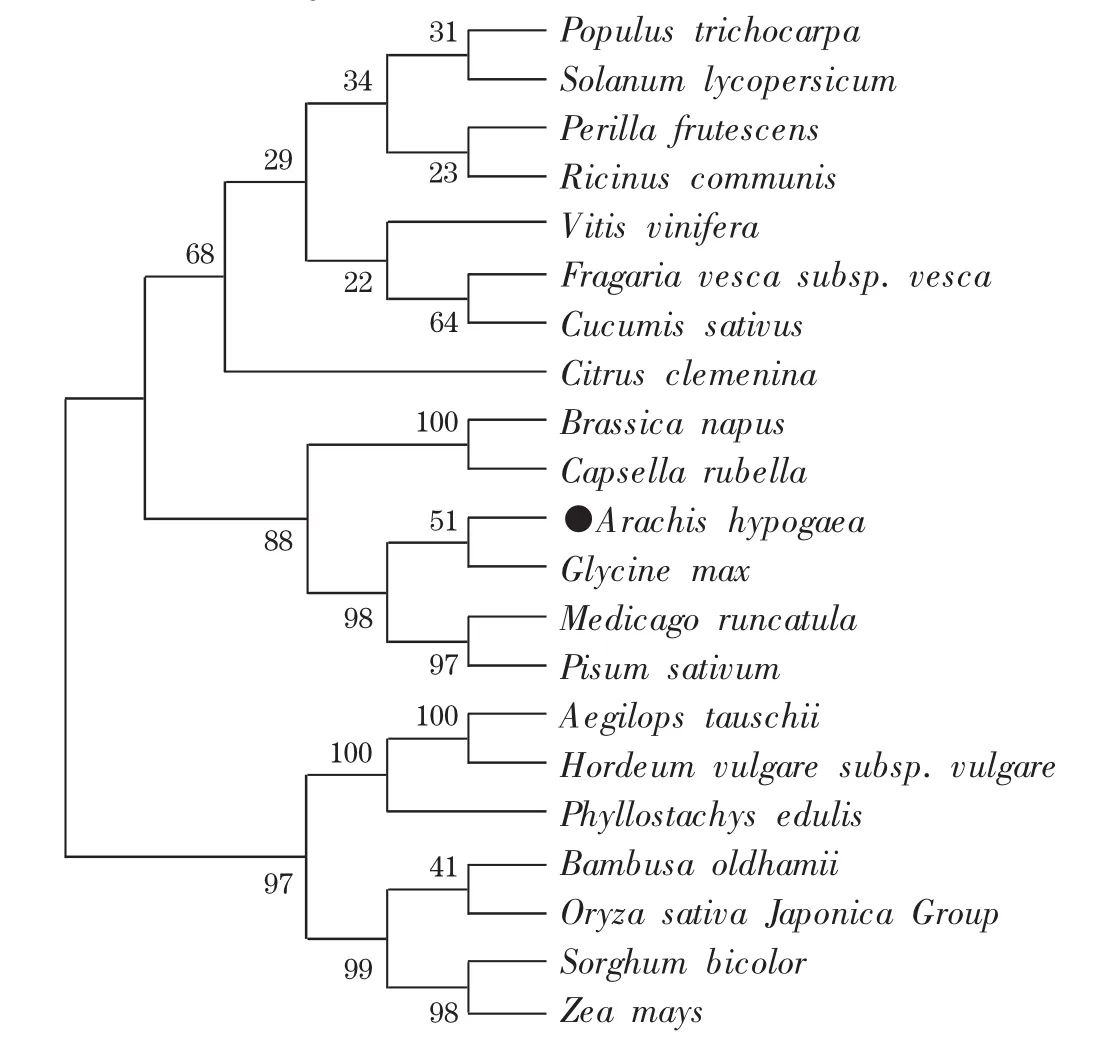
图7 AhMDH基因编码蛋白的系统发育树Fig.7 Phylogentic tree of AhMDH deduced amino acid sequence and its homologous sequences
苹果酸脱氢酶可以催化草酰乙酸与苹果酸之间的可逆转换,在植物细胞内参与了众多生理活动,如三羧酸循环、氮同化、脂肪酸和氨基酸的合成等,因而,MDH在植物种子萌发、生长发育和果实成熟等方面起着重要作用。此外,在应对逆境胁迫中,MDH也具有重要作用,如Yao等[9]在苹果和番茄中过表达MDH后,发现两种植物对低温和盐胁迫抗性提高;Wang等[10]在番茄中过表达MDH也发现其对Al的抗性增强,但过表达MDH是否会提高植物对UV-B的抗性尚未见报道。本研究从花生叶片中克隆了花生苹果酸脱氢酶基因AhMDH,下一步拟构建真核表达载体,将此基因转入花生中,进行过量表达,检测能否提高其对UV-B的抗性。
3结论
花生苹果酸脱氢酶基因AhMDH(Genbank登录号为KF499119),长度为1071bp,编码356个氨基酸,相对分子质量为37.50KD。该蛋白可能定位于线粒体基质,含有三种结构域,分别是辅酶NAD+结合结构域、MDH二聚体结合结构域和底物结合结构域。AhMDH编码蛋白与大豆、蒺藜苜蓿和豌豆等具有较高的相似性。
[1]Scheibe R.Malate valves to balance cellular energy supply[J].Physiologia Plantarum,2004,120(1):21-26.
[2]Goward C R,Nicholls D J.Malate dehydrogenase:a model for structure,evolution,and catalysis[J].Protein Science,1994,3(10):1883-1888.
[3]Lin C-F,Jiang L-Z,Zhang X-N,et al.Cloning and prokaryotic expression of a cDNA encoding a putative mitochondrial malate dehydrogenase in Oryza sativa[J].Mitochondrial DNA,2003,14(1):75-77.
[4]蔺占兵,徐洋,马庆虎,等.小麦中一类依赖于NAD的细胞质型苹果酸脱氢酶cDNA的克隆和进化树分析 [J].农业生物技术学报,2004,12(1):38-42.
[5]胡建广,赵相山,刘军,等.玉米苹果酸脱氢酶基因的分离与结构分析 [J].植物学报,1999,41(1):40-44.
[6]张建斌,贾彩红,邓秋菊,等.香蕉苹果酸脱氢酶基因克隆及其逆境胁迫表达 [J].西北植物学报,2012,32(10): 1942-1949.
[7]徐景升,阙友雄,颜克伟,等.甘蔗细胞质型苹果酸脱氢酶基因的克隆及其表达分析 [J].热带亚热带植物学报,2012, 20(5):455-461.
[8]贾晋,张鲁刚.大白菜苹果酸脱氢酶基因的克隆及序列分析 [J].园艺学报,2009,36(3):363-368.
[9]Yao Y X,Dong Q L,Zhai H,et al.The functions of an apple cytosolic malate dehydrogenase gene in growth and tolerance to cold and salt stresses[J].Plant Physiology and Biochemistry,2011,49(3):257-264.
[10]Wang Q F,Zhao Y,Yi Q,et al.Overexpression of malate dehydrogenase in transgenic tobacco leaves: enhanced malate synthesis and augmented Al-resistance[J].Acta Physiologiae Plantarum,2010,32(6):1209-1220.
Cloning and Sequence Analysis of Malate Dehydrogenase Gene from Arachis hypogaea L.
WANG Qiao-ying1,YING Hao-ze1,YU Jia-ning1,ZHU Jin-jing1,XU Zi-li1,DU Zhao-kui1,2,3*
(1.School of Life Sciences,Taizhou University,Taizhou 318000,China; 2.Zhejiang Provincial Key Laboratory of Plant Evolutionary Ecology and Conservation,Taizhou 318000,China; 3.Institute of Ecology,Taizhou University,Taizhou 318000,China)
In this paper, degenerate primers were designed according to reported malate dehyrogenase gene sequences.The coding sequence of malate dehyrogenase gene (AhMDH) numbered KF499119 was amplified by RT-PCR from cDNA of Arachis hypogaea L.The sequence of AhMDH is 1071 bp in length encoding 356 amino acid.Multiple sequence alignment analysis showed that A.hypogaea,Glycine max,Medicago truncatula and Pisum sativum share high homology.
Arachis hypogaea;malate dehyrogenase;gene cloning;sequence analysis
10.13853/j.cnki.issn.1672-3708.2014.06.008
(责任编辑:耿继祥)
2014-05-05;
2014-05-12
浙江省教育厅科研项目(Y201223322);2014年浙江省大学生科技创新活动计划(新苗人才计划)(2014R428013)。
简介:杜照奎(1979- ),男,湖北随州人,讲师,博士,主要从事植物分子生态学研究。
