猕猴桃灰霉病生防真菌的分离与鉴定
2014-02-24毕金丽崔艳丽张静袁青峰刘娅
毕金丽,崔艳丽,张静,袁青峰,刘娅*
(1.石河子大学食品学院,新疆石河子832000;2.新疆农业职业技术学院,新疆昌吉831100;3.兵团第十三师农科所,新疆哈密839000)
猕猴桃灰霉病生防真菌的分离与鉴定
毕金丽1,崔艳丽2,张静3,袁青峰3,刘娅1*
(1.石河子大学食品学院,新疆石河子832000;2.新疆农业职业技术学院,新疆昌吉831100;3.兵团第十三师农科所,新疆哈密839000)
为了获得对猕猴桃灰霉病具有较高拮抗活性的生防菌株,采用系列稀释法和平板涂布法从猕猴桃果园土壤和健康的猕猴桃果皮表面初步分离筛选到真菌20株;以导致灰霉病的灰霉菌为靶标菌,经平板对峙实验复筛,发现5株真菌对灰霉病有一定拮抗作用,其中1株编号为HuW1的菌株抑菌直径最宽,对灰霉病的抑制率最高,达80%左右,形态观察和ITS rDNA、26S rDNA D1/D2区域序列分析表明该菌株为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)。
猕猴桃灰霉病;生物防治;拮抗真菌
果蔬采后病害导致的巨大经济损耗已成为一个全球关注的问题。据有关部门统计,2011年我国约有1亿多吨果蔬腐烂,直接损失高达1 000亿元,占整个行业产值的30%以上,而美国等发达国家的果蔬采后损失率仅占1.7%~5%[1]。猕猴桃是国内外重要的经济作物,猕猴桃灰霉病是由灰霉菌(Botrytis cinerea)引起的一种世界性的重要病害,能危害猕猴桃、蕃茄、草莓、黄瓜、葡萄等多种植物,引起果蔬腐烂,损失严重。灰霉病菌具有繁殖快,遗传变异大和适应性强的特点,连续使用同一药剂易产生抗药性[2-3]。目前,果蔬采后病害的防治方法主要包括物理法和化学法,物理法生产成本太高,而化学杀菌剂处理存在一定的安全问题[4],带来了严重的病菌抗药性与环境污染问题。而微生物防治可以有效的避免这些问题的发生,随着人们环保意识逐渐提高,对无公害果蔬的需求越来越大,微生物防治日益成为一条重要而有效的途径[5]。本实验筛选对灰霉病有拮抗作用的真菌,从而为猕猴桃采后病害的生物防治提供借鉴和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 土壤和猕猴桃果实
土壤样品采自陕西猕猴桃灰霉病发生较重田块的健康植株根围土壤。取样方法参考文献[6]。
猕猴桃果实为成熟度好、大小均一、无病虫害的猕猴桃果实。猕猴桃用质量分数2%的次氯酸钠消毒3 min后用无菌水冲洗,自然晾干后备用[7]。
1.1.2 供试病原菌
病原菌分离于自然发病的猕猴桃果实,并经过纯化培养,经形态学鉴定为灰霉菌(Botrytis cinerea)。将病原菌接种到马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,25℃条件下培养至长出菌落。
1.1.3 培养基
(1)PDA培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,自然pH,121℃灭菌20 min。
(2)培养基:去皮马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,自然pH,121℃灭菌20 min。
(3)酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母抽取物10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 000 mL,自然pH值,121℃灭菌20 min。配制YPD固体培养基时加入20 g的琼脂粉。
1.2 仪器与设备
“MLS-3780高压蒸汽灭菌器、MDF-U53F超低温冰箱:日本三洋公司;ZHJH-C1115C超净工作台、ZDP-A2160A全自动新型电热培养箱:上海智城分析仪器制造有限公司;S1000 PCR仪、Gel Dox XR+凝胶成像系统:美国BIO-RAD公司;XSP-2C双目生物显微镜:上海光学仪器厂;Centrifuge5430低温离心机:德国Eppendorf公司;HWS-12数显恒温水浴锅:上海一恒仪器有限公司。”
1.3 试验方法
1.3.1 真菌菌株分离纯化与保存
土壤中真菌的分离采用平板涂布法。取适量土壤样品于无菌水中,充分摇匀后用无菌水按照10倍稀释度稀释到不同梯度,涂布到PDA培养基,置于30℃静置培养,待长出菌落后,将具有典型真菌菌落特征的单菌落挑出,进行分离纯化,镜检为纯种后,于30℃连续传代培养几次[8]。对纯化的菌株进行编号,并保存在含有15%无菌甘油的冻存管中,-80℃保存。
猕猴桃果皮表面的真菌分离采用常规组织块法[9],培养基采用PDA培养基。在超净台内进行,选取表面消毒、清洗后的猕猴桃表皮,切取成小块(每边长3~4 cm),用无菌操作法将表皮组织移至平板培养基上,30℃静置培养,待长出菌落后,将具有典型真菌菌落特征的单菌落挑出,进行分离纯化,镜检为纯种后,于30℃连续传代培养几次。对纯化的菌株进行编号,并保存在含有15%无菌甘油的冻存管中,-80℃保存。
1.3.2 拮抗真菌的筛选
采用平板对峙培养法,以导致灰霉病的灰霉菌为靶标菌,在PDA培养基平板上,靠近中央的位置,做两个点标记,距离4 cm左右,一个点接灰霉菌菌饼(直径8 mm),并使菌饼带菌丝的一面贴在培养基表面,另一点划线筛选出的真菌,30℃培养24~72 h,测定菌落直径,计算抑菌率[10-11]。设3次重复。同时以只接有灰霉病原菌的菌饼作为对照(CK)。

1.3.3 拮抗真菌的鉴定
对具有高拮抗活性的真菌,根据菌落特征,并利用光学显微镜观察菌体,结合ITS rDNA和26S rDNA D1/D2区域序列分析,确定其分类学地位[12-14]。
ITS序列扩增引物为ITS1(5′-TCCGATGGTGAACCTGCGG-3′),PCR程序为:94℃预变性、5 min;94℃变性、30 s,57℃退火、45 s,72℃延伸、1 min,35个循环;72℃、10 min。26S rDNA D1/D2区域序列扩增引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′),PCR程序为:94℃预变性、5 min;94℃变性、30 s,55℃退火、45 s,72℃延伸、1 min,35个循环;72℃、10 min。PCR产物克隆到pMD18-T Simple载体后进行测序。所有序列的测定:由上海美吉生物医药科技有限公司完成。结合ITS序列和26S rDNA D1/D2区域序列在NCBI的BLAST比对结果和菌落、菌体细胞形态对拮抗真菌进行分类学鉴定[8,14-15]。
2 结果与分析
2.1 真菌菌株分离纯化
以土壤和猕猴桃果皮表面为拮抗真菌筛选来源,经初筛,共分离到20株真菌,其中源自土壤的菌株12株,源自猕猴桃果皮表面的菌株8株。
2.2 拮抗真菌的筛选
将分离到的20株真菌用于猕猴桃灰霉病潜在生防菌的筛选。分别在PDA培养基和YPD培养基上培养,通过复筛,发现有5株真菌对猕猴桃灰霉病具有一定的拮抗活性。根据平板对峙培养过程中抑菌宽带长短,筛选出一株拮抗活性最高的菌株,编号为HuW1(源自猕猴桃果皮表面),其抑菌圈透明、边缘清晰、界限明显,且在接灰霉菌后的3 d内具有一定的稳定性,72 h后抑菌直径达到33 mm左右,抑制率达80%左右,结果见图1。
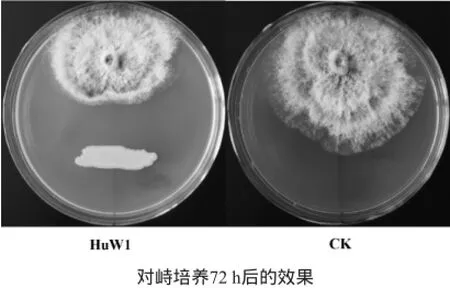
图1 菌株HuW1与猕猴桃灰霉菌平板对峙实验效果Fig.1 Results of plate confrontation test between strain HuW1 and kiwi Botrytis cinerea
2.3 拮抗真菌的鉴定
2.3.1 形态鉴定
菌株HuW1在PDA培养基和YPD培养基上的菌落特征为菌落大且厚,表面湿润、透明、光滑、易被挑起,为乳白色,具有酵母菌落的典型特征,结果见图2。
利用光学显微镜观察菌株HuW1的菌体形态,菌体呈椭圆形,有子囊和孢子,具有酵母菌细胞的典型特征,如图3所示。
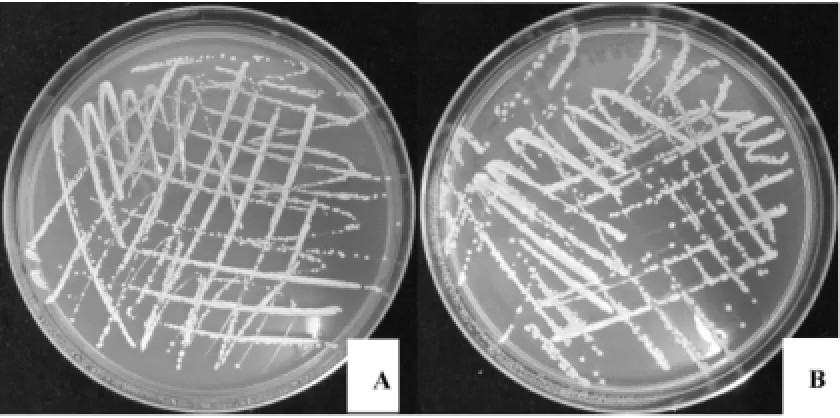
图2 菌株HuW1在PDA培养基(A)和YPD培养基(B)的菌落形态Fig.2 Colony morphology of strain HuW1 in PDA medium(A) and YPD medium(B)
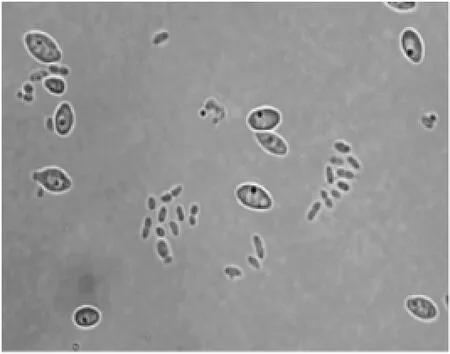
图3 菌株HuW1的细胞形态特征Fig.3 Cells morphology of strain HuW1
2.3.2 分子鉴定
HuW1 PCR扩增获得747 bp的ITS序列如下:

HuW1 PCR扩增获得615 bp的26S rDNA D1/D2区域序列如下:

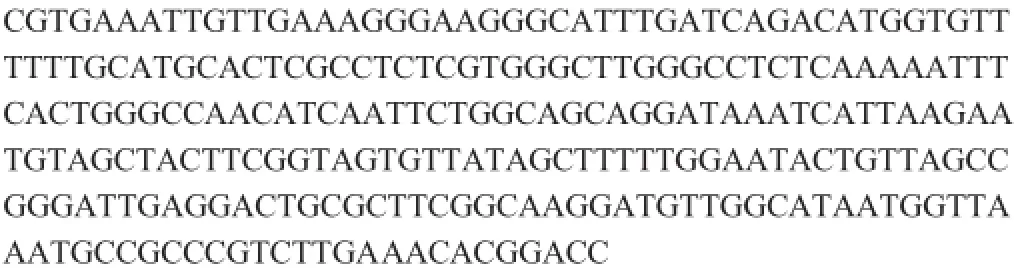
将所获得的序列与GenBank数据库中的已知序列进行BLAST比对,ITS和26S r DNA D1/D2区域序列与数据库中的Hanseniaspora uvarum和Hanseniaspora opuntiae的同源性为100%。
结合序列比对结果和菌落、菌体形态特征,最终将此菌株鉴定为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)。
3 结论
本实验从健康的猕猴桃果皮表面分离到1株对灰霉病抑制效果较好的菌株HuW1,抑制率约为80%。经形态和分子生物学鉴定,确定该菌为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)。
[1]宋金宇,刘程惠,胡文忠,等.拮抗酵母菌对果蔬病害防治的研究进展[J].保鲜与加工,2012,12(5):53-56.
[2]王克勤.灰霉病菌抗药性研究进展及防治对策[J].黑龙江农业科学,2000(5):40-41.
[3]杨燕涛.国内保护地蔬菜灰霉病侵染规律及防治技术研究进展[J].农药,2003,42(1):6-10.
[4]全桂静.苹果采后病害拮抗细菌的筛选与防腐效果研究[J].贮藏保鲜加工,2013(11):130-132.
[5]葛绍荣,牛莉娜,李铭.番茄灰霉病害及其微生物防治的研究进展[J].生物加工过程,2007,5(3):15-19.
[6]克龙启,陆铮铮,吴石平,等.一株放线菌对辣椒青枯菌的拮抗作用及其鉴定[J].河南农业科学,2012,41(11):92-95.
[7]巩文峰,岳海梅,旺姆,等.酵母菌3SJ对三种苹果致病菌的抑制效果及机理[J].湖北农业科学,2012,51(13):2741-2744.
[8]毕金丽,刘莉,张殿朋,等.耐高温酵母的筛选鉴定及发酵性能的初步研究[J].中国酿造,2013,32(5):107-110.
[9]方中达主编.植病研究法[M].北京:中国农业出版社,1998.
[10]宋聪,李正国,边万平,等.果实采后病害拮抗菌的筛选及鉴定[J].西南师范大学学报:自然科学版,2007,32(2):76-81.
[11]耿海峰,张丽珍,牛伟.冬枣采后病害拮抗菌的筛选和鉴定[J].食品科学,2010,31(9):150-155.
[12]燕勇,李卫平,高雯洁,等.rDNA-ITS序列分析在真菌鉴定中的应用[J].中国卫生检验杂志,2008,18(10):1958-1961.
[13]马爱瑛.rDNA分析在真菌分类鉴定中的应用[J].安徽农业科学,2010(32):18079-18079.
[14]李钧敏.分子生物学实验[M].杭州:浙江大学出版社,2008.
[15]ZHANG M,XIAO Y,ZHU R R,et al.Enhanced thermotolerance and ethanol tolerance in Saccharomyces cerevisiae mutated by high-energy pulse electron beam and protoplast fusion[J].Bioprocess Biosyst Eng, 2012,35(9):1455-1465.
Isolation and identification of biocontrol fungi against kiwi Botrytis cinerea
BI Jinli1,CUI Yanli2,ZHANG Jing3,YUAN Qingfeng3,LIU Ya1*
(1.College of Food,Shihezi University,Shihezi 832000,China;2.XinJiang Agricultural Vocational and Technical College, Changji 831100,China;3.Institute of Agricultural Sciences of 13 Division Corps,Hami 839000,China)
In order to get bio-control strains with high antagonism activity against kiwi Botrytis cinerea,20 fungi strains were isolated and screened from kiwi fruit orchard soil and the surface of the health kiwi fruit by serial dilution method and spread plate method.Using B.cinerea as target strain,after affination of plate confrontation test,five strains with certain antagonistic activity against the growth of B.cinerea were found through the confrontation experiments.The bacteriostatic diameter of one strain named HuW1 was the widest,and the inhibition ratio against B.cinerea was about 80%.According to the BLAST results of ITS and 26S rDNA D1/D2 domain sequences and the morphology of the colony and cells,this strain was identified to be Hanseniaspora uvarum.
kiwi Botrytis cinerea;biocontrol;antagonistic fungi
S182
A
0254-5071(2014)10-0084-03
10.11882/j.issn.0254-5071.2014.10.020
2014-05-19
兵团博士资金专项(2014BB006)
毕金丽(1987-),女,硕士,研究方向为食品微生物。
*通讯作者:刘娅(1974-),女,副教授,博士,研究方向为食品生物技术。
