利用葡萄枯枝蔓发酵生产木霉菌剂的初步研究
2014-02-24丁苏张劲张瑛杨莹管敬喜文仁德李玮
丁苏,张劲,张瑛,杨莹,管敬喜,文仁德,李玮*
(1.广西大学行健文理学院,广西南宁530004;2.广西壮族自治区农业科学院葡萄与葡萄酒研究所,广西南宁530007)
利用葡萄枯枝蔓发酵生产木霉菌剂的初步研究
丁苏1,张劲2,张瑛2,杨莹2,管敬喜2,文仁德2,李玮2*
(1.广西大学行健文理学院,广西南宁530004;2.广西壮族自治区农业科学院葡萄与葡萄酒研究所,广西南宁530007)
利用葡萄枯枝蔓和甘蔗糖蜜酒精发酵液为主要培养基原料,发酵生产绿色木霉(Trichoderma viride)孢子菌剂。以产孢量为测定指标,通过单因素试验优化了培养基的组成,并测试了发酵基质不灭菌对于木霉发酵的影响。研究结果表明:葡萄枯枝蔓和糖蜜酒精发酵液适宜作为生产绿色木霉的廉价培养基,优化后培养条件为固态基质粒径10~40目,糖蜜酒精发酵液中硫酸铵添加量1.0%,糖蜜酒精发酵液浓度5°Bx,培养基固液混合比2.5∶1(g∶mL)。在此条件下,绿色木霉JK-20直接发酵未灭菌培养基产孢子量可达1.12×1010CFU/g。
葡萄枝蔓;糖蜜酒精发酵液;绿色木霉;固态发酵
木霉是一类具有较强生物防治功效的丝状真菌,其具有生长迅速、能分泌多种抑菌物质、能够对植物病原菌进行重寄生等生理特性,因而在国内外被广泛的用于多种植物病害的生物防治研究[1-3]。其中,绿色木霉(Trichoderma viride)因其生物防治效果明显、环境适应能力较强、营养要求低等优势,成为生产木霉商品级菌剂的重要菌株。目前木霉的商品级农药剂主要为活性孢子粉制剂,通过叶面喷施、处理种子或灌施至土壤和植物根系等方式施用[4-7]。木霉孢子菌剂的生产大多采用粮食作为培养基进行发酵[8-9],生产成本较高,这导致木霉菌剂的市场竞争力不足。为了解决这一困扰木霉菌剂应用的问题,研究人员尝试了许多利用农业生产及农产品加工产生的生物质废弃物发酵木霉的方法[10-12],并已取得了一些进展。
近年来,由于广西农业科学院开发的葡萄“一年两收栽培”技术体系在广西推广应用[13],广西的葡萄栽培面积迅速扩大,在带来可观的经济效益的同时,栽培过程中产生的大量枯枝蔓,已经成为难以处理的一大问题。目前对于葡萄枯枝蔓的处理主要是通过焚烧的方式以消除葡萄园病原微生物孳生的风险,这样就造成了环境的污染和生物质资源的浪费,不符合现代循环经济的发展趋势,但目前尚无对这一废弃物资源加以利用的研究报道。
本研究以葡萄枯枝蔓为固体发酵基质,辅以广西特色大宗农产品加工副产物甘蔗糖蜜酒精发酵液作为补充营养成分的液体基质,通过培养基优化,尝试利用未灭菌的廉价农业废弃物及加工副产物发酵生产绿色木霉孢子菌剂,以期实现广西葡萄栽培废弃物的循环再利用,并为发酵生产廉价木霉菌剂提供新的技术路线。
1 材料与方法
1.1 材料与试剂
葡萄枯枝蔓由广西农业科学院明阳葡萄基地提供;糖蜜酒精发酵液由南宁糖业集团提供。
绿色木霉(Trichoderma viride)JK-20:广西农业科学院葡萄与葡萄酒研究所筛选并保藏。
保藏培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,自来水1 000 mL,pH自然。
产孢子固体培养发酵基质:葡萄修剪产生的枯枝蔓,甘蔗糖蜜酒精发酵液,(NH4)2SO4。
葡萄糖(分析纯)、硫酸铵(分析纯):国药集团化学试剂有限公司;琼脂粉(生化级):北京奥博星公司。
1.2 仪器与设备
XB-K-25血球计数板:上海安信光学仪器公司;HH. B11.600-S恒温培养箱:上海跃进医疗器械厂;B11-2磁力搅拌器:上海司乐仪器有限公司。
1.3 方法
1.3.1 菌种活化
将保藏的绿色木霉JK-20斜面上的孢子用生理盐水洗下制备成浓度为105CFU/mL的单孢子悬浮液,稀释涂布于PDA平板上,30℃培养36 h,挑取生长迅速、表面长满绿色孢子的单菌落接种于PDA斜面上,30℃培养3 d,至斜面培养基表面长满。
1.3.2 固态发酵方法及产孢量测定
将葡萄枯枝蔓按要求粉碎过筛,(NH4)2SO4预先溶解于稀释至5°Bx的糖蜜酒精发酵液中,二者按比例混合均匀后,称取10 g装入250 mL三角瓶中封口灭菌,活化后的绿色木霉斜面种子用生理盐水制备浓度为107CFU/mL的单孢子悬浮液。将单孢子悬浮液接入固态发酵培养基中30℃培养5 d。发酵后取1 g发酵物,0.1%吐温水稀释,在磁力搅拌器上充分搅拌,血球计数板测定孢子浓度[14]。
1.3.3 固态发酵培养基的单因素试验
粒径对产孢量的影响:将葡萄枯枝蔓按常规粉碎,分别过10目、40目和80目筛,得到4种不同细度的基质,其粒径大小范围由粗到细分别为≥10目、10~40目、40~80目、≤80目,将它们对应编号为1、2、3、4号样品。按葡萄枯枝蔓颗粒/糖蜜酒精发酵液2∶1(g∶mL)的比例加入5°Bx的糖蜜酒精发酵液,充分混匀后按每瓶装料量100 g的量分装于500 mL三角瓶中,121℃湿热灭菌30 min,冷却后每瓶接种1 mL种子液,30℃静置培养5 d,至基质表面长满均匀的绿色孢子为止。培养物于45℃烘干后,用无菌水洗涤制备孢子悬浮液,再用血球计数板测定孢子生成量。
固液基质配比对产孢量的影响:分别按葡萄枯枝蔓颗粒/糖蜜酒精发酵液1.5∶1、2.0∶1、2.5∶1和3.0∶1(g∶mL)配制发酵基质,按上述方法接种、发酵并测定孢子生成量。
糖蜜酒精发酵液浓度对产孢量的影响:分别调整糖蜜酒精发酵液的浓度为1.0°Bx、2.5°Bx、5.0°Bx、7.5°Bx和10.0°Bx,按上述中方法接种、发酵并测定孢子生成量。
氮源添加量对产孢量的影响:分别在混料前将0.5%、 1%、2%、3%和4%的(NH4)2SO4溶于糖蜜酒精发酵液中,混料后按上述方法接种、发酵并测定孢子生成量。
1.3.4 利用未灭菌基质发酵生产木霉菌剂试验
将木霉种子孢子液接种于经121℃高压温热灭菌20 min或未灭菌的糖蜜酒精发酵液中,预培养24 h后,分别与经121℃高压温热灭菌20 min和未灭菌的固体基质混合,30℃静置培养5 d,至基质表面长满均匀的绿色孢子为止。培养物于45℃烘干后,用无菌水洗涤制备孢子悬浮液,悬浮液用8层擦镜纸过滤除菌丝后,稀释涂布于PDA平板上,30℃静置培养36 h,统计木霉菌落的生成量,换算出孢子的生成量。通过对比研究基质是否灭菌对于木霉菌剂发酵的影响。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 固体基质粒径对产孢量的影响
在固态发酵过程中,固体基质的粒径大小对发酵的影响很大[12],粒径过大,基质的比表面积则小,微生物难以在短时间内充分利用基质颗粒,粒径过小,则容易造成培养基结团或内部空隙过小,不利于发酵系统的传质、传热。因而,两种情况均不利于微生物充分利用基质进行生长。不同基质粒径条件下绿色木霉JK-20的产孢子量如图1所示。由图1可知,2号处理样品(粒径为10~40目)的基质最适于木霉产孢,其产孢量可达1.2×1010CFU/g干培养物。

图1 固体基质粒径对于产孢量的影响Fig.1 Effect of particle size of raw materials on spore production
2.1.2 固液基质配比对产孢量的影响
在固态发酵中,适宜的固液配比能使培养基具有最适的含水量,从而保持较好的疏松度,有利于微生物生长和发酵过程中的传质传热[15-16]。本实验中,糖蜜酒精发酵液为固态发酵的培养基基质提供了水分、无机盐类、部分氮源和碳源。不同的葡萄枯枝蔓颗粒/糖蜜酒精发酵液条件下JK-20的产孢子量结果如图2所示。由图2可知,当葡萄枯枝蔓颗粒/糖蜜酒精发酵液为2.5∶1(g∶mL)时JK-20的产孢子量最高,达到1.37×1010CFU/g干培养物。

图2 固液基质比例对于产孢量的影响Fig.2 Effect of solid-liquid ratio on spore production
2.1.3 糖蜜酒精发酵液浓度对产孢量的影响
糖蜜酒精发酵液在本实验中对木霉的生长提供了多种营养成分[17]。糖蜜酒精发酵液浓度过低,木霉的菌丝体生长较弱,影响孢子的生成总量;糖蜜酒精发酵液浓度过高,木霉菌丝体生长过于旺盛,也会影响孢子的分化。糖蜜酒精发酵液的浓度对JK-20的产孢子量的影响如图3所示。由图3可知,产孢子量随糖蜜酒精发酵液的浓度增大而增加,当糖蜜酒精发酵液的浓度>5°Bx,产孢量趋于稳定,因而选择5°Bx作为最适糖蜜酒精发酵液浓度。
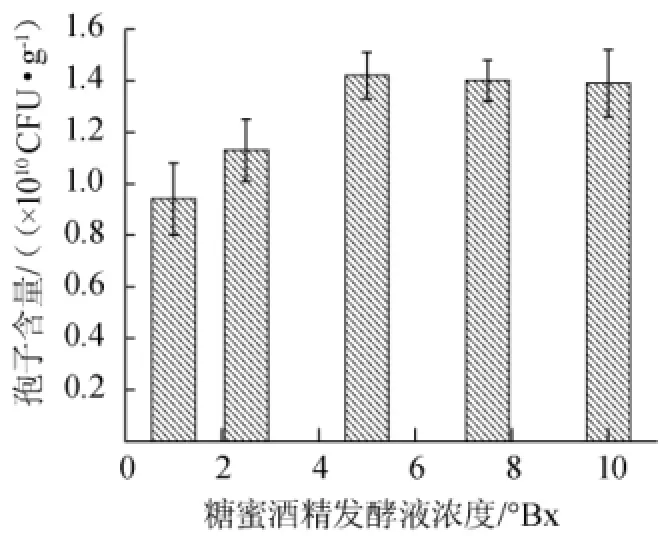
图3 糖蜜酒精发酵液浓度对于产孢量的影响Fig.3 Effect of molasses alcohol fermentation mash concentration on spore production
2.1.4 (NH4)2SO4添加量对产孢量的影响
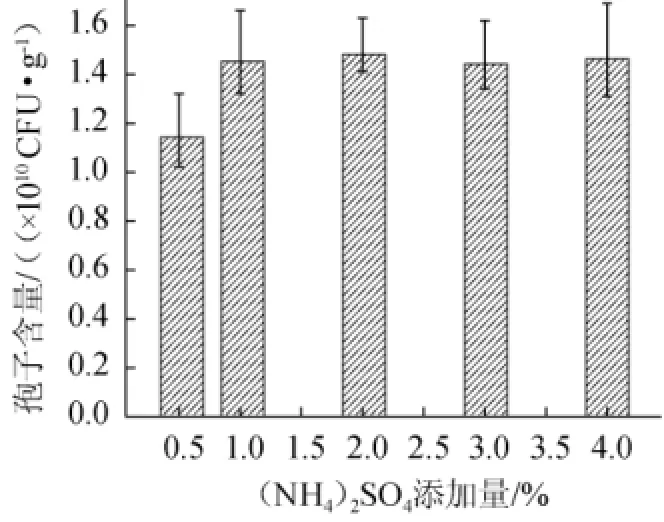
图4 (NH4)2SO4添加量对于产孢量的影响Fig.4 Effect of(NH4)2SO4addition on spore production
(NH4)2SO4是常用的廉价无机氮源,适量无机氮源能促进菌丝体生长,有利于产孢量的增加,但过量的氮会抑制孢子的分化。(NH4)2SO4添加量对JK-20的产孢子量的影响如图4所示。由图4可知,当(NH4)2SO4添加量达到1.0%之后,继续添加(NH4)2SO4对于木霉菌产孢没有显著促进。因此(NH4)2SO4最适添加量为1.0%。
2.2 利用未灭菌基质发酵生产木霉菌剂试验
木霉菌剂等生物农药与化学农药相比,成本偏高是其主要劣势之一。应用农业生产或农产品加工过程中产生的生物质废弃物生产木霉菌剂的最主要目的之一就是降低生产和使用成本。而对发酵基质进行灭菌操作,需要消耗大量的蒸汽和能源,对于发酵设备的要求也较高,这样会造成更高的生产成本,不利于技术的实际应用。因此,在确定最优发酵条件后对部分或全部发酵基质不进行任何灭菌处理,直接进行接种发酵,结果如表1所示。由表1可知,在发酵基质未灭菌的条件下,JK-20最终产孢子量少于经121℃高压温热灭菌20 min条件下产孢子量,这可能是因为在未灭菌条件下,发酵基质中存留有大量的野生杂菌,与木霉JK-20发生了竞争作用,从而在一定程度上影响了JK-20的菌丝体生长和孢子的生成量。其中,固体基质灭菌与否对于木霉产孢子量的影响略大于糖蜜酒精发酵液灭菌与否的影响,这可能是因为葡萄枯枝蔓在露天环境下堆放过程中携带了更多的与木霉存在竞争作用的微生物。尽管如此,但由于省去了灭菌环节,无需灭菌设备及无菌发酵设备,发酵过程的成本大大下降,这使得利用未灭菌基质发酵木霉菌剂具备很大的优势。

表1 绿色木霉JK-20利用未灭菌基质发酵产孢子量Table 1 Spore production of T.viride JK-20 by non-sterilizedfermentation substrate
3 结论
结果表明,葡萄枯枝蔓和糖蜜酒精发酵液适宜作为生产绿色木霉的廉价培养基,本研究优化后培养条件为固态基质粒径10~40目,糖蜜酒精发酵液中硫酸铵添加量1.0%,糖蜜酒精发酵液浓度5°Bx,培养基固液混合比2.5∶1(g∶mL)。在此条件下,绿色木霉JK-20直接发酵未灭菌培养基产孢子量可达1.12×1010CFU/g。
绿色木霉是一种应用很广的生物防治微生物,能够防治灰霉病等多种由植物病原真菌引起的植物病害。目前,生产成本偏高,是阻碍木霉菌剂推广应用的主要原因之一。利用农业及农产品加工业产生的生物质废弃物,在不经灭菌的条件下直接接种绿色木霉发酵制备木霉菌剂,虽然与使用灭菌基质相比,其孢子产量有所下降,但其孢子产量仍可达到已有生物防治菌菌剂生产的水平[18-20]。由于减少了灭菌环节,生产成本和工艺难度大幅降低,便于普通种植户自行完成,因此该新工艺具有一定的应用前景。
[1]MATARESE F,SARROCCO S,GRUBER S,et al.Biocontrol of Fusarium head blight:interactions between Trichoderma and mycotoxigenic Fusarium[J].Microbiology,2012,158(1):98-106.
[2]YANG X M,CHEN L H,YONG X Y,et al.Formulations can affect rhizosphere colonization and biocontrol efficiency of Trichoderma harzianum SQR-T037 against Fusarium wilt of cucumbers[J].Biol Fert Soils, 2011,47(3):239-248.
[3]JEGATHAMBIGAI V,KARUNARATNE M D,SVINNINGEN A,et al. Biocontrol of root-knot nematode,Meloidogyne incognita damaging queen palm,Livistona rotundifolia using Trichoderma species[J].Commun Agric Appl Biol Sci,2008,73(4):681-687.
[4]郭润芳,刘晓光,高克祥,等.拮抗木霉菌在生物防治中的应用与研究进展[J].中国生物防治,2002,18(4):180-184.
[5]夏飞,张于,旭热,等.生防菌哈茨木霉Trichoderma harzianum T4对西瓜根围土壤细菌群落的影响[J].中国生物防治学报,2013,29(2):232-241.
[6]王淑霞,张丽萍,黄亚丽,等.哈茨木霉Tr-92诱导黄瓜对灰霉病系统抗性的研究[J].中国生物防治学报,2013,29(2):242-247.
[7]陈臻,古丽君,徐秉良,等.长枝木霉对6种牧草种子发芽与生理效应的影响[J].草地学报,2013,21(3):564-570.
[8]邵红涛,许艳丽,李春杰,等.筛选用于防治大豆尖孢镰刀菌根腐病的木霉菌株[J].中国油料作物学报,2004,26(4):76-79.
[9]梁昌聪,刘磊,张建华,等.响应面法优化绿色木霉H06产孢发酵培养基[J].热带作物学报,2014,35(2):333-338.
[10]谭显东,王君君,胡伟,等.三七渣固态发酵生产生防菌康宁木霉[J].环境科学与技术,2014,37(4):62-67.
[11]曾庆才,肖荣凤,刘波,等.以微生物发酵床养猪垫料为主要基质的哈茨木霉FJAT-9040固体发酵培养基优化[J].热带作物学报,2014,35(4):771-778.
[12]王君君,谭显东,羊依金,等.三七渣固态发酵生产生防菌绿色木霉的初步研究[J].中国酿造,2012,31(11):62-65.
[13]白先进,李杨瑞,黄江流,等.广西南部巨峰葡萄一年两收栽培模式研究[J].西南农业学报,2008,21(4):953-955.
[14]陈欣,李寅,堵国成,等.应用响应面方法优化Coniothyrium minitans固态发酵生产生物农药[J].工业微生物,2004,34(1):26-29.
[15]阚国仕,陈春,陈红漫,等.绿色木霉95106固态发酵生产纤维素酶条件优化研究[J].中国酿造,2011,30(12):130-133.
[16]武香玉,陈存社,张京,等.绿色木霉固态发酵生产纤维素酶的研究[J].中国酿造,2010,29(5):93-96.
[17]陈桂光,曾日华,张云开,等.绿色木霉发酵强化糖蜜酒精废液活性炭脱色效果的研究[J].中国酿造,2011,30(4):122-124.
[18]庄敬华,高增贵,刘限,等.不同发酵条件对木霉产孢类型的影响[J].中国生物防治,2005,21(1):37-40.
[19]陈碧云,周乐聪,陆致平.绿色木霉发酵配方与防治油菜菌核病的研究[J].中国生物防治,2001,17(2):67-70.
[20]BAI Z H,JIN B,LI Y J,et al.Utilization of winery wastes for Trichoderma viride biocontrol agent production by solid state fermentation[J]. J Environ Sci,2008,20(3):353-358.
Production of Trichoderma viride culture using grape branches
DING Su1,ZHANG Jing2,ZHANG Ying2,YANG Ying2,GUAN Jingxi2,WEN Rende2,LI Wei2*
(1.Xingjian College of Science and Liberal Arts,Guangxi University,Nanning 530004,China; 2.Viticulture and Wine Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007,China)
Trichoderma viride spore culture was produced using grape branches and molasses alcohol fermentation mash as main medium material. Using spore production as index,the medium composition was optimized by single factor test,and the effect of non-sterilization fermentation substrate on T.viride fermentation was investigated.The result showed that the low-cost medium of grape branches and molasses alcohol fermentation mash was suitable for T.viride fermentation.The optimal medium was obtained as follows:particle size of the solid substrate 10-40 mesh,(NH4)2SO41.0%in molasses alcohol fermentation mash,molasses alcohol fermentation mash 5°Bx and solid-liquid ratio 2.5∶1(g∶ml).Under this condition,the spore production of T.viride JK-20 by fermenting non-sterilized medium was 1.12×1010CFU/g.
grape branches;molasses alcohol fermentation mash;Trichoderma viride;solid-substrate fermentation
Q939.96
A
0254-5071(2014)10-0032-04
10.11882/j.issn.0254-5071.2014.10.008
2014-08-05
广西自然科学基金(2013GXNSFBA019074);广西大学行建文理学院科研基金(2013ZKLX03)
丁苏(1985-),女,助教,硕士,研究方向为微生物工程。
*通讯作者:李玮(1984-),男,助理研究员,博士,研究方向为微生物工程。
