猪流行性腹泻病毒双抗夹心ELISA的建立
2014-02-24祁振强秦智峰
雷 利,彭 姣,祁振强,秦智峰,卢 超
(1.深圳市宝舜泰生物医药股份有限公司,广东深圳 518057;
2.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518045)
猪流行性腹泻病毒双抗夹心ELISA的建立
雷 利1,彭 姣1,祁振强1,秦智峰2,卢 超1
(1.深圳市宝舜泰生物医药股份有限公司,广东深圳 518057;
2.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518045)
用猪流行性腹泻病毒(PEDV)免疫蛋鸡后提取抗猪流行性腹泻病毒的特异性卵黄抗体为捕获抗体,鼠抗猪流行性腹泻病毒多克隆抗体为检测抗体,建立了猪流行性腹泻病毒病原检测的双抗夹心ELISA,其最适包被抗体浓度为1∶4000(12.35µg/mL),鼠抗猪流行性腹泻病毒的多克隆抗体最佳浓度为1∶6000(10.25µg/ mL),样品反应时间为30min,酶标抗体工作浓度为1∶6000,并以OD450≥0.130作为阳性判断标准。该方法与猪传染性胃肠炎、猪轮状病毒、猪流感病毒、大肠杆菌K88、K99、987P、F41等病原无交叉反应。对经猪流行性腹泻病毒PCR检测的100份粪便样本进行检测表明,8份PCR检测阳性样本中6份为本法阳性;PCR阴性者本法全部阴性。实验结果表明该方法具有良好的特异性和敏感性,可用于猪流行性腹泻病毒的快速检测。
猪流行性腹泻病毒;卵黄抗体;双抗夹心ELISA
猪流行性腹泻病毒为冠状病毒科的成员[1],仔猪有较高的发病率和死亡率[2],给某些养猪场带来严重的经济损失。本实验用一株猪流行性腹泻病毒分离株,制备免疫原免疫产蛋鸡,收集高效卵黄,分离提纯纯化制备成特异性抗体;用酶联免疫双抗夹心法检测猪呕吐物及粪便中的腹泻病毒病原[3],及早发现感染猪流行性腹泻病毒的猪只,提前进行治疗并对猪场所有猪只进行健康监控[4]。
1 材料和方法
1.1 材料
酶标板:Costar公司可拆卸酶标板;PEDV特异性卵黄抗体:PEDV毒株(深圳出入境动植
物检验检疫中心自行分离)免疫产蛋鸡,提取含抗PEDV病毒的蛋黄,通过硫酸铵沉淀法粗提抗PEDV卵黄抗体,再经M蛋白进行亲和层析纯化(实验室制备);鼠抗PEDV多克隆抗体:用PEDV毒株免疫小鼠,采集眼睛血液,离心后取血清,进行纯化;酶标二抗:购自Sigma公司;阴阳性样本均由深圳出入境动植物检验检疫中心提供,阴阳性样本的稀释度均为1∶10。
1.2 PEDV-IgY特异性卵黄抗体最佳浓度测定
用包被液将PEDV-IgY特异性抗体按不同稀释倍数进行稀释,按照ELISA程序进行测定,比较样本的OD450值,P/N值最大的确定为最佳包被浓度。
1.3 多克隆抗体最佳稀释度的确定
将PEDV-IgY特异性抗体按确定的最佳浓度进行包被,再将纯化的鼠抗PRDV-IgG多克隆抗体按不同倍数稀释,按照ELISA程序进行测定,比较样本的OD450值,P/N值最大的确定为最佳多抗稀释浓度。
1.4 最佳封闭液的选择
用5%的脱脂奶粉、酪蛋白钠、5%胎牛血清、1%BSA、鱼明胶作封闭液,酶标仪上读出OD450值,比较阴阳性样本的OD450值,确定最佳封闭液。
1.5 酶标二抗最佳稀释度的选择
将多克隆抗体按最佳浓度稀释后,加入不同浓度的倍比稀释的HRP-羊抗鼠IgG,按照ELISA程序进行测定,比较样本的OD450值,确定酶标二抗的最适工作浓度。
1.6 血清作用时间和酶标二抗作用时间确定
由以上试验确定好包被浓度,多抗及酶标二抗浓度,37 ℃分别作用不同时间,按照ELISA程序进行测定,比较样本的OD450值,确定最佳反应时间。
1.7 阴阳临界值的确定
按已建立的双抗体夹心ELISA方法,检测20份阴性血清,每份设三个重复。计算出阴性血清OD450平均值(X)和标准差(S),以X+3S的值为阴性和阳性的临界值。
1.8 特异性检测
用ELISA方法对本实验室保存的猪传染性胃肠炎病毒抗原、猪轮状病毒抗原、猪流感病毒抗原、产肠毒素大肠杆菌K88,K99、987P、F41抗原发生交叉反应,及由深圳出入境动植物检验检疫中心提供的20份阴性血清进行特异性鉴定,并用PEDV抗原作阳性对照,
1.9 临床样本检测
用来自比利美英伟营养有限公司恩平试验中心经PCR所检测过的100份样本,其中PCR检测有8份为阳性的样本中用本实验室建立的双抗体夹心ELISA方法进行检测(实验结果另文公布),有6份相同编号的样本检测为阳性,其它样本全部检测为阴性。
1.10 敏感性实验
结合阴阳临界值判定,建立的双抗体夹心ELISA方法的敏感性为105(55.930 ng/mL)
2 结果
2.1 PEDV-IgY特异性卵黄抗体最佳浓度的测定当包被浓度为1∶4000(12.35µg/mL)时,P/N值最大(表1),故将此确定为包被浓度。
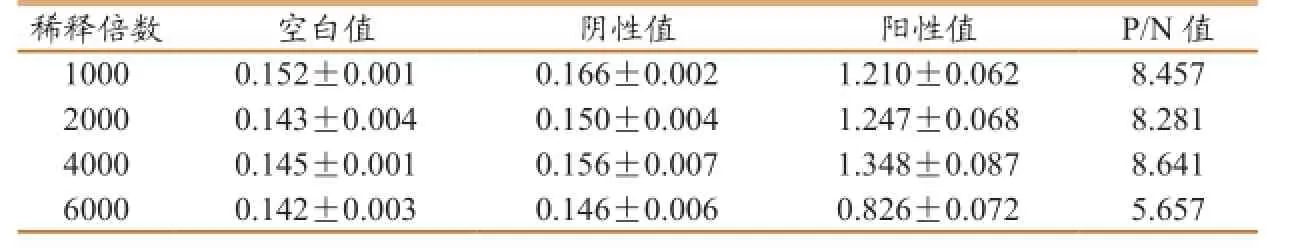
表1抗体最适稀释浓度确定
2.2 多抗最佳稀释度浓度的确定
当多抗浓度为1∶1000(10.25µg/mL)时,P/N值最高(表2),故将此确定为多抗最佳浓度。
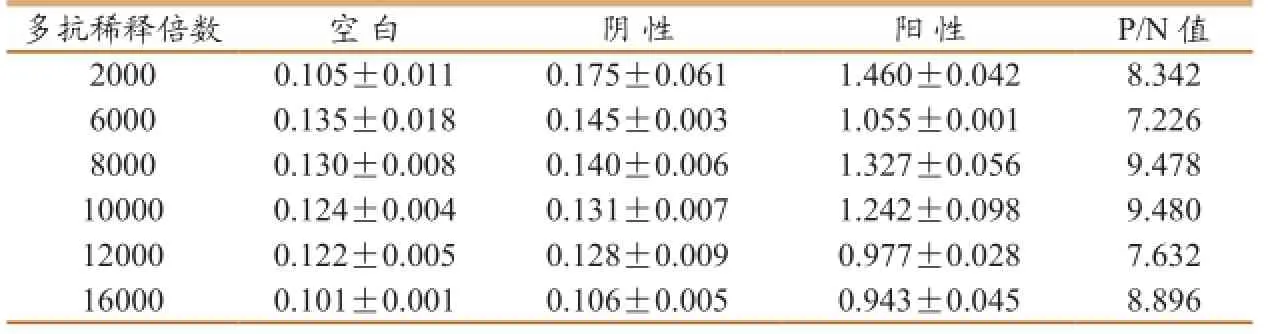
表2多克隆抗体最适稀释度确定
2.3 最佳封闭液选择
用鱼明胶作封闭液时,P/N值最大(表3),故选鱼明胶为最佳封闭液。
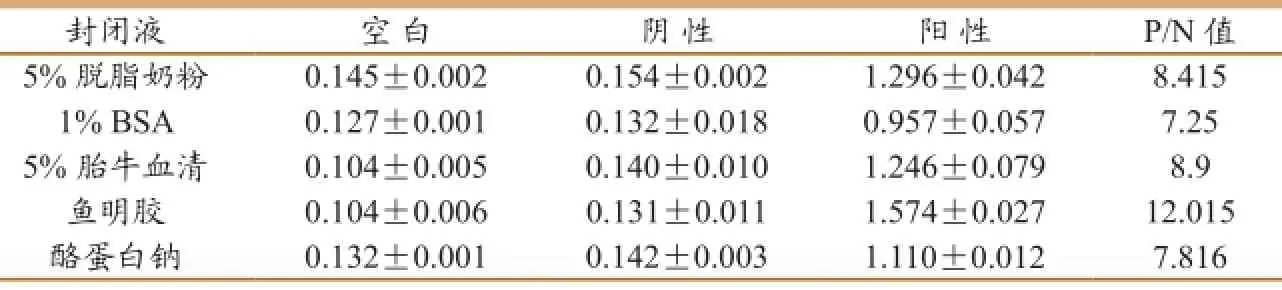
表3最佳封闭液的确定
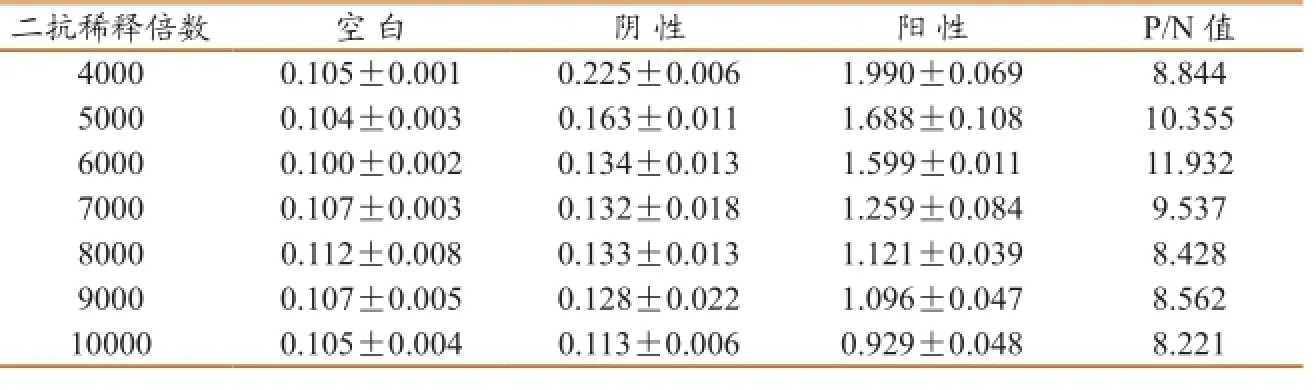
表4酶标二抗最佳浓度确定

表5样本最佳反应时间的确定
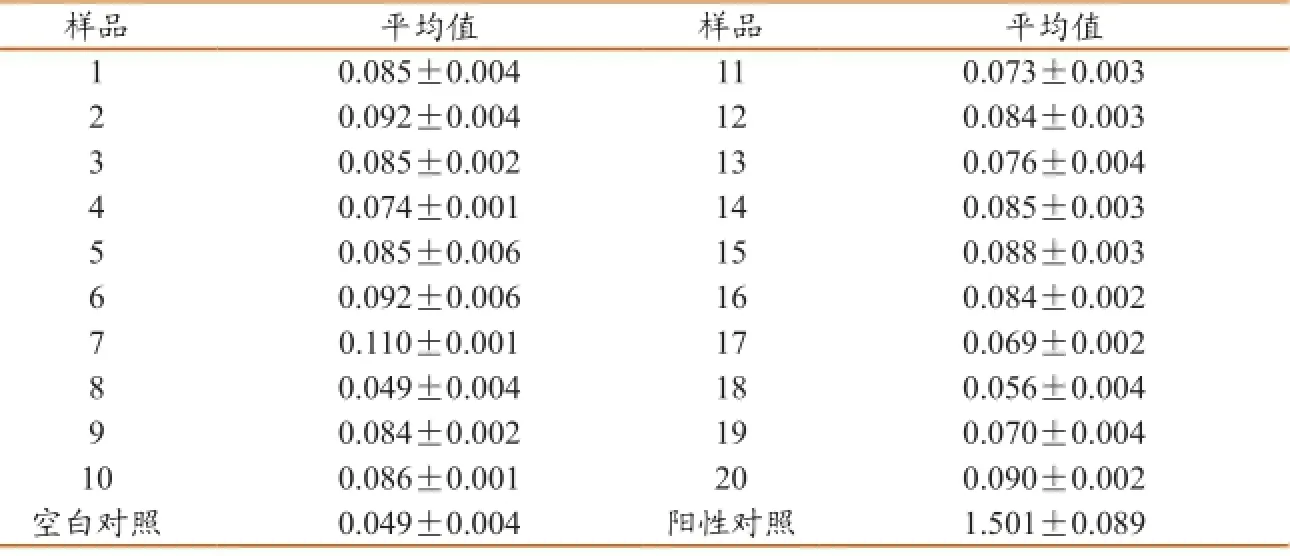
表6阴阳临界值的确定
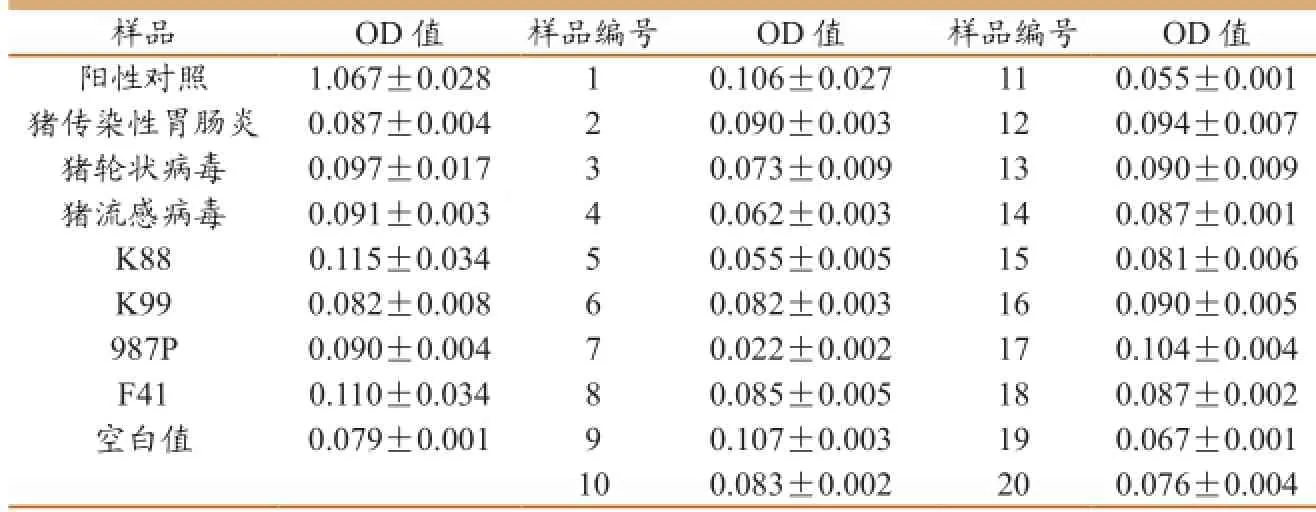
表7特异性实验结果
2.4 酶标二抗最佳浓度
当酶标二抗作6000倍稀释时,P/N值最高(表4),故确定此浓度为最佳二抗浓度。
2.5 样本最佳反应时间确定
当样本作用时间为0.5h时,阳性对照OD值为1.020,接近1.0,阴性对照OD值较低,本底也较低,P/N值最大(表5),故样本作用时间确定为0.5h。
2.6 阴阳临界值的确定
按照已建立的双抗体夹心ELISA方法检测10份阴性样本,计算其OD450的平均值及标准方差,阴阳性临界值= X +3SD。经计算,阴阳性临界值=0.08427+3×0.015252=0.130 因此把临界值定为0.130。在阴阳对照成立的情况下,OD450大于0.130就可以判定猪流行性腹泻病毒抗原阳性,否则,判为阴性(表6)。
2.7 特异性试验
PEDV只与PEDV抗原发生反应,而不与猪传染性胃肠炎抗原、猪轮状病毒抗原、猪流感病毒抗抗原、产肠毒素大肠杆菌K88,K99、987P、F41抗原发生交叉反应,另有20份阴性血清均不产生反应,说明建立的双抗体夹心ELISA方法特异性好。
2.8 敏感性试验
如表8所示,结合阴阳临界值判定,建立的双抗体夹心ELISA方法的敏感性为105(55.930 ng/mL)。
2.9 临床样本检测
由试验确定的阴阳临界值为0.130,阴阳对照和空白对照成立,用来自比利美英伟营养有限公司恩平试验中心经PEDV-PCR所检测过的100份样本,其中PCR检测有8份为阳性的样本中用本实验室建立的双抗体夹心ELISA方法进行检测(检验结果将另文公布),有6份相同
编号的样本检测为阳性(表9)。
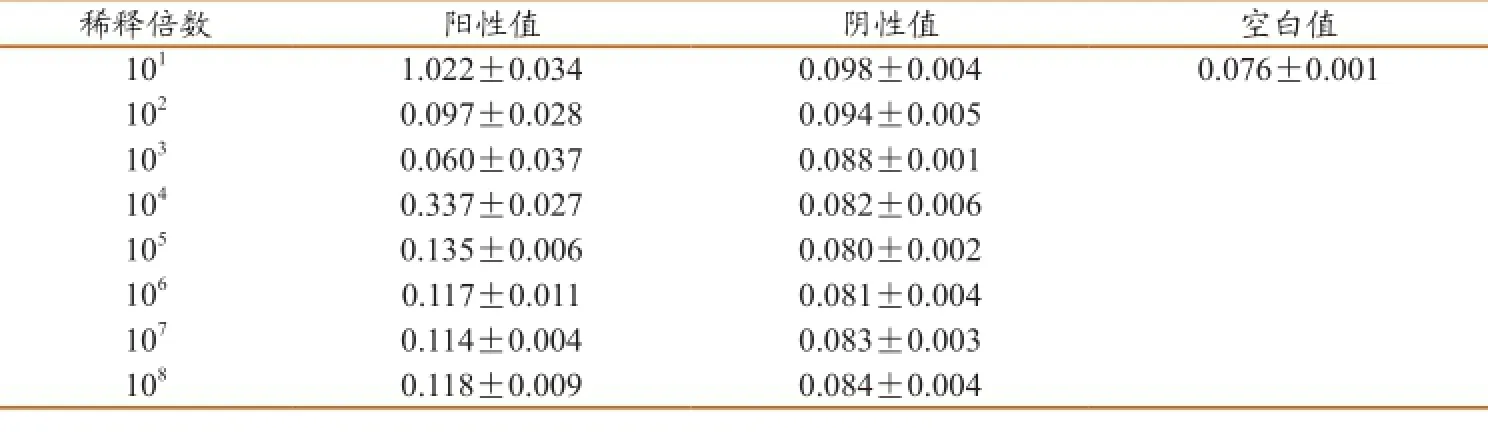
表8敏感性试验结果
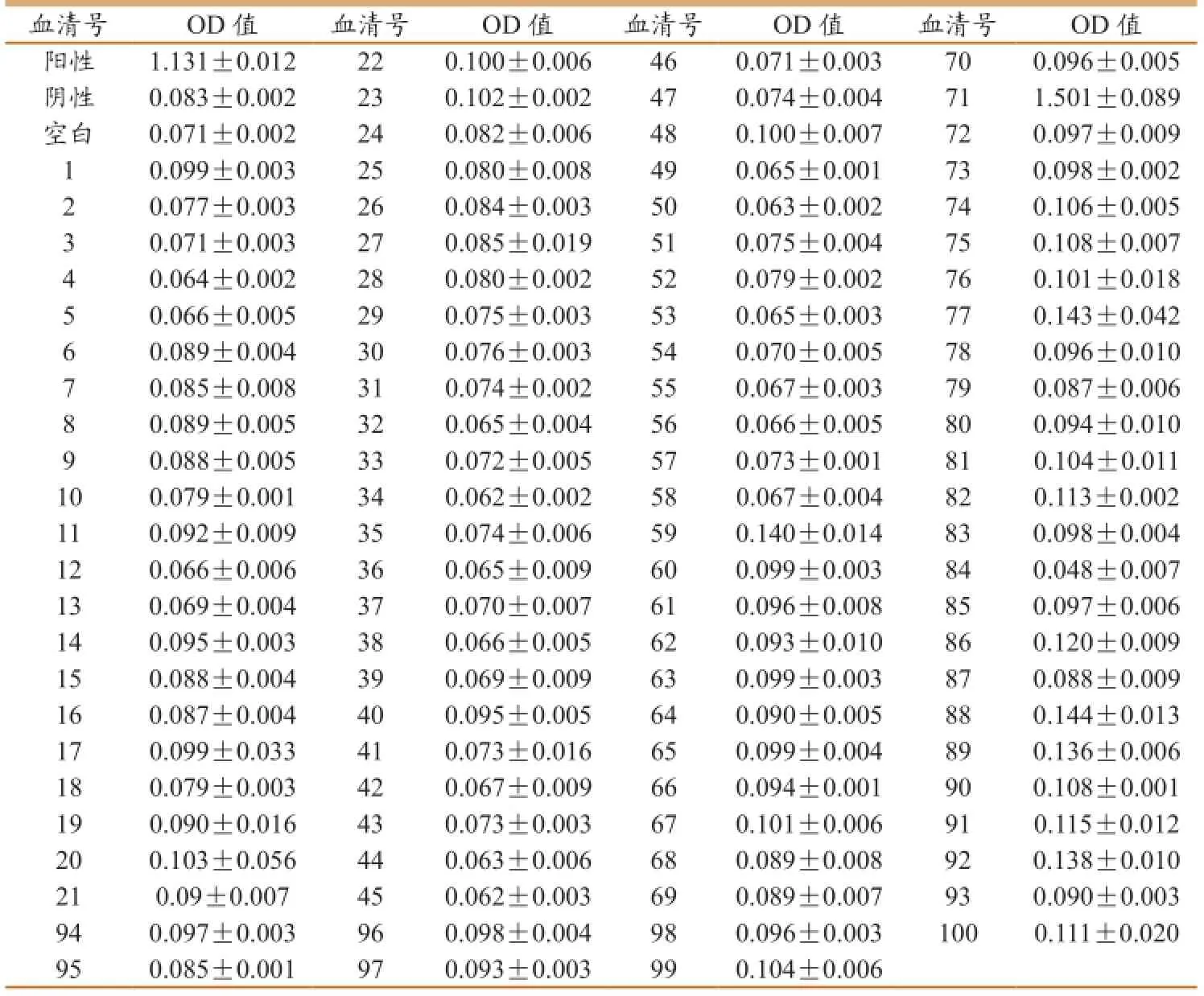
表9双抗体夹心ELISA法检测不同样品的抗原
3 讨论
猪流行性腹泻病(PED)是由PEDV引起的一种高度接触性肠道传染病,发病特征为呕吐、水样腹泻、脱水,对仔猪具有高效致病率[5]。在自然情况下,PEDV对不同年龄阶段猪群都易感,其中7日龄以内的哺乳仔猪多发死亡率高[6]。PEDV与猪传染性胃肠炎病毒(TGEV)同属冠状病毒属成员,二者在病毒粒子形态、临床症状及流行病学方面极为相似,难以区分[7];而且早些年对此病的实验室诊断主要是采用免疫电镜法、PCR、直接免疫荧光法、微量血清中和试验等[8-9],但是这些方法对实验室基础条件及仪器要求较高,不能普遍使用。本研究采用酶联免疫双抗夹心法检测,检测结果准确、灵敏度高,具有广泛应用前景。
卵黄抗体(IgY)是用抗原免疫蛋鸡后产生的免疫球蛋白由血液转入卵黄中形成的[10],其化学性质稳定、产量高、成本低,具有开发功能性食品和新药的潜能。目前IgY主要用于疾病诊断检测和防治[11]、食品添加剂及化妆品领域等。而卵黄抗体作为一种高效的生物活性免疫球蛋白,能对一种疾病更好的进行监测。目前用卵黄抗体研制成防治仔猪腹泻病毒药物的研究较多[12],但卵黄抗体在双抗夹心用作包被抗体检测抗原的研究较少,所以本实验中利用卵黄抗体这一特异进行疾病的抗原检测,检测病毒能早日对猪只情况进行监控及早日治疗。
此实验选择PEDV IgY特异性抗体作为第一抗体包被96孔酶标板来捕获样品中的抗原,用多克隆抗体作为第二抗体,因为这种特异性抗体可以针对单一抗原决定簇,具有表位特异性,先用PEDV-IgY特异性卵黄抗体包被酶标板,特异性的捕获PEDV抗原,再加入鼠抗PEDV-IgY多克隆抗体,增加了该方法的特异性[13]。通过对ELISA实验中各项条件的优化,本试验确定了最佳抗体包被浓度1∶4000,多抗最佳稀释浓度1:6000,最佳封闭液为鱼明胶、酶标二抗最佳浓度为1:6000、样本最佳反应时间0.5h,显色时间(37℃,10min)和阴阳临界值(OD450≥0.13为阳性),有效降低
了非特异性反应,保证了检测方法的准确性和灵敏性。用所建立方法对传染性胃肠炎抗原、猪轮状病毒抗原、猪流感抗原抗原、产肠毒素大肠杆菌K88,K99、987P、F41抗原进行交叉反应,均为阴性,证实该方法具有较好的特异性、敏感性和重复性,可以用于PEDV抗体的检测和相关流行病学调查。
用来自比利美英伟营养有限公司恩平试验中心经PEDV-PCR所检测过的100份样本,在PCR检测8份阳性样本中,有6份用本实验室建立的双抗体夹心ELISA方法检测阳性,符合率可达96%。双抗体夹心ELISA方法已被大量用于动物疫病的临床诊断,但目前还没有查到与此方法相同的文献,报道的大多是抗体检测,不利于早期发现病毒感染。本研究建立的PEDV抗体夹心ELISA方法弥补了现有PEDV检测方法的不足,用本研究建立的夹心ELISA法检测PEDV抗原非常方便,直接采用粪便、呕吐物均可作为临床样品进行检测。
[1] Oldham J. Pig Farming [J]. Health Serv J,1972,121:18.
[2] Wood EN. An apparently new syndrome of porcine epidemic diarrhoea [J]. Vet Rec,1977,100(12):243-244.
[3] Carvajal A,Lanza I,Diego R,etc. Evaluation of a blocking ELISA using monoclonal antibodies for the detection of porcine epidemic diarrhea virus and its antibodies [J]. J Vet Diagn Invest,1995,7(1):60-64.
[4] 朱书梁,何少华,游秋花.当前规模化猪场病毒性腹泻的防控策略[J].中国动物检疫,2013,30(6):58-61.
[5] 毛黎红,朱义嘉,李冬光.仔猪病毒性腹泻综述[J].贵州畜牧兽医,2013,37(6):14-16.
[6] Sun R Q,Cai R J,Chen Y Q,et al. Outbreak of porcine epidemic diarrhea in suckling piglets,China[J]. Emerg Infect Dis,2012,18(1):161-163.
[7] Duarte M,Gelf J,Lambert P,et al. Genome organization of porcine epidemic diarrhoea virus [J]. Adv Exp Med Biol,1993,342:55-60.
[8] Jung K,Chae C. RT-PCR-based dot blot hybridization for the detection and differentiation between porcine epidemic diarrhea virus and transmissible gastroenteritis virus in fecal samples using a non-radioactive digoxigenin cDNA probe [J]. J Virol Methods,2005,123(2):141-146.
[9] 张长英.几种仔猪腹泻病的鉴别诊断[J].中国动物检疫,2001,18(7):37.
[10] Warr G W, Magor K E,Higgins D A. IgY:clues to the origins of modern antibodies[J].Immunology,1995,16(8):392-398.
[11] Yokoyama H,Peralta RC,Diaz R. Passive protective of chicken egg yolk immunoglobulins against experimental enterotoxigenic Escherichia coli infection in neonatal pig[J].Infection and immunity,1992,60(3):998-1007.
[12] 房祥军.卵黄抗体的特性及其在仔猪腹泻防治上的应用[J].中国兽医杂志,2013,39(4):24-27.
[13] Dávalos-Pantoja L, Ortega-Vinuesa JL, Bastos-González D,et al. A comparative study between the adsorption of IgY and IgG on latex particles[J]. Biomater Sci Polymer Ed,2000,11(6):657-673.
Development of a Double Antiby Sandwich ELISA for Detection of Porcine Epidemic Diarrhea Virus
Lei Li1,Peng Jiao1,Qi Zhenqiang1,Qin Zhifeng2,Lu Chao1
(1.Shenzhen Boostie Biological Pharmaceutical CO. ,LTD,Shenzhen,Guangdong 518057;2. Animal & Plant Inspection and Quarantine Technology Center,Shenzhen Enter-Exit Inspection and Quarantine Bureau,Shenzhen,Guangdong 518103)
Porcine epidemic diarrhea virus(PEDV)was used to immunize laying hens for preparation of specifc yolk antibody(IgY)as capturing antibody. A double antibody sandwich ELISA(DAS-ELISA)was developed for the detection of PEDV in pigs. The optimal coating concentration of anti-PEDV IgY was 1∶4000(12.35µg/mL);the optimal concentration of mouse-anti-PEDV polyclonal antibody was 1∶6000(10.25µg/mL);optimal reaction time was 30 minutes;optimal working concentration of HRP-labelled goat-anti-mouse IgG was 1∶6000;and the positive standard value was OD450≥0.130. The DAS-ELISA showed no cross-reaction with porcine transmissible gastroenteritis virus,porcine rotavirus,Escherichia coli k88/k99/987P/F41. One hundred clinical fecal samples which had been detected by real-time PCR were analyzed by this method. 6 out of 8 real-time PCR positive samples were positive in the DASELISA,and all the negative samples in real-time PCR were negative in the DAS-ELISA. The results indicated that the DAS-ELISA was highly specifc,reproducible and sensitive,and suitable for rapid detection of PEDV.
porcine epidemic diarrhea virus( PEDV);IgY;double antibody sandwich ELIS
S852.65
:A
:1005-944X(2014)12-0065-05
深圳市科创委技术创新计划专项基金资助项目,No. CXZZ20130320154210829
