醋酸菌对苹果汁酒精发酵的影响
2014-02-23代鹏,何丹,王晋,栾静,孙玉梅
代 鹏,何 丹,王 晋,栾 静,孙 玉 梅
(1.大连工业大学 生物工程学院,辽宁 大连 116034;2.中国生物发酵产业协会,北京 100833)
0 引 言
微生物混合发酵技术在污染物降解、燃料乙醇、食品和氨基酸工业等领域有着广泛应用[1]。利用酵母菌与醋酸菌在适当条件下可以互利共生,通过酒精和醋酸同步发酵进行混菌发酵酿造果醋[2]。国外已有将酒精与醋酸混合发酵生产食醋的研究报道[3-4]。与传统两步发酵相比,混合发酵不仅能够避免中间产物过量积累对菌体的影响,而且还能简化工艺设备、降低能耗和缩短发酵周期[5],对进一步提高果醋生产效率具有很高的应用价值。
本实验选用一株从草莓自然发酵醪中分离的降糖、产酒和产香能力均较酿酒酵母强的裂殖酵母菌株[6],在苹果汁酒精发酵的不同时期接入一定量的醋酸菌,监测发酵过程中2种微生物活菌数、总糖、酒精和滴定酸含量及CO2失重量的变化,考察了不同时期接种醋酸菌对酵母酒精发酵的影响。
1 试 验
1.1 主要材料
裂殖酵母(Schizosaccharomycessp.),由本实验室从草莓自然发酵醪中分离获得并保存[6];醋酸杆菌(Acetobacterpasteurianus)AS1.41,上海迪发酿造生物制品有限公司。
浓缩苹果汁(70.2°Bx),大连海升果业有限责任公司。
1.2 主要仪器与试剂
722G 可见分光光度计,上海精密科学仪器有限公司;WYT-5手持糖量折光仪,上海大庆光线仪器厂。
无水乙醇、氢氧化钠、3,5-二硝基水杨酸、偏重亚硫酸钾、重铬酸钾、浓硫酸等均为分析纯;注射用青霉素钠(400万U/g);注射用硫酸链霉素(100万U/g);制霉素片(50万单位/片)。
1.3 培养基及其制备
1.3.1 酵母菌培养基
菌种保藏与活化培养基(g/L):蛋白胨20,酵母浸粉10,葡萄糖20,琼脂20,pH 6.0,于115 ℃灭菌30min。
平板计数培养基(g/L):同菌种保藏与活化培养基,灭菌冷却至50 ℃左右加入青霉素钠60mg/L和硫酸链霉素100mg/L[6-7]。
一级液体种子培养基:同菌种保藏与活化培养基,但不加琼脂。
二级液体种子培养基:15.2°Bx 苹果汁,于115 ℃灭菌30min。
酒精发酵培养基:15.2°Bx苹果汁,加入偏重亚硫酸钾200mg/L。
1.3.2 醋酸菌培养基
菌种保藏与活化培养基(g/L):葡萄糖10,酵母膏10,CaCO320,琼脂20,pH 自然,于115 ℃灭菌30min,冷却至50 ℃左右加入体积分数3%的无水乙醇。
平板计数培养基:同菌种保藏与活化培养基,灭菌后冷却至50 ℃左右加入50mg/L 的制霉菌素[7-8]。
液体种子培养基(g/L):葡萄糖15,酵母膏10,K2HPO40.5,MgSO40.5,115℃灭菌30min,使用前加入体积分数3%的无水乙醇。
1.4 培养方法
1.4.1 酵母种子液的制备
取4 ℃保藏的酵母菌接种于活化培养基中,于30 ℃活化培养24h。取2环活化好的菌种接入一级种子培养基中,于30℃静置培养24h。二级种子培养基中接入体积分数10%的一级种子液,于30 ℃、160r/min摇床培养13h,得成熟二级种子液。
1.4.2 醋酸菌种子液的制备
将4 ℃保藏的醋酸菌接入活化培养基中,于30 ℃活化培养72h。取2环活化好的菌种接入液体种子培养基中,于30℃、120r/min摇瓶培养30h,得成熟种子液。
1.4.3 酵母乙醇发酵
向酒精发酵培养基中接入体积分数10%的成熟酵母二级种子液,10层纱布封口,于25 ℃、120r/min摇床培养8h,再用发酵栓取代纱布封口,于25 ℃静止培养12d。
1.5 不同阶段接入醋酸菌对酒精发酵的影响
分别向发酵第1、4和7天的酒精发酵液中接入一定量成熟醋酸菌种子液,以未接醋酸菌为对照,考察不同时期接入醋酸菌对酒精发酵的影响。
1.6 分析方法
采用标准碱滴定法[9]滴定酸含量(以苹果酸计);采用硫酸-重铬酸钾氧化比色法[10]测定乙醇含量;采用稀释涂平板法[11]测定酵母、醋酸菌活菌数;总糖含量测定:先将发酵上清液用6mol/L HCl水解后中和,再采用DNS法测定[12];采用称重法[13]测定CO2失重量。
2 结果与讨论
2.1 醋酸菌对酵母酒精发酵过程中微生物生长的影响
分别在酒精发酵前、中和后期接入醋酸菌,发现酵母菌的生长规律与对照组相同(见图1)。而不同时期接入的醋酸菌活菌数的变化却有明显区别(见图2),其中,中期接入的醋酸菌活菌数在整个发酵过程中基本稳定,表明中期接种更适宜醋酸菌的生存;而前期和后期接种并不利于醋酸菌的生存。
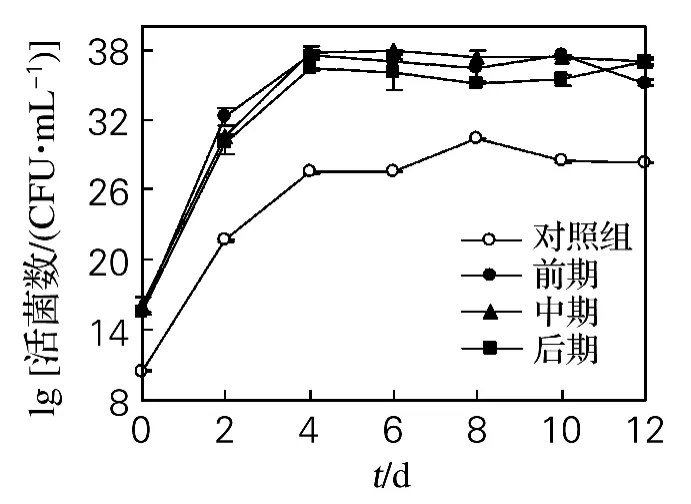
图1 醋酸菌对酒精发酵过程中酵母活菌数的影响Fig.1 Effect of AAB on viable counts of yeast in alcoholic fermentation
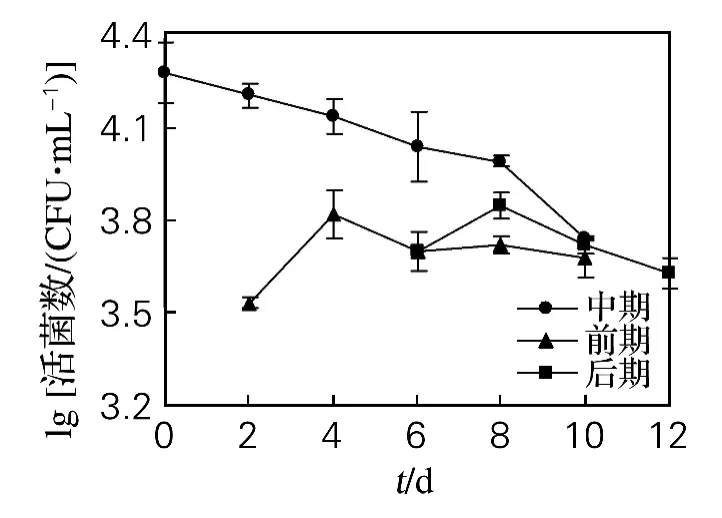
图2 醋酸菌对酒精发酵过程中醋酸菌活菌数的影响Fig.2 Effect of AAB on viable counts of AAB in alcoholic fermentation
在发酵前期,酵母正处于快速生长期,仅有少量酒精生成;而且此时发酵液中游离SO2浓度较高,对前期接种的醋酸菌的生长有较强的抑制作用[14]。此外,不断降低的溶氧也对严格好氧的醋酸菌的生长代谢非常不利,导致醋酸菌活菌数逐渐降低。在发酵中期,SO2浓度较低,对中期接入的醋酸菌的生长抑制作用较小,发酵生成的一定量酒精也为醋酸菌的生长提供了能量,醋酸菌活菌数才能够保持相对稳定。后期接种醋酸菌活菌数呈下降趋势,这可能是由于发酵液中营养物质与氧气较匮乏,生成较多的酒精严重影响了后期接入醋酸菌的生长代谢活性。
2.2 醋酸菌对酒精发酵过程中酒精质量分数的影响
由图3知,不同时期接入醋酸菌对最终酒精含量影响较小。而在前期接种醋酸菌后的第2~10天内,酒精产率与产量均低于对照组,说明前期接入醋酸菌明显抑制了酵母的发酵活性。酒精发酵前期,发酵液中相对较高的溶氧及一定量的乙醇为醋酸菌有氧代谢提供了条件;其代谢产物导致发酵液环境的变化,影响了酵母酒精发酵活性,使产酒速率降低。中期接种醋酸菌的酒精产率比对照组高,酒精产量也较对照组提前2d达到最大,说明中期接种醋酸菌加速了酒精发酵。后期接种醋酸菌对最终酒精产量影响较小,可能与酒精发酵基本结束和醋酸菌代谢活性受环境条件限制有一定关系。
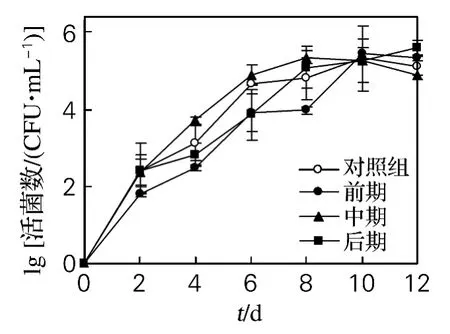
图3 醋酸菌对酒精发酵过程中酒精质量分数的影响Fig.3 Effect of AAB on ethanol content in alcoholic fermentation
2.3 醋酸菌对酒精发酵过程中总糖质量浓度的影响
酵母通过无氧代谢将部分糖转化为酒精。由图4可见,前期接入醋酸菌的耗糖速率明显低于对照组,这一结果与同期酒精含量的变化趋势有一定的对应关系。可推测醋酸菌是通过影响糖代谢来影响酵母乙醇代谢活性。中期接入醋酸菌的降糖速率较快,可能是因为酒精发酵中期的环境有利于醋酸菌的生长,从而加速了糖的消耗。后期接入醋酸菌对降糖影响较小。总体来说,随着接种时间的延后,对降糖的影响逐渐减小。

图4 醋酸菌对酒精发酵过程中总糖质量浓度的影响Fig.4 Effect of AAB on total sugar content in alcoholic fermentation
2.4 醋酸菌对酒精发酵过程中滴定酸质量浓度的影响
由图5可知,不同时期接入醋酸菌的发酵液中滴定酸质量浓度的变化大致呈先升高后降低的趋势,而发酵8~10d,不同时期接种醋酸菌的滴定酸质量浓度均较对照组有不同程度的升高。结合中期接种醋酸菌的酒精变化(图3)可知,中期滴定酸质量浓度的升高可能由酒精转化为醋酸所致。前期接种醋酸菌的酒精发酵后期滴定酸质量浓度突然升高,其原因有待进一步研究。
2.5 醋酸菌对酒精发酵过程中CO2 失重量的影响
酒精发酵过程中CO2失重量的变化反应酵母发酵力的强弱。由图6可见,前期接种明显低于其他3组,这与图2、3中相对应的接种情况下总糖与酒精质量分数的变化趋势相符,进一步证实了前期接种醋酸菌对酵母代谢活性有明显的抑制作用。后期接种醋酸菌的CO2失重量变化与对照组相近,说明后期接种醋酸菌对酵母代谢活性几乎无影响。而中期接种醋酸菌的CO2失重量较对照组和后期接种均提前保持不变,说明酒精发酵提前结束。

图5 醋酸菌对酒精发酵过程中滴定酸质量浓度的影响Fig.5 Effect of AAB on titratable acid content in alcoholic fermentation

图6 醋酸菌对酒精发酵过程中CO2 失重量的影响Fig.6 Effect of AAB on CO2releasing quantities in alcoholic fermentation
3 结 论
酵母菌生理状态及发酵液理化性质的差异使醋酸菌对酒精发酵的影响有别。前期接种醋酸菌对酒精发酵的影响最大,降低了酵母的发酵活力,使降糖和产酒速率降低,发酵周期延长。中期接种,醋酸菌的生长加速了酒精发酵,使发酵周期缩短。因环境条件恶劣不利于醋酸菌的生长代谢,后期接种醋酸菌对酒精发酵几乎没影响。与前期和后期接种醋酸菌相比,中期接种更有利于醋酸菌的生存,其活菌数量能够在较长时间内维持较高水平,有利于后续醋酸发酵的快速启动。然而,前期接种醋酸菌使酒精发酵后期滴定酸含量骤升的原因仍需进一步研究。
目前,关于酵母与醋酸菌混合发酵酿造食醋的报道[2-4,15]均在酒精发酵初始阶段同 时接种,缺乏理论依据。本研究通过在酒精发酵的不同时期接入醋酸菌,研究醋酸菌对酵母酒精发酵的影响,以期为简化果醋发酵工艺奠定基础。
[1]李春笋,郭顺星.微生物混合发酵的研究及应用[J].微生物学通报,2004,31(3):156-161.
[2]卢怡,苏有勇.多菌混合发酵酿造苹果醋的工艺研究[J].中国调味品,2011,36(3):84-86.
[3]KONDO T,KONDO M.Efficient production of acetic acid from glucose in a mixed culture ifZymomonasmobilisandAcetobactersp.[J].Journal of Fermentation and Bioengineering,1996,81(1):42-46.
[4]SAEKI A.Studies on acetic acid fermentation.(Part 1).Production of rice vinegar by a mixed culture of acetic acid-tolerant yeast andAcetobacterspp.[J].Journal of the Japanese Society for Food Science and Technology,1989,36(9):726-731.
[5]赵德安.混合发酵与纯种发酵[J].中国调味品,2005(3):3-6.
[6]吕慧威,孙玉梅,卢明春,等.自选酵母菌株草莓酒发酵特性比较[J].食品科学,2010,31(11):197-201.
[7]del CAMPO G,BERREGI I,SANTOS J I,et al.Development of alcoholic and malolactic fermentations in highly acidic and phenolic apple musts[J].Bioresource Technology,2008,99(8):2857-2863.
[8]du TOIT W J,LAMBRECHTS M G.The enumeration and identification of acetic acid bacteria from South African red wine fermentations[J].International Journal of Food Microbiology,2002,74(1/2):57-64.
[9]马兆瑞,祝战斌,师俊玲.苹果酒酿造技术[M].北京:中国工业出版社,2004:75-230.
[10]林仁权,胡文兰,陈国亮.重铬酸钾氧化分光光度法测定酒中乙醇含量[J].浙江预防医学,2006,18(3):78-79.
[11]沈萍,范秀容,李广武,等.微生物学实验[M].北京:高等教育出版社,2000:92-96.
[12]董晓燕.生物化学实验[M].北京:化学工业出版社,2003:58-62.
[13]黄海,文成兵,李袁林,等.酒用酵母的分离及其特性的研究[J].食品与发酵科技,2009,45(6):16-18.
[14]刘树文,王玉霞,陶怀泉,等.SO2和酒精处理对葡萄酒自然发酵酵母菌群的影响[J].西北农林科技大学学报,2008,36(5):196-200.
[15]刘长海.多菌种混合发酵黑米饮料的研究[J].食品工业科技,2003,24(6):43-45.
